ВВЕДЕНИЕ
Повторные неудачи имплантации (ПНИ) в зарубежной литературе определяются как три или более последовательные неудачные попытки имплантации в программах ЭКО с использованием не менее четырех эмбрионов высокого качества в минимум трех «свежих» или замороженных циклах при отсутствии каких-либо факторов, снижающих шансы наступления беременности [1]. В клиническом протоколе «Вспомогательные репродуктивные технологии и искусственная инсеминация» Минздрава РФ 2019 года такую клиническую ситуацию называют «Повторные неудачные попытки переноса эмбрионов (имплантации)» и относят к ней случаи трех неудачных попыток селективного (еСЕТ или еДЕТ) переноса «свежих» или размороженных эмбрионов у женщин моложе 35 лет и двух — у женщин 35 лет и старше при отсутствии каких-либо факторов, снижающих шансы наступления беременности1.
Считается, что 5% женщин страдают от привычного выкидыша, при этом у 75% из них также диагностируются ПНИ. Среди пациенток, проходящих лечение бесплодия, по разным данным, 15% страдают ПНИ [2]. В подобной ситуации клиницисты отчаянно пытаются увеличить шансы достижения клинической беременности, постоянно разрабатывая дополнительные диагностические исследования и/или вспомогательные методы лечения [3].
Имплантация эмбриона — это сложный многоэтапный биологический процесс, требующий синхронизированного молекулярного взаимодействия между эмбрионом на стадии бластоцисты и эндометрием [4]. Качество эмбриона и рецептивность эндометрия считаются ключевыми факторами, детерминирующими успешную имплантацию [5]. Эндометрий представляет собой сложную и динамичную двухслойную ткань, состоящую из функционального и базального слоев, которые в норме претерпевают ряд биохимических и морфологических изменений в течение каждого менструального цикла для достижения оптимальной рецептивности. Для того чтобы эндометрий был восприимчив к эмбриону во время окна имплантации (период, когда эндометрий лучше всего подходит для поддержки трофобластно-эндометриальных взаимодействий), стероидные гормоны яичников подготавливают эндометрий путем потенцирования ряда клеточных, иммунологических и сосудистых изменений [6].
Стромальные клетки эндометрия превращаются в увеличенные округлые децидуальные клетки, секреторные железы начинают расти, а пиноподии и микроворсинки на люминальном эпителии эндометрия развиваются и пролиферируют. Указанные клеточные трансформации сопровождаются изменением экспрессии факторов роста, молекул адгезии и цитокинов с параллельным изменением ингибирующих факторов [6]. Это приводит к инфильтрации иммунных клеток и вторжению кровеносных сосудов в эндометрий [7]. В течение четко определенного окна имплантации эмбрион высокого качества идеально подходит для трех фаз имплантации: аппозиции (аpposition), прикрепления или прилипания (attachment, adhesion) и инвазии (invasion) в рецептивный эндометрий [7].
Именно поэтому эндометриальные факторы, а именно нарушения архитектоники и аберрантную экспрессию различных факторов рецептивности, исследователи считают ведущей причиной ПНИ, поскольку в данной клинической ситуации всегда переносятся эмбрионы высокого качества [8, 9, 10]. Кроме того, исследования показали, что около двух третей неудач имплантации связаны с субоптимальной рецептивностью эндометрия и нарушением перекрестного взаимодействия между эмбрионом и эндометрием [11].
В связи с изложенным изучение механизмов патогенеза имплантационной несостоятельности в аспекте нарушения рецептивности эндометрия при ПНИ в рамках повышения эффективности программ ЭКО представляет значительный интерес для практического здравоохранения и для женщин, планирующих использование ВРТ. Все вышеизложенное определило выбор цели и задач настоящего исследования.
Цель исследования: расширить представления о патогенезе нарушений рецептивности эндометрия у пациенток с ПНИ в программах ЭКО.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование включены 57 женщин (основная группа) в возрасте от 27 до 42 лет (средний возраст составил 36 ± 6,2 года) с клинически верифицированными ПНИ, согласно клиническому протоколу «Вспомогательные репродуктивные технологии и искусственная инсеминация». Группу морфологического контроля составили 30 фертильных женщин, имевших в анамнезе 2 и более родов доношенными здоровыми детьми и не имевших нарушений фертильности, давших добровольное информированное согласие на участие в исследовании.
Материалом исследования являлись биоптаты эндометрия, полученные путем пайпель-биопсии на 5–7-й день после пика концентрации ЛГ в крови (окно имплантации). Полученные биоптаты после фиксации в 10%-ном забуференном формалине и гистологической обработки в автоматическом гистопроцессоре Leica ASP 30 (Германия) заливали в парафин на станции Leica EG 1150 (Германия). Производилась окраска срезов толщиной 4 микрометра гематоксилином и эозином при помощи станции Leica ST5010 (Германия).
Обзорное микроскопическое исследование материала осуществлялось с помощью микроскопа Leica DMLB и цифровой камеры Leica DFC420 (Германия). В полученных микропрепаратах производилась патоморфологическая оценка состояния эндометрия.
Иммуногистохимическое исследование эндометрия с антителами с целью изучения морфофункционального состояния эндометрия в период окна имплантации (морфологически ранняя стадия фазы секреции) проводили с антителами к MUC1 — клон MRQ-17 Cell marque, фактору Виллебранда (VWF) — клон 36B11 Leica Bond, CD34+ — клон QBEnd/10 Leica Bond, CD4+ (Т-лимфоциты) — клон SP35 Ventana, CD8+ (Т-лимфоциты) — клон SP57 Ventana, рецепторам эстрогена (ER) α — клон GF11 Leica Bond, рецепторам прогестерона (PR) АВ — клон 1E2 Ventana, CD56+ NK — клон CD564 Leica Bond. Иммуногистохимическое окрашивание производилось в иммуностейнере Ventana BenchMark Ultra IHdSH (США), Bond-Max (Германия). Для иммуноокрашивания использовали систему визуализации Ultra Vision TL-015-HD Lab Vision.
Экспрессию иммуногистохимических маркеров изучали в трех неперекрывающихся полях зрения при 400-кратном увеличении с помощью микроскопа Leica DMLB и цифровой камеры Leica DFC420 (Германия).
Для определения нормальности распределения параметров применен критерий Колмогорова — Смирнова. Результаты иммуногистохимического исследования представлены в виде суммы DAB-позитивных клеток в полях зрения при 400-кратном увеличении. Все данные отображены в виде медианного значения — Me (25%; 75%).
Статистическое сравнение групп осуществлялось при помощи непараметрических методов. Для выявления статистической значимости результатов использовался критерий Манна — Уитни. В случае оценки качественных признаков применен двусторонний критерий Фишера. Результаты считали статистически значимыми при р < 0,05.
Обработку данных производили с использованием пакета программ электронных таблиц Microsoft Excel и программы IBM SPSS Statistics 26.
РЕЗУЛЬТАТЫ
В эндометрии пациенток с ПНИ в период окна имплантации наблюдались изменения экспрессии исследуемых маркеров рецептивности в сравнении с показателями группы морфологического контроля (табл.).
Таблица
Результаты иммуногистохимического исследования биоптатов эндометрия пациенток с повторными неудачами имплантации и фертильных женщин, Me (25%; 75%)
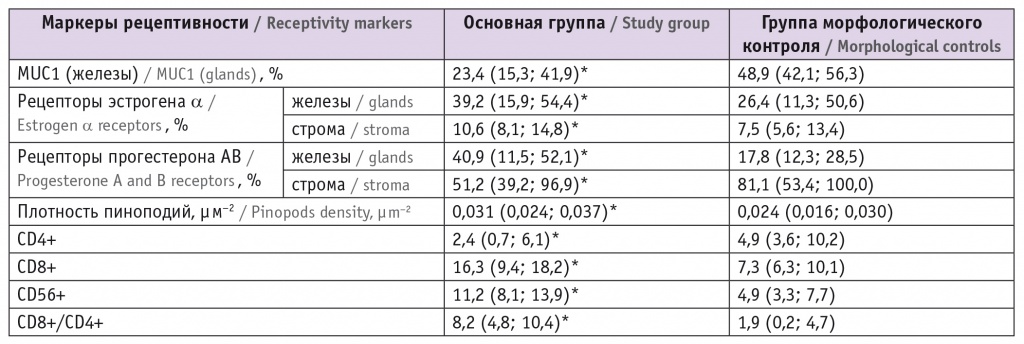
* Отличия от группы морфологического контроля статистически значимы (р < 0,05).
В период окна имплантации у пациенток с ПНИ установлены изменения имплантационной состоятельности эндометрия, характеризующиеся прежде всего уменьшением числа зрелых и созревающих пиноподий вплоть до их отсутствия на апикальной поверхности эндометрия (морфологически ранняя стадия фазы секреции) на срезах, окрашенных гематоксилином и эозином (рис. 1 А, В).
Рис. 1. Эндометрий соответствует ранней-средней стадии фазы секреции. А — фокус отсутствия пиноподий на апикальной поверхности эндометрия (стрелка) у пациентки с бесплодием 2, повторными неудачами имплантации (ПНИ); В — равномерное расположение пиноподий на всем протяжении апикальной поверхности эндометрия у пациентки группы морфологического контроля; C — иммуногистохимия с антителом к MUC1, фокусы отсутствия или уменьшения экспрессии на апикальной поверхности эндометрия (стрелки) у пациентки с бесплодием 2, ПНИ; D — равномерное распределение пиноподий у пациентки группы морфологического контроля. Здесь и далее иллюстрации Мидибера К.Ю., 400-кратное увеличение. A, B — окраска гематоксилином и эозином, C, D, — иммуногистохимическое окрашивание
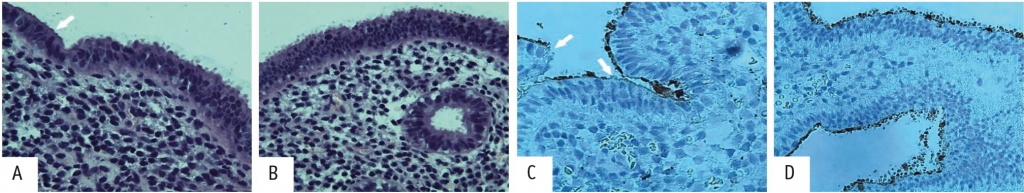
При проведении иммуногистохимической реакции с маркером MUC1 определялась неравномерная окраска, а в фокусах отсутствия пиноподий у пациенток с ПНИ выявлена негативная реакция (рис. 1С) в отличие от группы морфологического контроля, в которой реакция на всем протяжении на апикальной поверхности эндометрия была равномерной положительной (рис. 1D).
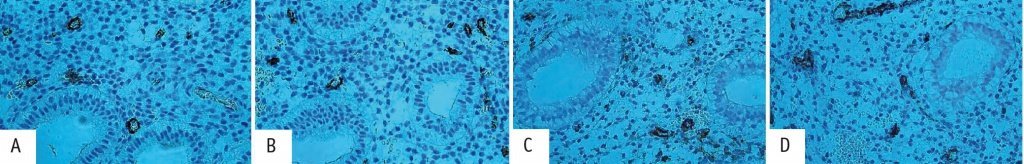
Для сравнения процессов ангиогенеза в эндометрии у пациенток с ПНИ и здоровых женщин нами проведено иммуногистохимическое исследование с маркерами VWF и CD34+, продемонстрировавшее статистически незначимое увеличение числа кровеносных сосудов, экспрессии их в эндотелии (рис. 2).
Рис. 2. Положительная экспрессия в эндотелии кровеносных сосудов: иммуногистохимия с антителом к фактору Виллебрандта у пациентки с бесплодием 2, повторными неудачами имплантации (ПНИ) (А) и участницы группы морфологического контроля (В); иммуногистохимия с антителом к CD34+ у пациентки с бесплодием 2, ПНИ (С) и участницы группы морфологического контроля (D). Здесь и в рисунке 3 — иммуногистохимическое окрашивание
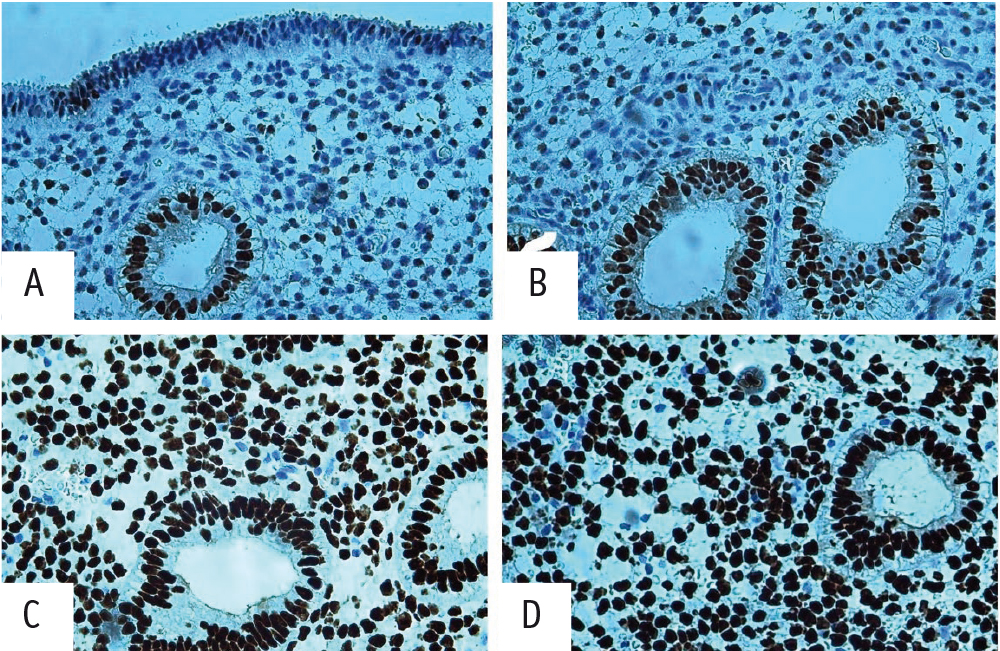
Следующим этапом стало изучение иммуногистохимических реакций с антителами к половым гормонам: ERα и PR-АВ (рис. 3). Обращают на себя внимание статистически значимые увеличение числа экспрессированных клеток с антителом к ERα в железах и строме эндометрия (в 1,5 и 1,4 раза) у пациенток основной группы (см. рис. 3А) и снижение экспрессии к рецепторам PR-АВ в строме эндометрия (в 1,6 раза) при одновременном повышении уровня этого маркера в эпителии маточных желез (в 2,3 раза) (см. рис. 3С) по сравнению с таковыми у здоровых женщин (см. рис. 3 В, D).
Рис. 3. Иммуногистохимия: А, В — положительная экспрессия к рецепторам эстрогена в железах и строме эндометрия в обеих группах; С — положительная экспрессия к рецепторам прогестерона в железах при уменьшении числа положительных клеток в строме эндометрия у пациентки с бесплодием 2, повторными неудачами имплантации; D — положительная равномерная экспрессия к рецепторам прогестерона в железах и строме эндометрия у пациентки группы морфологического контроля
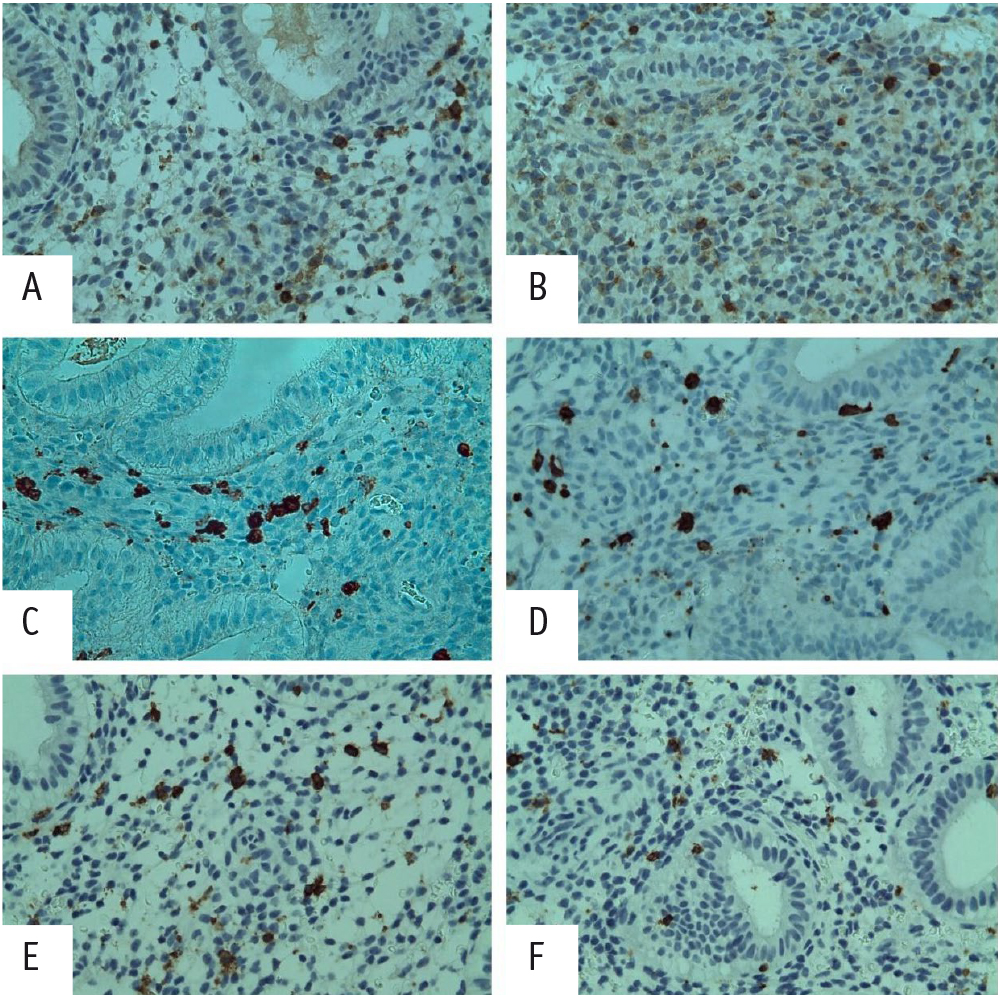
В предыдущем исследовании нами была проведена иммуногистохимическая оценка местного иммунитета в эндометрии пациенток с ПНИ, морфологически соответствующего средней стадии фазы пролиферации, продемонстировавшая дисбаланс между Т-лимфоцитами (СD4+, CD8+) в пользу CD8+, а также увеличение почти в 2 раза уровня CD56+ NK-клеток. Выполненное иммуногистохимическое исследование с вышеуказанными маркерами в период окна имплантации (ранняя стадия фазы секреции) подтвердило сохранение дисбаланса между Т-лимфоцитами и увеличение количества CD56+ клеток по сравнению с таковым в группе морфологического контроля (рис. 4).
Рис. 4. Иммуногистохимия с антителом к CD4+ — уменьшение количества положительных клеток у пациентки с бесплодием 2, повторными неудачами имплантации (ПНИ) (А) по сравнению с таковым у участницы группы морфологического контроля (В). Иммуногистохимия с антителом к CD8+ — увеличение количества положительных клеток у пациентки с бесплодием 2, ПНИ (С) по сравнению с показателем группы морфологического контроля (D). E — положительная экспрессия CD56+; 28 клеток в поле зрения у пациентки с бесплодием 2, ПНИ. F — положительная экспрессия CD56+; 10 клеток в поле зрения у пациентки группы морфологического контроля
ОБСУЖДЕНИЕ
Успешная имплантация требует адгезии эмбриона к эндометрию и его последующей инвазии в нижележащий стромальный слой. На события во время имплантации и ранней беременности серьезное влияние оказывают стероидные гормоны яичников, 17β-эстрадиол и прогестерон [12]. Молекулярные механизмы, посредством которых стероид-регулируемые пути контролируют эти процессы, интенсивно исследуются во многих лабораториях по всему миру, однако установлено, что регуляторное воздействие стероидных гормонов в первую очередь детерминировано экспрессией рецепторов к ним — к эстрогену α и β и прогестерону А и В соответственно [12].
Большое количество данных литературы свидетельствует о том, что эстроген и прогестерон, действуя через свои рецепторы, регулируют пролиферацию, дифференцировку и выработку секреторных белков в матке, необходимых для имплантации [13]. Соответственно, динамическая картина экспрессии рецепторов к ним наблюдается как в эпителиальном, так и в стромальном компартменте матки во время всего репродуктивного цикла и беременности.
После овуляции, оплодотворения и прогрессивного развития полученной зиготы до стадии активированной бластоцисты повышение уровня системного прогестерона вызывает пролиферацию стромальных клеток эндометрия, которая еще больше усиливается небольшим нидативным скачком уровня эстрогена [14]. Параллельно прогестерон подавляет эстроген-индуцированную пролиферацию эпителия эндометрия, что приводит к переходу эпителия из пролиферативного в дифференцированное состояние и временному переходу в состояние, благоприятное для прикрепления и инвазии эмбриона [14, 15].
Ранние исследования J.P. Lydon и коллег с использованием модели мыши с выключением локуса, отвечающего за экспрессию PR (PRKO), в которой обе изоформы PR были одновременно удалены [15], подчеркнули незаменимость опосредованной ядерными рецепторами прогестероновой сигнализации в развитии рецептивности и децидуализации эндометрия.
Окружая инвазирующую эндометрий бластоцисту, децидуальные клетки обеспечивают гистотрофное питание, иммунотолерантную микросреду, процесс отбора нежизнеспособных эмбрионов и защиту от физиологических стрессовых факторов, а также от чрезмерной инвазии эмбриона в матку [16].
В свою очередь, эстроген играет важную, но ограниченную роль в имплантации эмбриона. Мессенджер РНК ER1 обнаруживается как в эпителиальных, так и в стромальных клетках эндометрия в пролиферативной фазе, но уровень его экспрессии снижается в ранней секреторной фазе под влиянием лютеинового прогестерона [17]. Экспрессия транскриптов ER1 и ER2 падает до необнаруживаемого уровня к середине секреторной фазы в окне имплантации в функциональном слое, что позволяет предположить, что снижение пролиферативного воздействия эстрогенов в секреторной фазе необходимо для успешной имплантации. Действие эстрогена может не требоваться для нормального секреторного развития эндометрия после овуляции и даже способно препятствовать имплантации [18].
Вышесказанное позволяет сделать вывод, что выявленная в нашем исследовании аберрантная экспрессия рецепторов к эстрогену и прогестерону обусловливает нарушения рецептивной способности эндометрия в окне имплантации у пациенток с ПНИ. Дезрегуляция активности стероидных гормонов в результате нарушенной экспрессии рецепторов приводит к изменениям архитектоники эндометрия и имплантационной несостоятельности.
Эти данные также подтверждаются изменением экспрессии маркера адгезии MUC1 на апикальной поверхности эндометрия и снижением числа пиноподий, местами вплоть до полного их отсутствия, у пациенток с ПНИ в отличие от здоровых женщин.
Хотя точная роль MUC1 в имплантации до сих пор не изучена, многие исследования показали, что экстремально низкий уровень MUC1 связан с нарушением рецептивности эндометрия [19]. Недавнее исследование продемонстрировало, что содержание данного маркера значительно снижено у пациенток с нарушениями имплантации [20].
Это позволяет предположить, что уменьшение экспрессии MUC1 в эндометрии является маркером рецептивности при ПНИ во время окна имплантации. Регуляция экспрессии MUC1 также опосредована экспрессией и активацией рецепторов к прогестерону и эстрогену [21]. В нашем исследовании продемонстрировано снижение экспрессии MUC1 у пациенток с ПНИ по сравнению с таковой в группе морфологического контроля.
Эндометриальные пиноподии — это микроскопические образования апикальной клеточной мембраны функционального слоя, которые проходят различные морфофункциональные стадии развития по мере течения лютеиновой фазы менструального цикла. На сегодняшний день исследователями описаны развивающиеся, полностью развитые и пиноподии в стадии регресса, каждая из стадий длится примерно 24 ч [22].
Функция пиноподий не вполне известна. Согласно исследованиям in vitro, они в стадии расцвета могут способствовать прикреплению бластоцисты [23]. Пиноподии неоднократно предлагались в качестве надежного маркера окна имплантации [23].
В настоящем исследовании отмечено статистически значимое уменьшение числа зрелых и созревающих пиноподий вплоть до их полного отсутствия у женщин с ПНИ. Это можно объяснить тем, что в эндометрии пациенток с ПНИ пиноподии не достигают состояния полного созревания. По этой же причине плотность пиноподий у пациенток с ПНИ была в 1,3 раза больше, чем у здоровых женщин.
Маточные натуральные киллеры (uNK) являются доминирующими лимфоцитами в поздней лютеиновой фазе, составляя > 30% клеток в строме эндометрия, их количество увеличивается на всех стадиях лютеиновой фазы [24]. CD56+ uNK-клетки являются частью врожденной иммунной системы и отличаются от своих периферических аналогов NK-клеток, проявляя пониженную цитотоксичность и демонстрируя высокую экспрессию поверхностного маркера CD56+ и низкую экспрессию CD16+, однако при активации они способны вызывать клеточный апоптоз в клетках-мишенях [25].
В условиях высоких концентраций прогестерона количество CD56+CD16– uNK-клеток увеличивается, и их роль в секреторной фазе заключается в ремоделировании сосудов эндометрия, ангиогенезе и модуляции фето-материнского взаимодействия [26,27].
Отмеченное в нашем исследовании повышение экспрессии CD56+ клеток свидетельствует о вероятном смещении экспрессии uNK-клеток в сторону их цитотоксических форм CD16+.
Крайне важный результат нашего исследования — подтверждение выявленного нарушения в местном иммунитете у пациенток с ПНИ: увеличение числа CD8+ клеток Т-супрессоров и снижение числа CD4+ клеток Т-хелперов, ответственных за реализацию иммунной толерантности к собственным и чужеродным антигенам [27]. Дисбаланс между Т-лимфоцитами в пользу CD8+ клеток и увеличение числа CD56+ NK, зафиксированные как в период окна имплантации (настоящее исследование), так и в средней стадии фазы пролиферации (ранее), могут быть расценены как ведущие иммунологические звенья в патогенезе ПНИ.
Проведенное исследование с маркерами к эндотелию кровеносных сосудов VWF и CD34+ не выявило значимых различий по числу кровеносных сосудов в эндометрии у участниц обеих групп.
ЗАКЛЮЧЕНИЕ
Патогенез нарушений рецептивности в эндометрии пациенток с повторными неудачами имплантации (ПНИ) может быть объяснен нарушением экспрессии рецепторов к прогестерону А и В и эстрогену α в строме и железистом компоненте. Эти изменения приводят к дезрегуляции нормальных морфофункциональных изменений эндометрия в период окна имплантации, что подтверждается повышением плотности пиноподий и снижением экспрессии MUC1 на апикальной поверхности эндометрия пациенток с ПНИ.
Обнаруженное увеличенное число экспрессированных CD56+ NK-клеток в эндометрии в период окна имплантации у пациенток обеих групп (у пациенток с ПНИ экспрессия CD56+ значимо выше) в сочетании с дисбалансом между Т-лимфоцитами, снижением числа зрелых и созревающих пиноподий на апикальной поверхности эндометрия и экспрессии MUC1 объясняют нарушение имплантации, клинически проявляющееся ПНИ.
Поступила: 12.10.2021
Принята к публикации: 19.11.2021
________
1 Абубакиров А.Н., Адамян Л.В., Аншина М.Б. и др. Клинические рекомендации (протокол лечения) «Вспомогательные репродуктивные технологии и искусственная инсеминация» от 21 февраля 2019 года № 15-4/466-07.








