Новообразования яичников — одна из актуальных проблем гинекологии, они являются наиболее частым показанием к хирургическому вмешательству на органах малого таза у женщин. Выявляемость опухолей яичников составляет 7,8% у женщин репродуктивного возраста и 2,5–18,0% в постменопаузе. При этом у 87,0% молодых женщин диагностированные опухоли имеют доброкачественную структуру, у 45,0% пациенток постменопаузального возраста верифицируется рак яичника [1–4].
Совершенствование неинвазивных методов диагностики опухолей яичников, основанных на сочетании клинических данных, онкомаркеров и визуализационных методик и обладающих высокой информативностью, представляет огромный научный и практический интерес [5, 6]. В настоящее время в качестве предоперационных дифференциальнодиагностических тестов при новообразованиях яичников используют математический алгоритм оценки риска рака яичников (Risk of Ovarian Malignancy Algorithm), учитывающий показатели онкомаркеров СА125 и НЕ4, а также расчет индекса риска злокачественности (Relative Malignancy Index, RMI), объединяющего возраст женщины, ультразвуковые характеристики опухоли и уровень CA125, которые в совокупности могут применяться в качестве дифференциальнодиагностического критерия объемных образований яичников [7–10].
Модифицированная оценка RMI в настоящее время считается наиболее информативной в дифференциальнодиагностическом поиске у пациенток с новообразованиями яичников по сравнению с другими критериями злокачественных овариальных опухолей [11].
Цель исследования: изучение диагностической значимости RMI при дифференциальной диагностике истинных опухолей яичников, опухолевидных образований и процессов.
МАТЕРИАЛЫ И МЕТОДЫ
Проведено комплексное клиниколабораторное обследование 259 женщин, из которых 69 (26,6 ± 2,7%) — здоровые, 126 (48,7 ± 3,1%) — пациентки с доброкачественными новообразованиями яичников, 64 (24,7 ± 2,7%) — больные овариальным раком. Исследование выполнено в 2007–2017 гг. на базе ФГБУ «Российский научный центр рентгенорадиологии» Минздрава России и ГБУЗ «Московский клинический научный центр имени А. С. Логинова Департамента здравоохранения города Москвы». Возраст обследованных варьировал от 22 до 79 лет и в среднем составил 56,1 ± 19,1 года, при этом соотношение обследованных репродуктивного и постменопаузального возраста — 40% и 60% соответственно.
Проведенное исследование основывалось на анализе расчета показателя RMI по следующей формуле [8]:
RMI = М × U × CA125,
где M — показатель, зависящий от менструального статуса женщины (М = 1 — репродуктивный возраст, М = 4 — постменопауза, которая определяется как отсутствие менструаций в течение одного года у пациенток старше 50 лет, а также перенесших гистерэктомию); U — показатель, соответствующий результатам УЗИ: по одному баллу начисляется при оценке ультразвуковых данных (размеров опухоли, многокамерности, солидных включений, локализации, наличия метастазов), соответственно U = 1 при выявлении какоголибо из эхографических критериев, U = 4, если выявлены 2 или более дифференциальнодиагностических признаков); и наконец, CA125 — абсолютные значения концентрации маркера СА125 в сыворотке крови больной (табл. 1).
Таблица 1
Расчет индекса риска злокачественности
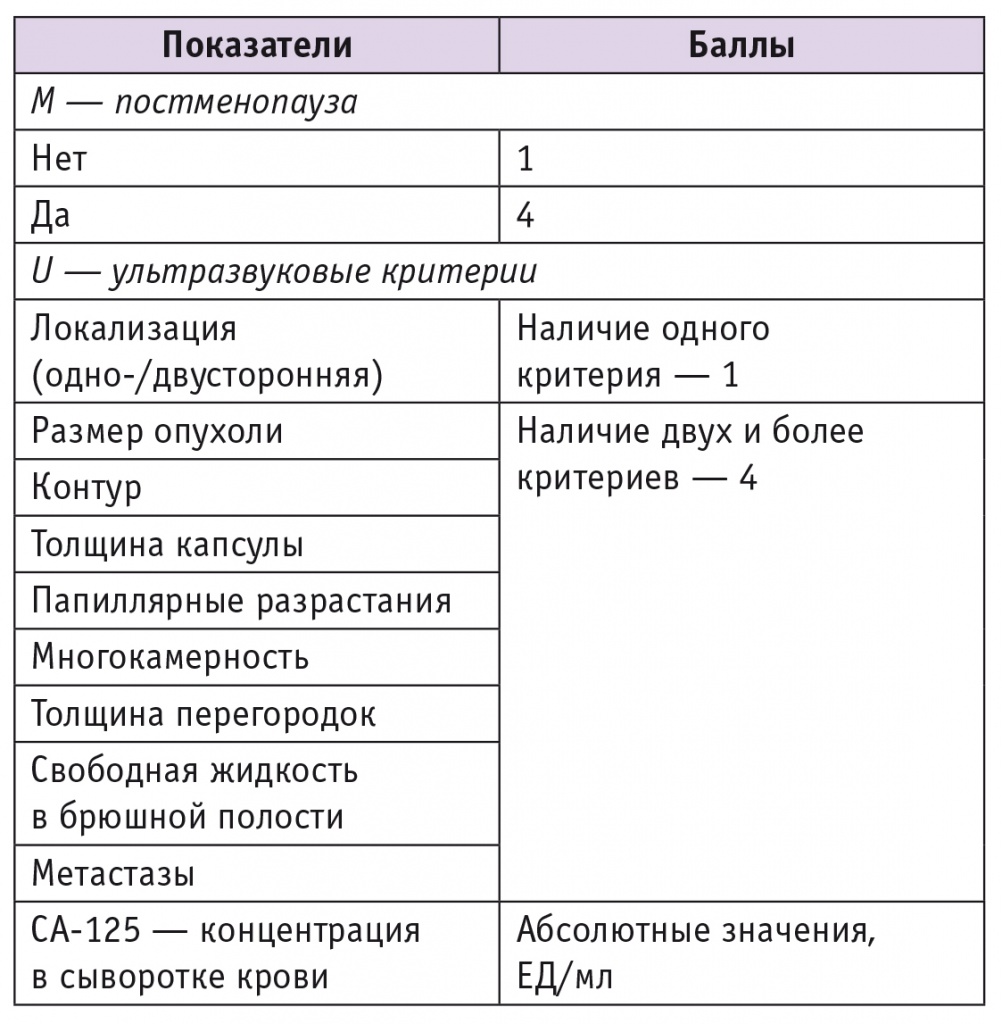
Значения RMI < 25 соответствовали низкому риску малигнизации, 25–200 — промежуточному риску и > 200 — высокому риску.
Данные представлены в виде M ± m, где M — среднее арифметическое, m — ошибка среднего. Для оценки статистической значимости различий использовали критерий Стьюдента (t), критический уровень значимости принимался ≤ 0,05. В представленных таблицах приведены коэффициенты только статистически значимых различий.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Проведенное исследование выявило, что среди пациенток с новообразованиями яичников было 64 (33,7 ± 3,4%) женщины репродуктивного возраста, из них у 48 (75,0 ± 5,4%) диагностировали доброкачественные опухоли и опухолевидные образования яичников, у 2 (3,1 ± 2,2%) — пограничные опухоли, у 14 (21,9 ± 5,2%) — овариальный рак (табл. 2). В периоде постменопаузы находились 126 (66,3 ± 3,4%) пациенток, 78 (61,9 ± 4,3%) из них имели доброкачественные опухоли и 48 (38,1 ± 4,3%) — злокачественные заболевания яичников.
Таблица 2
Распределение гистологических вариантов опухолей у больных в зависимости от менструального статуса, n (%)

* Отличия от больных в постменопаузе статистически значимы (p < 0,05).
Средний возраст женщин с доброкачественными новообразованиями составил 46,7 ± 10,1 года, с карциномами яичников — 60,2 ± 14,3 года (р > 0,05). Обследованные в постменопаузе имели более высокую частоту как доброкачественных опухолей, так и рака яичников (р < 0,001). Наиболее высокая заболеваемость яичниковыми новообразованиями отмечалась в группе женщин в возрасте 51–60 лет.
При гистологическом исследовании в группе женщин репродуктивного возраста обнаружились эпителиальные (серозная и муцинозная цистаденома), герминогенные (зрелая кистозная тератома), соединительнотканные опухоли (фиброма, опухоль стромы полового тяжа, или текома). У каждой третьей пациентки репродуктивного возраста выявлялись эндометриоидные кисты яичников, около 15% составили фолликулярные и параовариальные кисты.
Пограничные опухоли были представлены серозной цистаденомой.
Среди злокачественных опухолей также преобладал эпителиальный рак — серозная, папиллярная, муцинозная цистаденокарциномы.
У пациенток в постменопаузе около 40% доброкачественных новообразований яичников составили истинные эпителиальные опухоли — серозная и муцинозная цистаденома, реже обнаруживались соединительнотканные опухоли и опухоли стромы полового тяжа. Чуть более трети доброкачественных опухолей яичников были представлены опухолевидными образованиями (простыми серозными и параовариальными кистами) и процессами (стромальным гипертекозом, фиброматозом). Более 80% злокачественных новообразований яичников составили эпителиальные опухоли (серозная, папиллярная, муцинозная аденокарциномы).
Среди пациенток, у которых был диагностирован рак яичников, наиболее часто выявлялась III стадия заболевания (Classification of ovarian cancer International Federation of Gynecology and Obstetrics, 2014) — у 40 (64,5 ± 6,1%) женщин. В 10 (16,1 ± 4,5%) наблюдениях обнаруживалась IV стадия; в 8 (12,9 ± 4,5%) — II стадия, в 4 (6,3 ± 3,0%) опухоль соответствовала I стадии злокачественного процесса.
До настоящего времени одним из наиболее сложных аспектов использования УЗИ в гинекологии остается определение дифференциальнодиагностических критериев образований яичников [6, 12]. В проведенном исследовании эхографические признаки систематизировались с позиций их соотнесения с другими клиническими, лабораторными и инструментальными данными. Значимые различия ультразвуковых критериев выявлялись между пациентками с доброкачественными и злокачественными новообразованиями яичников — в 40 (62,5 ± 6,1%) наблюдениях у пациенток с двумя и более эхопризнаками придаткового образования впоследствии верифицировался рак против 23 (18,2 ± 6,1%) в группе доброкачественных новообразований (р = 0,002). У 103 (81,8 ± 3,5%) обследованных при выявлении не более одного признака диагностировались доброкачественные новообразования яичников (истинные кисты и опухолевидные образования и процессы) (р > 0,001).
В клинической практике широко используется определение уровня маркера СА125. До настоящего времени прогностическая значимость повышения концентрации СА125 для формирования группы риска овариального рака изучается. Известно, что СА125 не является строго специфичным маркером только для рака яичников, его уровень может быть повышен при эндометриозе, миоме матки, заболеваниях ЖКТ, опухолях молочной железы и бронхов. В репродуктивном возрасте содержание СА125 может варьироваться в зависимости от фазы менструального цикла [5, 9, 10]. Тем не менее многочисленными многоцентровыми исследованиями установлено, что вероятность наличия злокачественной опухоли яичников с максимальной точностью можно определить при аддитивном изучении уровня CA125 и использовании визуализационных методов (УЗИ, МРТ, КТ) [6].
Средний уровень СА125 в сыворотке крови здоровых женщин и больных доброкачественными новообразованиями яичников не различался, хотя и имел тенденцию к повышению при опухолях (12,8 ЕД/мл против 24,2 ЕД/мл соответственно) и значительно превышал референсные значения у больных раком — 167,2 ЕД/мл. Необходимо отметить, что только в 6 (50%) наблюдениях у больных с I–II стадией рака отмечалось увеличение концентрации этого онкомаркера, тогда как при III–IV стадиях опухолевого процесса оно имело место у 43 (86,0%) пациенток (р < 0,001). При концентрации 50 ЕД/мл злокачественные опухоли яичников диагностировались у 78% больных, что демонстрирует достаточно высокую значимость этого маркера в качестве предиктора злокачественного процесса.
Анализ рассчитанного RMI, проведенный с учетом всех изученных параметров, показал его высокую эффективность для идентификации доброкачественных новообразований и рака яичников (рис.).
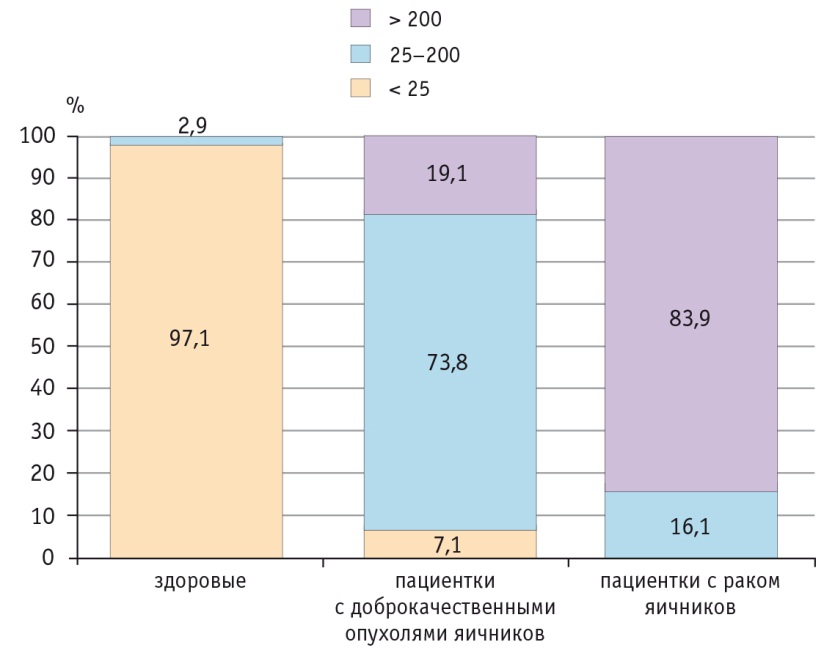
В группе здоровых женщин более 90% имели значения RMI менее 25, при доброкачественных опухолях, опухолевидных образованиях и процессах превалировали значения 25–200, составив более 70%, в то же время у большинства больных раком значения RMI были более 200. Показательной является дифференциальнодиагностическая значимость RMI у участниц с опухолевидными образованиями и процессами — у всех пациенток на этапе обследования RMI не превышал 25, тогда как при истинных доброкачественных опухолях яичников он в большинстве случаев соответствовал значениям более 25 и не выходил за пределы 200, что позволяет эффективно дифференцировать необходимость хирургического вмешательства и тактику мониторинга.
Уровни RMI более 200 отмечались у пациенток с доброкачественными новообразованиями яичников, которые морфологически соответствовали эндометриоидным кистам в сочетании с распространенным эндометриозом брюшины малого таза, а также муцинозным цистаденомам. У всех пациенток с пограничными опухолями RMI превышал 200. При злокачественных новообразованиях яичников у 8 (12,9 ± 4,3%) женщин с эпителиальными опухолями и у 2 (3,2 ± 2,2%) со светлоклеточной карциномой RMI не превышал 200.
ЗАКЛЮЧЕНИЕ
Наиболее эффективным с точки зрения дифференциальной диагностики доброкачественных и злокачественных объемных образований яичников можно считать комплексный подход, который объединяет разнообразные по своей специфичности и чувствительности биомаркеры и специально разработанные статистические алгоритмы. Проведенное исследование свидетельствует о высокой информативности применения индекса риска злокачественности (Relative Malignancy Index, RMI) на первичном этапе дифференциальной диагностики в качестве базового критерия формирования групп риска по развитию овариального рака у пациенток с объемными образованиями яичников.
Эффективный дифференцированный подход в зависимости от уровня RMI как кумулятивного показателя результатов использования нескольких методик обследования позволяет оптимизировать медикоорганизационные аспекты ведения больных с новообразованиями яичников, корректировать тактику их ведения, повысить качество оказания специализированной медицинской помощи.








