Проблема лечения и профилактики гиперплазии эндометрия (ГПЭ) в перименопаузе является одной из самых актуальных для гинекологии в связи с высокой распространенностью заболевания у женщин перименопаузального возраста [1, 2, 5, 6, 10, 12]. Неослабевающий интерес к ней определяется тенденцией ГПЭ к длительному рецидивирующему течению, отсутствием специфических (патогномоничных) симптомов, а также сложностью дифференциальной диагностики и выбора методов лечения [1, 5, 10, 12].
С современных позиций гиперплазию эндометрия рассматривают как полиэтиологический патологический процесс, развитию и прогрессированию которого могут способствовать различные факторы. Одним из таких факторов является возраст пациентки, перименопаузальный период жизни, когда в результате гормональных перестроек создаются предпосылки для возникновения гиперпластических процессов в репродуктивной системе [1, 2, 5, 9–12]. В исследованиях последних лет показано, что ХЭ также входит в число факторов риска развития ГПЭ [4, 7, 8, 10].
Согласно современным представлениям, ХЭ рассматривают как клинико-морфологический синдром, при котором вследствие персистирующего повреждения инфекционным агентом развиваются множественные вторичные морфологические и функциональные изменения, нарушающие циклическую биотрансформацию и рецептивность слизистой оболочки матки [4]. Принято считать, что у абсолютного большинства пациенток эндометрит является первичным, реализованным инфекционным процессом, развившимся в результате внедрения микроорганизмов, передаваемых половым путем, или вследствие размножения условно-патогенной микрофлоры после внутриматочных манипуляций. Лишь у 5% женщин он носит вторичный характер, развиваясь при попадании инфекции в эндометрий из экстрагенитальных очагов гематогенным, лимфогенным или нисходящим путем [4].
Частота морфологически верифицированного бессимптомно протекающего ХЭ, по данным различных авторов, варьирует от 10% до 85% [4, 5, 7], не имея тенденции к снижению.
Среди факторов способствующих хронизации воспалительного процесса в эндометрии, следует назвать несвоевременную диагностику и неадекватную терапию, незавершенность заключительной фазы воспаления, нарушения тканевого гомеостаза, повышенную активность регенераторных процессов в ткани, роль вирусной и условно-патогенной микрофлоры, способной к персистенции в пораженных тканях [3–5, 7].
Важно подчеркнуть, что длительное течение ХЭ сопряжено с развитием вторичных морфофункциональных изменений эндометрия — активации склеротических процессов с повреждением экстрацеллюлярного матрикса, нарушения медиаторных межклеточных взаимодействий, изменения ангиоархитектоники ткани и ее ишемии [4, 7].
Все вышесказанное позволяет выдвинуть научную гипотезу о влиянии предсуществующего хронического эндометрита на исход лечения гиперплазии эндометрия у пациенток в перименопаузе, что определило актуальность настоящего исследования оптимизации тактики ведения больных с ГПЭ на фоне ХЭ в перименопаузе, которая должна быть направлена на создание адекватных комплексных подходов к их лечению.
Цель настоящего исследования: улучшить исход лечения пациенток перименопаузального возраста с ГПЭ в сочетании с ХЭ.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проводили на базе гинекологического отделения клиники № 1 Волгоградского государственного медицинского университета (главный врач — Зюбина Е. Н., д. м. н., профессор) и гинекологического отделения Волгоградского областного перинатального центра № 2 (главный врач —Веровская Т. А., главный внештатный акушер-гинеколог, заслуженный врач РФ) в 2014–2015 гг.
Выполнено комплексное клинико-лабораторное обследование 64 пациенток в возрасте от 45 до 55 лет с гиперплазией эндометрия в сочетании с ХЭ. Критериями включения в исследование стали: 1) возраст от 45 до 55 лет; 2) наличие морфологически подтвержденной гиперплазии эндометрия (простая гиперплазия эндометрия (ПГЭ) без атипии, сложная гиперплазия эндометрия (СГЭ) без атипии) в сочетании с ХЭ; 3) информированное добровольное согласие пациенток на проведение необходимых лечебно-диагностических мероприятий.
Критерии исключения: 1) полипы эндометрия; 2) атипическая гиперплазия и рак эндометрия; 3) миома матки больших размеров, субмукозная локализация миоматозных узлов; 4) наружный генитальный и экстрагенитальный эндометриоз, аденомиоз II–III cтепени; 5) острые воспалительные заболевания органов малого таза; 6) ИППП; 8) опухоли яичников; 9) сердечно-сосудистые заболевания, тяжелые формы сахарного диабета, гипо- и гипертиреоза, почечной и печеночной недостаточности, острого тромбофлебита.
Динамическое наблюдение за пациентками проводили в течение 6 месяцев. Согласно протоколу исследования исходно, через месяц после окончания двухэтапной терапии ХЭ (первый этап включал назначение системной антибактериальной терапии в сочетании с внутриматочным введением Катеджеля с лидокаином; на втором этапе вагинально вводили полифункциональный ферментный препарат пролонгированного действия Лонгидаза), через 6 месяцев после гормональной терапии ГПЭ осуществляли клинико-морфологический, ультразвуковой, иммуногистохимический и бактериологический мониторинг состояния больных.
Всем пациенткам при поступлении в стационар была выполнена гистероскопия с раздельным диагностическим выскабливанием и последующим гистологическим исследованием соскобов слизистой полости матки и цервикального канала. Показаниями к их выполнению явились аномальные маточные кровотечения, а также подозрение на патологию эндометрия по данным ультразвукового сканирования. Через месяц от начала лечения ХЭ выполняли аспирационную биопсию эндометрия, через 6 месяцев от начала гормональной терапии — контрольную гистероскопию с биопсией эндометрия.
Трансвагинальное ультразвуковое исследование проводили с помощью цифровой диагностической системы ультразвукового сканирования Voluson E8 через 1, 3 и 6 месяцев после окончания терапии: оценивали размеры матки, структурные особенности миометрия, эндометрия, яичников; особое внимание обращали на величину и структуру срединного М-эха.
Исходно и после окончания двухэтапной терапии ХЭ осуществляли бактериологический контроль материала, полученного из цервикального канала.
В ходе иммуногистохимического исследования экспрессии рецепторов к половым стероидным гормонам: эстрогенам (ER-α) и прогестерону (PR) изучили 74 образца ткани эндометрия, полученные от 64 пациенток с ПГЭ и СГЭ и 10 здоровых женщин, обратившихся для подбора контрацепции, которым в среднюю фазу пролиферации была выполнена биопсия эндометрия. Перед проведением иммуногистохимического исследования материал фиксировали в 10%-ном растворе нейтрального формалина в течение 24 часов и заливали в парафин. Депарафинированные срезы ткани эндометрия помещали на высокоадгезивные предметные стекла, использовали моноклональные антитела (Dako Cytomation, Дания) к ER-α (1 : 35) и PR (1 : 50). Для восстановления антигенной активности срезы подвергали обработке 0,01 М-цитратным буфером с рH 6,0 в течение 15 минут в мини-автоклаве 2001 Retriever (Pick Cell, Нидерланды). Затем срезы инкубировали с 0,3%-ным пероксидом водорода для блокирования эндогенной активности пероксидазы, обрабатывали нормальной козьей сывороткой для снижения неспецифического связывания и инкубировали со специфическими первичными антителами при 40 °C в течение 12 часов. Для инкубации использовали иммуностейнер Envision+ (Dako Cytomation). После проведения иммуногистохимической реакции срезы окрашивали гематоксилином и заключали в синтетическую среду Shandonmount TM (США).
Результаты специфического иммуногистохимического исследования идентифицировали с помощью окрашивания ядер или цитоплазмы клеток и плазматической мембраны. Во всех случаях для исключения неспецифического окрашивания использовали «негативный контроль» (мыш
ах клеток эпителия желез и стромы оценивали по методу гистологического счета H-score по формуле:
S = 1a + 2b + 3c,
где
а — процент слабо окрашенных ядер клеток;
b — процент умеренно окрашенных ядер клеток;
с — процент сильно окрашенных ядер клеток.
При этом интенсивность окраски (количество окрашенных ядер или цитоплазмы на 100 клеток) оценивали в баллах: 1 балл — слабая; 2 балла — умеренная; 3 балла — высокая. Таким образом, степень выраженности экспрессии ER-α и PR определяли по балльной шкале: 0–10 — отсутствие экспрессии; 11–100 — слабая; 101–200 — умеренная; 201–300 — выраженная экспрессия.
В ходе иммуногистохимического исследования оценивали также степень плазмоцитарной инфильтрации стромы эндометрия в баллах от 0 до 3: 0 — единичные клетки; 1 — небольшие очаговые инфильтраты; 2 — умеренное число клеток, диффузная инфильтрация; 3 — большое число клеток, выраженная диффузная инфильтрация.
С учетом выявленных клинико-лабораторных, морфологических и иммуногистохимических особенностей у пациенток с ГПЭ в сочетании с ХЭ нами разработан двухэтапный способ лечения ХЭ.
На первом этапе наряду с системной антибактериальной терапией (при выявлении бактериальной флоры с учетом чувствительности к антибитикам) пациентки получали локальное лечение с внутриматочным введением препарата Катеджель с лидокаином, содержащего хлоргексидина дигидрохлорид и лидокаина гидрохлорид: 3–4 инстилляции по 12,5 мг через день на курс лечения. Данный препарат оказывает антимикробное и местноанестезирующее действие.
После окончания первого этапа осуществляли введение полифункционального ферментного препарата пролонгированного действия Лонгидаза: вагинально по 1 суппозиторию 1 раз в 3 дня, 10 суппозиториев на курс лечения. Лонгидаза обладает выраженным антифиброзирующим и антиоксидантным действием. Препарат представляет собой конъюгат гиалуронидазы с высокополимерным носителем — сополимером N-оксида, 1,4-этиленпиперазина и (N-карбоксиметил)-1,4-этиленпиперазиния бромида. Благодаря этой конъюгации препарат становится защищенным от действия ингибиторов плазмы, в течение длительного времени сохраняется его ферментативная активность, а также уменьшается число побочных реакций.
Лонгидаза инактивирует цитотоксические свойства химических агентов, тем самым защищая клетки от повреждения. Положительное действие Лонгидазы заключается в прямой инактивации активных форм кислорода и других свободных радикалов, повреждающих клетки и ткани; хелатировании и удалении из очага воспаления активных ионов железа — самых мощных стимуляторов радикальных реакций. Проявляя выраженный антифиброзирующий, антиоксидантный эффект, Лонгидаза не обладает антигенными свойствами, митогенной, поликлональной активностью, не имеет аллергизирующего, мутагенного, эмбриотоксического и канцерогенного действия.
С целью лечения ГПЭ после проведения двухэтапной терапии ХЭ назначали гормональную терапию (прогестины, агонисты ГнРГ — Бусерелин-депо 3,75 мг внутримышечно № 6, внутриматочную систему Мирена, содержащую левоноргестрел). Различная экспрессия PR у пациенток с ПГЭ и СГЭ в сочетании с ХЭ диктует необходимость дифференцированного подхода к назначению гормональной терапии. Препаратами первой линии лечения ГПЭ являются препараты PR, поэтому дифференцированный выбор гормональной терапии обусловлен различной его экспреcсией. Высокая (201–300 баллов) или умеренная (101–200 баллов) экспрессия рецепторов к половым стероидным гормонам у больных с ГПЭ обосновывает рациональность гормонотерапии прогестагенами. Слабая (11–100 баллов) экспрессия или ее отсутствие (0–10 баллов), а также дефекты распределения PR с зонами низкого уровня вплоть до отсутствия его рецепторов, преимущественно в железах эндометрия, являются факторами риска развития резистентности к вводимым прогестагенам. В данном случае оправданна терапия агонистами ГнРГ.
Для статистической обработки данных использовали пакет программного обеспечения Statistica 6.0. Достоверность различий определяли по параметрическому критерию Стьюдента (t). Для несвязанных совокупностей использовали непараметрический критерий Манна — Уитни. Различия считали статистически значимыми при значениях p ˂ 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В ходе исследования установлено, что все пациентки предъявляли жалобы на тянущие боли внизу живота, дискомфорт во влагалище, периодически беспокоящие бели из половых путей. Среди нарушений менструального цикла обследованных женщин доминировала олигоменорея (64,1%), чередовавшаяся с менометроррагиями; у 17 (26,6%) пациенток отмечали меноррагии, а у 3 (4,7%) — олигоменорею, в то время как у 2 (3,1%) женщин клинических проявлений гиперплазии эндометрия не наблюдали.
Обращает на себя внимание тот факт, что у всех пациенток в анамнезе имели место указания на неоднократные внутриматочные вмешательства. Три и более прерывания беременности были у каждой третьей женщины с ПГЭ (31,2%) и СГЭ (34,4%) в сочетании с ХЭ. Самопроизвольное прерывание беременности выявили у 13 (20,3%) больных. Раздельные диагностические выскабливания стенок полости матки отмечены у 62 (96,9%) пациенток.
Среди экстрагенитальных заболеваний одну из лидирующих позиций у пациенток изучаемой когорты занимали сердечно-сосудистые заболевания — гипертоническая болезнь (31,3%) и нейроциркуляторная дистония по гипертоничеcкому типу (14,1%). Заболевания органов ЖКТ выявлены у 45,3% женщин, болезни эндокринной системы — у 62,5%. немногим менее половины пациенток страдали ожирением (45,3%). Сахарный диабет 2 типа отмечен у 7,8% участниц исследования.
У 53,1% больных, УЗИ которым было выполнено на фоне кровотечения длительностью от 8 до 40 дней, М-эхо варьировало от 10 до 20 мм. Данный факт свидетельствовал о возможном наличии гиперплазированного эндометрия. В 28,1% наблюдений при трансвагинальной эхографии, выполненной в первую фазу менструального цикла (5–7 дней), М-эхо варьировало от 10 до 15 мм. У 18,8% пациенток УЗИ выполняли на фоне задержки менструации от 10 до 60 дней, при этом толщина М-эха была от 16 до 20 мм. Таким образом, независимо от продолжительности кровотечения и дня менструального цикла, данные УЗИ эндометрия не позволяли исключить ГПЭ у всех участниц исследования.
В ходе УЗИ у всех пациенток были диагностированы увеличение размеров матки и утолщение ее стенок. Неравномерная эхогенность миометрия установлена у 53,1% обследованных. У 40,6% женщин эхографические признаки гиперплазии эндометрия сочетались с признаками миомы матки небольших размеров (определяли субсерозные и интерстициальные миоматозные узлы размерами от 5 до 30 мм).
Согласно результатам бактериологического исследования содержимого цервикального канала, у пациенток с ГПЭ в сочетании наиболее часто выявляли бактерии семейства Staphylococcaceae. При этом S. epidermidis высевали у 43,8%, а S. saprophyticus — у 21,8% женщин. На втором месте по числу выделенных культур были бактерии семейства Enterobacteriaceae: Escherichia coli выявили у 10,9% пациенток, Proteus vulgaris — у 4,7%. Третье место заняли бактерии cемейства Enterococcaceae (14,1%).
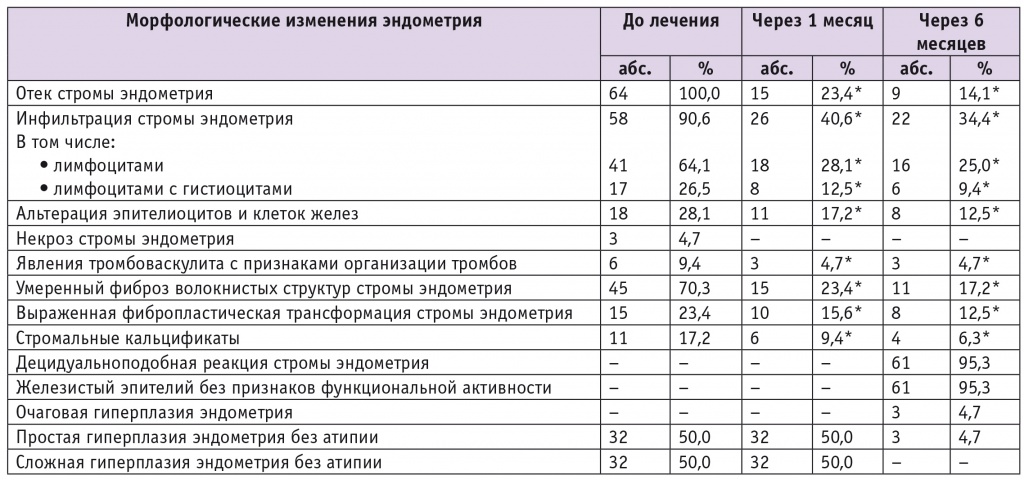
Данные морфологического исследования представлены в таблице 1. Обращает на себя внимание тот факт, что у всех обследованных пациенток выявлен отек стромы эндометрия, в 90,6% случаев диагностирована инфильтрация стромы. Наличие умеренного фиброза волокнистых структур стромы установлено у 70,3% женщин, при этом выраженная фибробластическая трансформации стромы эндометрия имела место у каждой четвертой пациентки.
Таблица 1
Результаты морфологического исследования эндометрия у обследованных пациенток в динамике
В ходе иммуногистохимического исследования были зафиксированы небольшие очаговые скопления плазмоцитов, вырабатывающих IgM, на фоне диффузной инфильтрации стромы с умеренным количеством плазмоцитов, продуцирующих IgG, у женщин с ПГЭ без атипии на фоне ХЭ. Установлено, что для пациенток с СГЭ без атипии в сочетании с ХЭ характерна диффузная плазмоцитарная инфильтрация стромы с умеренным числом плазмоцитов, вырабатывающих IgM, и со значительным преобладанием в инфильтрате плазмоцитов, продуцирующих IgG.
Согласно результатам иммуногистохимического анализа как в эпителии желез, так и в строме наиболее высокий уровень экспрессии ER-α и PR отмечали в неизменном эндометрии в фазу пролиферации (табл. 2). У пациенток с ПГЭ в сочетании с ХЭ средний уровень экспрессии ER-α в эпителии желез составил 111,8 ± 3,6 балла, средний уровень экспрессии PR в эпителии желез — 170,4 ± 4,6 балла (оба значения были достоверно ниже, чем в контроле: р < 0,05). У пациенток с СГЭ в сочетании с ХЭ средний уровень экспрессии ER-α в эпителии желез составил 102,5 ± 4,2 балла, а уровень PR — 163,2 ± 5,2 балла (в обоих случаях имелись достоверные отличия от показателей контрольной группы: р < 0,05). Полученные нами данные согласуются с результатами других исследований [10].
Таблица 2
Экспрессия рецепторов к половым стероидным гормонам при различных формах гиперплазии эндометрия в сочетании с хроническим эндометритом и в нормальном эндометрии (группа контроля), баллы
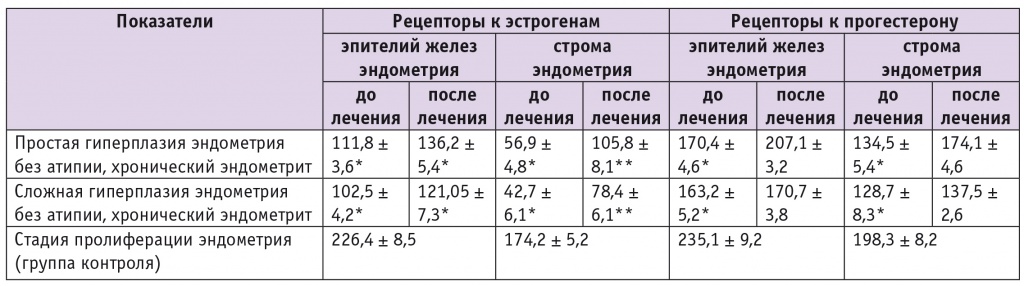
* P < 0,05 при сравнении с контролем.
** P < 0,05 при сравнении с исходными данными.
В результате оценки равномерности распределения рецепторов в эпителии желез эндометрия у 35,3% пациенток с ПГЭ в сочетании с ХЭ и в 52,1% случаев СГЭ в сочетании с ХЭ имело место нерегулярное распределение ER-α и/или PR вплоть до полного исчезновения в эпителии желез. При этом наибольшее число рецептор-негативных зон как при ПГЭ, так и при СГЭ приходилось на ER-α. Следует отметить, что независимо от формы гиперплазии в строме эндометрия выявлена более низкая экспрессия ER-α, чем в железах (см. табл. 2). Аналогичную тенденцию наблюдали и в отношении экспрессии PR.
Всем пациентам проведен разработанный нами двухэтапный метод лечения хронического эндометрита.
По данным УЗИ, через месяц от начала лечения размеры матки уменьшились у 64,1% пациенток, через 6 месяцев ― у 82,8%: длина матки — от 62,46 ± 4,54 мм до 56,80 ± 4,52 мм; ширина матки — от 58,18 ± 2,42 мм до 40,74 ± 1,12 мм; передне-задний размер — от 50,35 ± 1,08 мм до 28,68 ± 0,94 мм. Кроме того, после окончания второго этапа у каждой второй участницы (54,7%) снизилась неравномерность эхогенности миометрия. На момент начала приема гормональной терапии средняя толщина эндометрия составляла 4,2 ± 0,2 мм и существенно не менялась на протяжении трех месяцев (через 3 месяца ― 3,8 ± 0,2 мм). Анализ полученных данных свидетельствовал о том, что у 45,3% женщин толщина эндометрия на протяжении первых трех месяцев была менее 5 мм, в 50,0% случаев колебалась от 5 мм до 8 мм и лишь у 4,7% пациенток через 3 месяцев терапии, толщина эндометрия превышала 8 мм. Через 6 месяцев приема гормональной терапии отмечалась четкая динамика уменьшения срединного М-эхо, его среднее значение достоверно снизилось по отношению к исходному и составило 2,8 ± 0,2 мм.
Результаты бактериологического исследования посевов из цервикального канала после окончания лечения свидетельствовали об эффективности терапии препаратом Катеджель с лидокаином (табл. 3).
Таблица 3
Результаты бактериологического исследования содержимого цервикального канала у обследованных пациенток до и после лечения
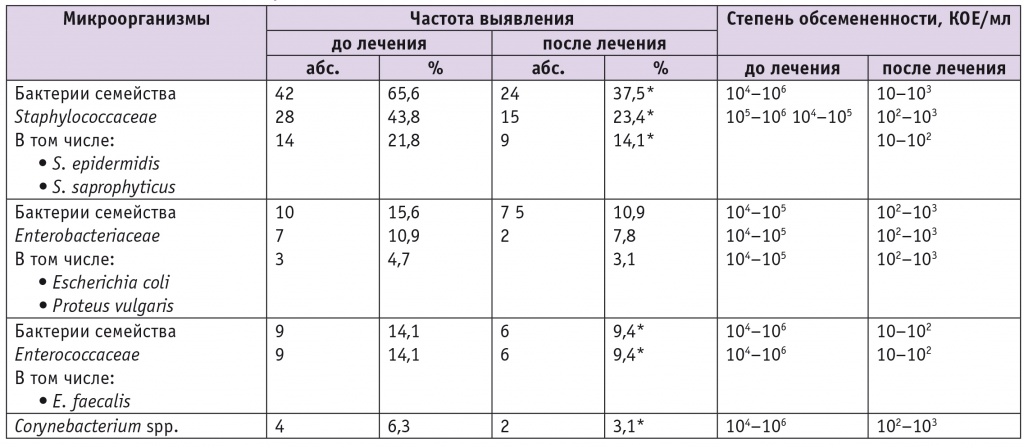
* P < 0,05 при сравнении с показателями до лечения.
Анализ данных морфологического, а также иммуногистохимического исследования эндометрия, проведенного после окончания двухэтапной терапии ХЭ, свидетельствовал о выраженной эффективности предложенного метода (см. табл. 1, 4).
Таблица 4
Результаты оценки плазмоцитарной инфильтрации стромы эндометрия у обследованных пациенток в динамике, баллы
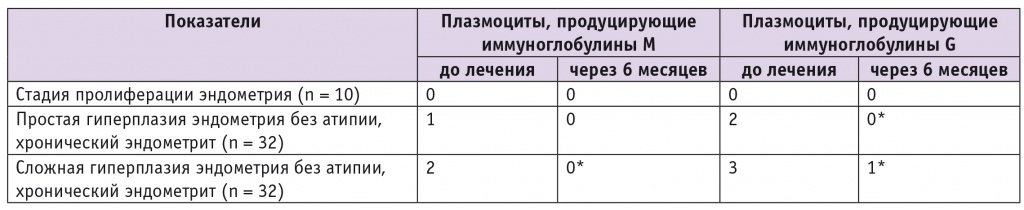
* P < 0,05 при сравнении с показателями до лечения.
Двухэтапная терапия ХЭ у пациенток с ГПЭ в перименопаузе позволила восстановить морфофункциональный потенциал эндометрия, что выразилось в повышении экспрессии рецепторов эндометрия к половым стероидным гормонам (см. табл. 2).
После окончания гормональной терапии морфологические признаки ГПЭ отсутствовали у 95,3% пациенток и лишь у 4,7% определялись очаги гиперплазированного эндометрия, гистологически верифицированные как ПГЭ без атипии (см. табл. 1).
ЗАКЛЮЧЕНИЕ
Полученные результаты подтверждают выдвинутую гипотезу о том, что предсуществующий ХЭ посредством изменения рецепторной чувствительности ткани эндометрия существенно влияет на исход лечения ГПЭ, требующей гормонотерапии. Предложенный комплекс лечебных мероприятий, включающий двухэтапный метод лечения ХЭ с применением ферментной терапии, направленный на приоритетное восстановление морфофункционального состояния эндометрия с последующей гормональной терапией позволяет при простой ГПЭ в сочетании с ХЭ улучшить исход лечения в 1,6 раза (p < 0,05), при сложной ― в 1,5 раза (p < 0,05).








