В 2013 г. Всемирная ассамблея здравоохранения определила рак шейки матки (РШМ) в качестве одного из приоритетных пунктов Плана действий по профилактике неинфекционных заболеваний и борьбе с ними на 2013–2020 гг. Начиная с 2006 г. во всем мире приоритетным направлением в профилактике РШМ наряду с проведением скрининговых программ признана вакцинация против вируса папилломы человека (ВПЧ). Возможность вакцинации от папилломавирусной инфекции (ПВИ) для первичной профилактики инфицирования и развития РШМ представляет собой одно из главных достижений науки последних десятилетий. В 2008 г. Харальду цур Хаузену из Немецкого центра исследования рака в Гейдельберге Нобелевский комитет присудил премию по физиологии и медицине за открытие ВПЧ, вызывающих РШМ [17, 22, 30]. Однако впервые теорию появления опухолевого роста, в которой огромная роль принадлежала вирусам, изложил российский ученый Л. А. Зильбер в 1935 г. [10, 29].
Ежегодно ВПЧ-инфекция ответственна за 530 тысяч новых случаев заболевания РШМ и 275 тысяч случаев смерти от РШМ [7]. В мире каждый год регистрируют порядка 100 тысяч случаев ВПЧ-ассоциированного анального рака у женщин и мужчин; у 15–20% больных раком головы и шеи (около 400 тысяч человек) выявляют ВПЧ [25]. В России ВПЧ является причиной широкого спектра онкологических заболеваний: в 2014 г. рак вульвы впервые выявили у 1852 женщин и рак влагалища — у 458; было зарегистрировано 4249 случаев рака полости рта, 2030 случаев рака гортаноглотки и 2445 случаев рака ротоглотки. Ежегодно регистрируется около 500 случаев рака пениса, чаще всего у мужчин старше 60 лет. Наиболее часто при этом выявляют ВПЧ 16-го типа [3].
Международное агентство по исследованиям в области рака (International Agency for Research on Cancer) определило, что ПВИ — вакциноуправляемая инфекция, а предотвращение заражения и персистенции ВПЧ однозначно можно считать профилактикой РШМ [11, 15, 16]. В настоящее время профилактические вакцины против ВПЧ зарегистрированы более чем в 130 странах мира. Национальные программы вакцинации от ВПЧ рекомендованы в 63 странах, в ряде стран наряду с девочками вакцинируют и мальчиков (Австралия, США, Канада, Австрия и др.).
Процесс создания вакцин против ВПЧ был сложным, поскольку до настоящего времени не существует пермиссивной клеточной системы для размножения ВПЧ in vitro. Мишенью реализации превентивного эффекта вакцины служит основной капсидный белок ВПЧ L1. Геном папилломавируса содержит 8–10 генов, которые в зависимости от типа вируса подразделяются на ранние и поздние [15]. В процессе озлокачествления наиболее важную роль играют так называемые ранние белки Е6 и Е7, которые интегрируются в геном клетки-хозяина и вызывают пролиферацию. Их считают перспективными для создания терапевтических вакцин. Поздние гены кодируют синтез капсидных белков. Сферическая поверхность вируса состоит из 360 копий белка L1 и 12 копий белка L2 [27]. После инфицирования эпителия ВПЧ в его верхних слоях отмечается продукция большого количества капсидных белков, формирующих оболочку вируса, в которую «упаковывается» вирусная ДНК. Наибольшей иммуногенностью обладают поздние капсидные белки, поэтому L1 — главный белок вирусного капсида — избран мишенью для создания профилактической вакцины, способной предотвратить продукцию ВПЧ.
Важным этапом в истории вакцины против ВПЧ явилось создание австралийскими учеными рекомбинантной вирусоподобной частицы, которая была синтезирована искусственным путем и не содержала геномного материала, т. е. ДНК ВПЧ. Вирусоподобная частица была создана путем экзогенной экспрессии белка L1 в различных клетках (дрожжи, бактерии, клетки насекомых и др.). Она не способна вызвать инфекционный процесс, однако хорошо стимулирует продукцию нейтрализующих антител, которые впоследствии связываются с капсидом ВПЧ при инфицировании.
Иммунитет против ВПЧ является типоспецифическим или приобретенным в процессе контакта с инфекционным агентом. Введение вакцины приводит к стимуляции выработки антител, цель которых — распознавание и нейтрализация чужеродных белков. Антитела синтезируются плазматическими клетками — В-лимфоцитами, которые обладают длительной памятью; благодаря клеточной памяти при будущем контакте с возбудителем-антигеном запускается новый процесс выработки нейтрализующих антител, что важно для создания долговременного иммунитета. Дополнительно к антигену в вакцину вводят специальные вещества — адъюванты, например соли алюминия, которые используются во многих современных вакцинах для усиления иммунного ответа. В настоящее время созданы три профилактические ВПЧ-вакцины.
С 2006 по 2015 г. в мире было применено более 200 млн доз вакцин против ВПЧ и накоплен достаточно большой объем данных по их эффективности и безопасности [24].
В России вакцинация против ВПЧ была одобрена правительством в 2007 г. С 2008 г. в 27 субъектах РФ (Московская область, Сахалинская область, Свердловская область, города Москва, Ярославль, Санкт-Петербург, Новосибирск, Смоленск, Екатеринбург, Пермский край, Ханты-Мансийский автономный округ и др.) было привито свыше 100 тысяч девочек-подростков [14]. Вопросами вакцинопрофилактики ПВИ в Российской Федерации активно занимаются многие ученые: В. И. Краснопольский, Г. Т. Сухих, В. Н. Прилепская, Н. В. Зароченцева, Ю. М. Белая, С. М. Харит, Л. С. Намазова-Баранова и др. [1]. Регламентируют вакцинальные программы региональные нормативные документы.
Позиция Всемирной организации здравоохранения. ВОЗ осознает серьезность проблемы РШМ и других заболеваний, вызываемых ВПЧ, для международного общественного здравоохранения и рекомендует включать ВПЧ-вакцины в национальные программы иммунизации при условии, что: профилактика РШМ и/или других заболеваний, вызываемых ВПЧ, является приоритетом общественного здравоохранения; внедрение вакцины выполнимо в плане организации; может быть обеспечено устойчивое финансирование, будет принята во внимание экономическая эффективность стратегий вакцинации в стране или области [2].
Вакцинация против ВПЧ не отменяет необходимости цитологического скрининга и регулярных гинекологических осмотров в рамках вторичной профилактики.
Самая эффективная скрининговая программа не может повлиять на распространение ПВИ, которая остается основной причиной развития онкологической патологии. Поэтому профилактическая вакцинация против ВПЧ наряду с программами скрининга является частью согласованной стратегии и тактики борьбы с РШМ.
Характеристика вакцин. Для первичной специфической профилактики заболеваний, связанных с ПВИ, в мире зарегистрированы три вакцины: двухвалентная (Церварикс, ЗАО «ГлаксоСмитКляйн Байолоджикалз с. а.», Бельгия), содержащая антигены ВПЧ 16-го и 18-го типов; четырехвалентная (Гардасил, «Мерк Шарп и Доум Б. В.», Нидерланды), содержащая антигены ВПЧ 6, 11, 16, 18-го типов, и девятивалентная (Гардасил 9, «Мерк Шарп и Доум Б. В.», Нидерланды), содержащая антигены ВПЧ 6, 11, 16, 18, 31, 33, 45, 52, 58-го типов.
В России сертифицированы две вакцины: двухвалентная (Церварикс) и четырехвалентная (Гардасил) (табл.).
Таблица
Сравнение вакцин против вируса папилломы человека
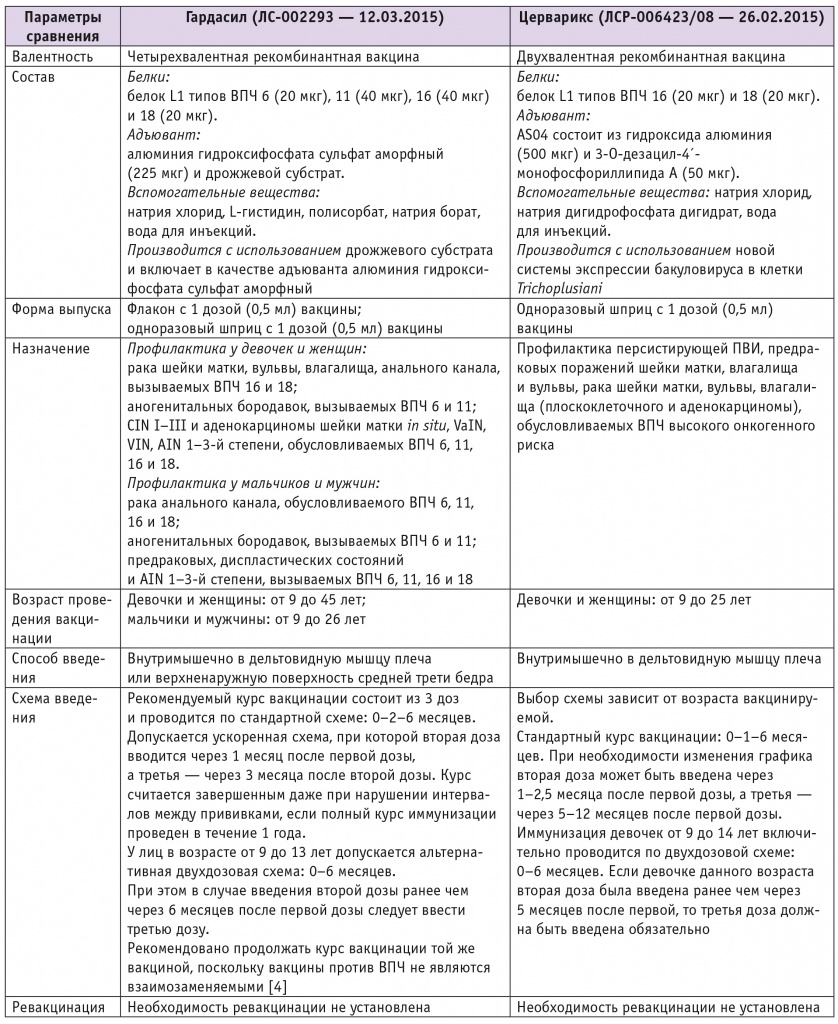
Примечание. ВПЧ — вирус папилломы человека; ПВИ — папилломавирусная инфекция; AIN — анальная интраэпителиальная неоплазия; CIN — интраэпителиальная неоплазия шейки матки; VaIN — интраэпителиальная неоплазия влагалища; VIN — интраэпителиальная неоплазия вульвы.
Обе вакцины получены с использованием рекомбинантной технологии из очищенных капсидных белков L1, которые путем самосборки образуют ВПЧ-типоспецифические пустые оболочки, или вирусоподобные частицы. Эти вакцины не содержат ни живых биологических продуктов, ни вирусных ДНК и, следовательно, не являются инфекционными; они не содержат антибиотиков или консервантов.
Курс вакцинации рекомендуется провести до начала сексуальной активности, т. е. до того, когда подростки потенциально могут подвергнуться инфицированию ВПЧ [2], однако вакцинация эффективна и в старшем возрасте — до 45 лет (Гардасил). Согласно рекомендациям экспертов ВОЗ, основной целевой группой для проведения иммунизации против ПВИ являются девочки от 9–10 лет до 13 лет [2]. Стандартный курс вакцинации состоит из трех доз, с 2015 г. введена альтернативная двухдозовая схема — 0–6 месяцев, — которая также является эффективной.
При проведении вакцинопрофилактики необходимо руководствоваться действующими нормативными и методическими документами по организации иммунизации [13], Национальным календарем профилактических прививок [12], а также инструкциями по применению иммунобиологических препаратов [13].
Иммуногенность. Механизм защиты, обеспечиваемой ВПЧ-вакцинами, связан с поликлональными нейтрализирующими антителами в отношении основного белка оболочки вируса L1. Долговечные плазмоциты, находящиеся главным образом в костном мозге, постоянно продуцируют антитела класса IgG и несут ответственность за длительное существование ВПЧ-специфических антител. Циркулирующие антитела, индуцированные вакцинацией, достигают места инфицирования благодаря активной транссудации IgG, по крайней мере в женских половых органах, и пассивной экссудации в местах дефектов кожи и слизистых оболочек, которые, как полагают, необходимы для возникновения ВПЧ-инфекции. Иммунизация также активизирует В-клетки памяти, находящиеся в основном в селезенке и лимфатических узлах. Эффективность защиты зависит от количества и от качества сходства индуцированных вакциной антител. Проведение полного курса вакцинации приводит к образованию специфических антител более чем у 98% вакцинируемых [14].
Иммуногенность двухвалентной и четырехвалентной вакцин сравнивали в идентичном параллельном исследовании [2]. У женщин в возрасте 18–26 лет через 7 месяцев после начала курса вакцинации нейтрализующие антитела в отношении ВПЧ 16-го и 18-го типов при использовании двухвалентной вакцины были в 3,7 и 7,3 раза соответственно выше, чем при применении четырехвалентной вакцины. Однако с учетом высокой эффективности обеих вакцин неясна клиническая значимость этих находок [14].
Противопоказания к проведению вакцинации против папилломавирусной инфекции [4, 5]. В число противопоказаний входят повышенная чувствительность к компонентам вакцины, развитие тяжелых системных аллергических реакций или поствакцинальных осложнений при предшествующем введении вакцины от ПВИ. При возникновении симптомов гиперчувствительности после введения вакцины введение следующей ее дозы противопоказано.
Нарушения свертываемости крови (гемофилия, тромбоцитопения, прием антикоагулянтов) являются относительным противопоказанием к внутримышечному введению вакцин. Необходимо принять меры по снижению риска образования постинъекционной гематомы.
Острые инфекционные и неинфекционные заболевания, а также обострения хронических заболеваний относятся к временным противопоказаниям, иммунизация проводится через 1–2 недели после выздоровления либо в период реконвалесценции или ремиссии. При легких формах респираторных, кишечных и других инфекций прививки можно проводить после нормализации температуры.
Если имеет место инфицирование вакцинным или невакцинным типом ВПЧ, то при решении вопроса о вакцинации необходимо сопоставить возможный риск в связи с предшествующим заражением и потенциальную пользу от вакцинации.
Данных о применении вакцин во время беременности и о потенциальном воздействии вакцины на репродуктивную функцию женщины и на плод у беременных недостаточно, чтобы рекомендовать использование вакцины во время гестации. Следует предупредить пациенток о необходимости предохранения от беременности в течение курса вакцинации, а при наступлении беременности вакцинацию надо отложить до ее завершения.
Грудное вскармливание не является противопоказанием для вакцинации четырехвалентной вакциной против ВПЧ. Применение двухвалентной вакцины в период грудного вскармливания возможно только в случае, если ожидаемая польза превышает риск.
Девочкам-подросткам перед выполнением вакцинации нет необходимости проходить специальный гинекологический осмотр.
Эффективность вакцин против папилломавирусной инфекции. Лицензирование ВПЧ-вакцин проведено на основании продемонстрированной ими клинической эффективности среди молодых женщин, а в отношении четырехвалентной вакцины — также и среди молодых мужчин [1].
Результаты вакцинации против ПВИ:
-
краткосрочные ранние — снижение распространенности заражения типами ВПЧ, входящими в состав вакцин, и уменьшение частоты возникновения аногенитальных кондилом (для четырехвалентной вакцины);
-
промежуточные — уменьшение частоты развития предраковых поражений шейки матки (цервикальная интраэпителиальная неоплазия), вульвы и влагалища (интраэпителиальная неоплазия вульвы и влагалища);
-
долгосрочные — снижение заболеваемости ВПЧ-ассоциированными видами рака.
Снижение заболеваемости раком шейки матки, вульвы и влагалища, а также анальным раком возможно оценить через 15–20 лет после начала вакцинопрофилактики [1].
По данным клинических исследований, эффективность четырехвалентной вакцины против ВПЧ у женщин от 16 до 26 лет в отношении профилактики рака и диспластических состояний шейки матки, вульвы, влагалища, а также аногенитальных кондилом находится в пределах 98–100%. У женщин от 24 до 45 лет эффективность в отношении профилактики персистирующей инфекции, интраэпителиальной неоплазии шейки матки (CIN) любой степени или аногенитальных поражений, вызываемых вакцинными штаммами, составляет 88,7% [23].
В Австралии после внедрения четырехвалентной вакцины против ВПЧ в программу массовой вакцинации девочек-подростков и молодых женщин заболеваемость аногенитальными кондиломами за 4 года (2007–2011 гг.) снизилась на 93% у девушек до 21 года и на 73% у женщин до 30 лет. С учетом данных о высокой эффективности вакцинации было принято решение расширить программу, включив в нее мальчиков [18]. У вакцинированных девушек, получивших по три дозы четырехвалентной вакцины против ВПЧ (n = 21 151), риск возникновения тяжелых дисплазий шейки матки оказался ниже, чем у непривитых, на 39% [21]. В ходе ретроспективного когортного исследования, проведенного среди девочек и женщин в возрасте 11–26 лет в период с 2007 по 2011 г. в штате Квинсленд, Австралия (n = 108 353), выявлено, что, по сравнению с результатами в контрольной группе невакцинированных пациенток, прохождение полного курса трехдозовой вакцинации четырехвалентной вакциной против ВПЧ обеспечивает защиту от CIN II/III на уровне 46% [19].
По данным проведенного в Швеции популяционного когортного исследования с участием почти 2,21 млн девочек и женщин в возрасте 10–44 лет, проживавших в Швеции с 2006 по 2010 г., у тех, кто получил три дозы четырехвалентной вакцины до достижения 20-летнего возраста, эффективность вакцинации в отношении снижения частоты возникновения остроконечных кондилом составила 76% [26].
Первые результаты вакцинации получены и в России. Московская область стала одним из субъектов РФ, где с 2008 г. начал осуществляться пилотный проект по иммунизации девочек 12–13 лет против РШМ. По данным, полученным в Московской области, в районах, где проводилась вакцинация девочек, за 4 года (2008–2012 гг.) произошло снижение заболеваемости аногенитальными кондиломами у девочек до 17 лет на 42% по сравнению с периодом до вакцинации [9].
Профилактическая эффективность двухвалентной вакцины против ВПЧ в популяции исходно неинфицированных женщин 15–25 лет в отношении персистирующей ПВИ 16-го и 18-го типов составила 98% и 97% соответственно; в отношении CIN I–III, обусловливаемых вакцинными штаммами, — 100% и в отношении интраэпителиальной неоплазии вульвы и влагалища, вызываемой ВПЧ 16-го и 18-го типов, — более 75% [28].
В профилактике аденокарциномы in situ эффективность двухвалентной вакцины была высокой (100%) у ВПЧ-наивных лиц и значительной (76,9%) в вакцинированной когорте [14].
Перекрестная защита. Двухвалентная вакцина обеспечивает, согласно инструкции, эффективную защиту от инфицирования и развития предраковых состояний, обусловливаемых генотипами ВПЧ, не входящими в состав вакцины (ВПЧ 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68-го типов): 54%-ную защиту в отношении CIN II+ по 12 онкогенным типам (исключая ВПЧ 16-го и 18-го типов) в популяции исходно неинфицированных женщин; профилактику CIN II+ и CIN III+ у женщин с исходно отрицательной ПЦР по 14 онкогенным типам ВПЧ независимо от типа ДНК в области поражения и от серологического статуса на уровне 65% и более 93% соответственно. Анамнестический иммунный ответ регистрируется в отношении родственных ВПЧ 31-го и 45-го типов [5].
Четырехвалентная вакцина индуцирует ответ в виде формирования сывороточных нейтрализующих антител в отношении ВПЧ 31-го, 33-го и 52-го типов. По результатам сравнения перекрестная защитная эффективность в предотвращении тканевых изменений с высокой степенью злокачественности для двухвалентной вакцины составляет 68%, а для четырехвалентной вакцины — 33% [17].
Длительность защиты вакцинации от папилломавирусной инфекции. Опубликованы данные по эффективной защите на протяжении 9,4 года для двухвалентной вакцины [28] и более 8 лет для четырехвалентной вакцины [20]. Исследования по изучению длительности иммунитета против ПВИ продолжаются.
Возможность одновременной вакцинации с другими вакцинами. Четырехвалентную вакцину против ВПЧ можно вводить в один день (в другой рекомендованный участок тела) с рекомбинантной вакциной против гепатита В, с менингококковой конъюгированной вакциной, с инактивированной вакциной против полиомиелита и бесклеточной вакциной против дифтерии, столбняка, коклюша.
Двухвалентная вакцина против ВПЧ может применяться одновременно с такими вакцинами, как инактивированная вакцина против полиомиелита, вакцина против гепатита А, рекомбинантная вакцина против гепатита В, при условии введения в разные участки тела и разными шприцами [2].
Применение с распространенными лекарствами. Применение анальгетиков, противовоспалительных препаратов, антибиотиков и витаминных средств, гормональных контрацептивов не оказывает воздействия на эффективность, иммуногенность и безопасность вакцин. Ингаляционные, местные и парентеральные стероиды не влияют на их иммуногенность и безопасность. Вместе с тем у лиц, принимающих иммуносупрессанты (системные кортикостероиды, цитотоксичные препараты, антиметаболиты, алкилирующие средства), защитный эффект вакцинации может быть снижен [4].
Безопасность и поствакцинальные реакции. Глобальный консультативный комитет ВОЗ по безопасности вакцин утверждает, что используемые вакцины безопасны [24].
Безопасность ВПЧ-вакцин мониторируется ведущими медицинскими организациями: ВОЗ, Центрами по контролю и профилактике заболеваний США (Centers for Disease Control and Prevention), Администрацией терапевтических товаров (Therapeutic Goods Administration) и др., — а также странами и компаниями-производителями с помощью систем активного и пассивного надзора за нежелательными явлениями (НЯ). В рамках клинических исследований НЯ называется любое неблагоприятное медицинское проявление — как связанное, так и не связанное с исследуемым препаратом, — которое возникает во время исследования.
Побочные поствакцинальные проявления ВПЧ-вакцин, как правило, несерьезны и непродолжительны. Наиболее частыми НЯ после введения четырехвалентной вакцины являются местные реакции: боль в месте инъекции, эритема, припухлость, гематома и зуд в месте введения, — большинство из которых имеют легкую степень тяжести. В поствакцинальном периоде могут наблюдаться боли в конечностях и повышение температуры тела. Во время пострегистрационного применения сообщалось о таких явлениях, как флегмона, бронхоспазм и крапивница, лимфоаденопатия, идиопатическая тромбоцитопеническая пурпура, головная боль, тошнота, рвота, артралгия, миалгия, астения.
При использовании двухвалентной вакцины в поствакцинальном периоде часто встречаются головная боль, миалгия, артралгия, зуд, сыпь, крапивница, астения, лихорадка более 38 °С, тошнота, рвота, диарея, боли в области живота. Нечасто возникают лимфоаденопатия, головокружение, уплотнение в месте введения вакцины. Редкими поствакцинальными реакциями признают обморочные состояния, вегетососудистые реакции, иногда сопровождающиеся тонико-клоническими движениями, аллергические реакции, включая отек Квинке и анафилактические реакции.
На сегодняшний день не выявлено никакой причинно-следственной связи вакцинации против ВПЧ с развитием аутоиммунных заболеваний, неврологических осложнений, венозной тромбоэмболии, бесплодия, не установлено негативных исходов беременности или смерти, что позволило дать однозначные рекомендации по включению вакцин против ВПЧ в программы массовой иммунизации против РШМ и других ВПЧ-ассоциированных заболеваний [1].
Важным свидетельством безопасности вакцин от ВПЧ являются данные о том, что течение беременности и состояние здоровья детей, рожденных вакцинированными женщинами, не отличаются от таковых в популяции и в группе женщин, получавших плацебо. Частота врожденных пороков развития и частота самопроизвольных выкидышей при беременностях, наступивших во время и после применения вакцин, соответствуют таковым в общей популяции [14].
Вакцины могут применяться среди лиц с ослабленным иммунитетом и/или ВИЧ-инфицированных. Следует констатировать, что получены убедительные свидетельства высокой безопасности и низкой реактогенности ВПЧ-вакцин [14, 24].
Экономическая эффективность. Глобальный анализ свидетельствует о том, что вакцинация девочек допубертатного возраста экономически эффективна, особенно в условиях ограниченных ресурсов, когда альтернативные методы профилактики РШМ зачастую имеют ограниченный охват. Результаты фармакоэкономического анализа, проведенного в РФ, позволяют предположить, что затраты на осуществление программы вакцинации против РШМ и других ВПЧ-ассоциированных заболеваний в России в 5,4 раза меньше ежегодных предотвращаемых потерь. Это имеет существенное социальное и экономическое значение [8].
ЗАКЛЮЧЕНИЕ
Профилактика рака шейки матки является приоритетом общественного здравоохранения во всем мире. Профилактические меры по снижению уровня ВПЧ-ассоциированных заболеваний крайне важны. Чтобы быть эффективной, вакцинация должна охватывать как можно бóльшую когорту населения, что, в свою очередь, требует проведения мероприятий по повышению осведомленности населения, врачей разных специальностей, органов здравоохранения. Накопленный в Московской области опыт и первые результаты оценки действия вакцин свидетельствуют о их безопасности и эффективности.








