В настоящий момент онкологические заболевания продолжают занимать ведущие позиции среди причин инвалидизации и смертности во всем мире. Согласно статистическому анализу GLOBOCAN, проведенному в 185 странах, в 2020 году в мире зарегистрированы 19,3 млн новых случаев рака и около 10 млн смертей вследствие онкологических заболеваний. Так, рак шейки матки является четвертым наиболее часто диагностируемым видом рака и четвертой основной причиной смерти от рака у женщин: по оценкам, за тот же год во всем мире зафиксированы 604 тыс. новых случаев и 342 тыс. смертей от данного заболевания1. В 2020 году в России на возраст 30–39 лет приходился пик заболеваемости раком шейки матки. Он был причиной 21,3% летальных исходов у женщин в указанной возрастной группе.
Установлено, что инфекционные агенты вызывают примерно 18% всех случаев онкологических заболеваний во всем мире [1]. К инфекционным агентам относятся бактерии (например, Helicobacter pylori), вирусы (ВПЧ, вирус гепатита В, гепатита C, вирус Эпштейна — Барр (ВЭБ), вирус герпеса человека 8, человеческий Т-клеточный лимфотропный вирус и т. д.), а также паразиты (например, шистосомы и печеночные сосальщики) [2-6]. При этом провоцируемые инфекционными агентами онкологические заболевания включают некоторые гематологические (лимфому Ходжкина, лимфому Беркитта, посттрансплантационное лимфопролиферативное заболевание и т. п.) и солидные злокачественные новообразования (карциномы носоглотки, гепатоцеллюлярные, рак желудка, шейки матки, мочевого пузыря).
Вирусные инфекции — это наиболее распространенная причина инфекционных раковых заболеваний (~12–15%). ВПЧ наряду с ВЭБ связан с 38% всех вирус-ассоциированных раковых заболеваний [7]. Большинство вирус-ассоциированных видов рака развиваются после длительного латентного периода, который может занимать от 15 до 40 лет [8].
ВИРУС ЭПШТЕЙНА — БАРР
Первичное инфицирование ВЭБ чаще всего происходит в детском возрасте и протекает бессимптомно. Первое столкновение с вирусом в подростковом и взрослом возрасте сопровождается развитием инфекционного мононуклеоза. После первичного инфицирования ВЭБ пожизненно сохраняется в В-лимфоцитах, приобретая латентную форму. Так, вирус способен сохраняться в организме за счет установления пожизненной латентной инфекции, которая может способствовать иммуномодуляции хозяина [9]. Согласно эпидемиологическим данным, ВЭБ-положительными являются более 90% населения земного шара [10]. Преимущественный путь передачи ВЭБ — воздушно-капельный, однако стало известно, что его распространению могут способствовать трансплантация органов и переливание крови [11].
ВЭБ кодирует несколько вирусных онкогенов [2], включая ядерные антигены (EBNA) и латентные мембранные белки (LMP) (рис.). Взаимодействия его поверхностного белка gp350 с рецептором CD21 и HLA класса II на В-лимфоцитах представляют собой основные механизмы проникновения в В-клетки. Кодируемые вирусом белки играют значительную роль в прогрессировании рака, инвазии и метастазировании, а также в иммунном уклонении опухолевых клеток, т. е. всех особенностях вирусного канцерогенеза.
Рис. Геномные организации вируса Эпштейна — Барр (EBV) и вируса папилломы человека (HPV) [14]
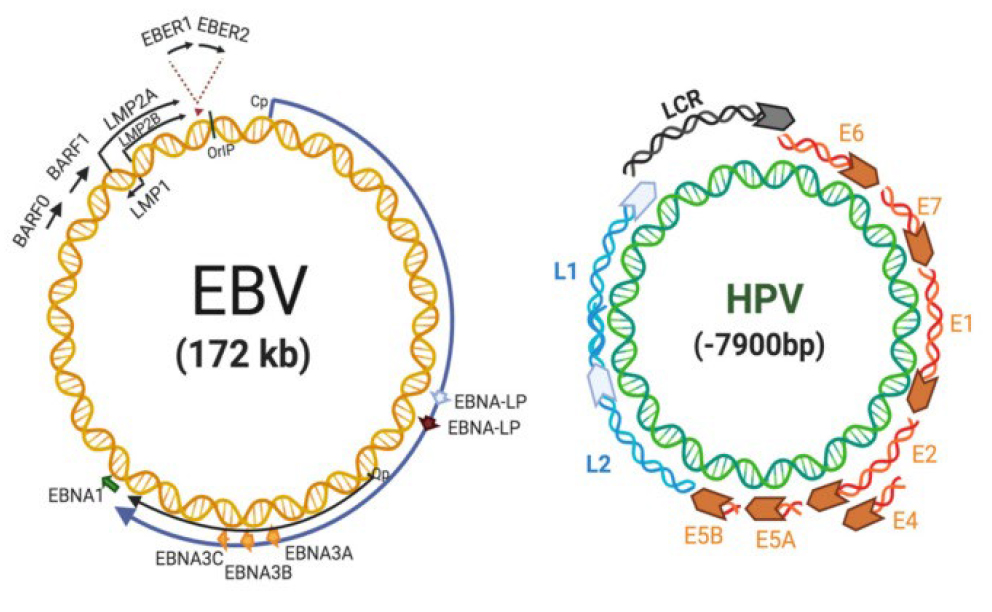
Молекулярные события, связанные с ролью ВЭБ в канцерогенезе, хорошо изучены в отношении лимфомы Ходжкина и недифференцированных вариантов карциномы носоглотки [12].
Метаанализ, проведенный в 2017 году и основанный на 25 публикациях, показал, что общая распространенность ВЭБ при раке шейки матки составила 43,63%. Кроме того, экспрессия ВЭБ коррелировала с тяжестью дисплазии эпителия шейки матки. Так, частота обнаружения ДНК ВЭБ при CIN1 — 27%, в то время как при CIN2/3 — 50% [13]. Согласно данным этого же исследования, коинфекция ВЭБ с ВПЧ в 4 раза увеличивала риск развития рака шейки матки у ВЭБ-положительных женщин; аналогичным образом предраковые поражения шейки матки встречались в 2 раза чаще у ВЭБ-положительных женщин, чем у ВЭБ-отрицательных.
Примечательно, что выявление ВЭБ положительно коррелирует с прогрессированием плоскоклеточного рака шейки матки. Присутствие ДНК ВЭБ, обнаруженное при помощи ПЦР, было положительно связано со степенью лимфоцитарной инфильтрации в материале. Подобным же образом выявлена повышенная распространенность ВЭБ-инфекции в инфильтрирующих лимфоцитах у пациенток с HSIL и цервикальным плоскоклеточным раком по сравнению с таковой при LSIL и отсутствии плоскоклеточного интраэпителиального поражения. Эти данные свидетельствуют о том, что прогрессирование от LSIL к HSIL, а затем к плоскоклеточному раку сопровождается увеличением числа ВЭБ-позитивных лимфоцитов [14]. Более того, активность Т-киллеров, специфичных для ВЭБ, снижается на поздних стадиях рака шейки матки по сравнению с таковой на более ранних стадиях, что говорит о нарушении Т-клеточного иммунитета.
Экспрессируемые ВПЧ E6 и E7 (см. рис.) ингибируют противовирусную активность и снижают секрецию ИЛ-3 макрофагами. Соответственно, иммуносупрессия, вызванная ВЭБ-инфекцией, может способствовать ускользанию от иммунного ответа эпителиальных клеток, инфицированных ВПЧ.
Вышеуказанные данные говорят о том, что ВЭБ является потенциально активным кофактором в патогенезе и прогрессировании рака шейки матки.
ВИРУС ПАПИЛЛОМЫ ЧЕЛОВЕКА
ВПЧ — основная причина развития рака шейки матки, при этом 12 онкогенных типов классифицируются Международным агентством по изучению рака как канцерогены первой группы [15]. Другие важные кофакторы включают некоторые инфекции, передающиеся половым путем (ВИЧ и Chlamydia trachomatis), курение, высокое число (3–5) родов и использование оральных контрацептивов (большое число заболеваний зафиксировано в период от 2 до 9 лет после прекращения использования) [16]. Подсчитано, что инфекции являются причиной до 15% случаев рака во всем мире, 20% из которых приходится на развивающиеся страны [17].
Инфекция наиболее распространена среди сексуально активных молодых женщин в возрасте от 18 до 30 лет с резким снижением частоты встречаемости после 30 лет. Чаще всего рак шейки матки диагностируется в возрасте 35 лет и старше, что позволяет предположить, что инфекция возникает в более молодом возрасте с медленным прогрессированием злокачественного процесса [18].
Персистенция ВПЧ-инфекции более характерна для типов онкогенного и высокого онкогенного риска (16-го, 18-го, 31-го, 33-го, 35-го и т. д.) [19], и это играет важную роль в развитии инвазивного рака шейки матки. Злокачественное перерождение эпителия возникает в зоне трансформации, то есть в области между плоским эпителием эктоцервикса и цилиндрическим эпителием эндоцервикса, где происходят непрерывные метапластические изменения. Период наибольшей метапластической активности совпадает с наибольшим риском заражения ВПЧ — это период полового созревания и первой беременности, а затем риск медленно снижается после наступления менопаузы [20].
ВПЧ является наиболее распространенной вирусной инфекцией репродуктивного тракта, а персистирующая инфекция типами ВПЧ высокого риска, такими как 16-й и 18-й, связана с предраковыми и раковыми поражениями шейки матки. Хотя ВПЧ вызывает несколько видов рака, включая рак вульвы, влагалища и ротоглотки, его связь с инвазивным раком шейки матки наиболее значима. По текущим оценкам, более 90% случаев рака шейки матки ассоциированы с инфекцией ВПЧ высокого риска [21]. Так, 99,7% карцином шейки матки во всем мире вызваны ВПЧ-16 или ВПЧ-18 [14].
Однако воздействия некоторых подтипов ВПЧ высокого риска недостаточно для развития рака шейки матки, поскольку плоскоклеточные цервикальные интраэпителиальные неоплазии низкой степени (LSIL) обычно регрессируют до нормальных клеток цервикальной слизистой или клеток плоского эпителия с атипией неясного значения (Atypical Squamous Сells of Undetermined Significance). Только 3,6% LSIL прогрессируют до цервикальной интраэпителиальной неоплазии высокой степени (HSIL) [22].
Таким образом, большинство изменений шейки матки, вызванных ВПЧ, являются преходящими, при этом 90% из них спонтанно регрессируют в течение 12–36 месяцев. Однако различные другие факторы, такие как индивидуальная генетическая предрасположенность, то есть полиморфные гены главного комплекса гистосовместимости, а также особый полиморфизм гена р53, участвующего в клиренсе и поддержании ВПЧ-инфекции, генетическая изменчивость в пределах разных типов ВПЧ, коинфекция более чем одним типом ВПЧ, частота повторного заражения, уровни гормонов и иммунный ответ могут изменить способность организма к элиминации инфекции.
Наличие ВПЧ высокого риска является необходимым, но может оказаться недостаточным фактором для формирования рака шейки матки. Разовьется ли у женщины рак шейки матки, зависит от нескольких факторов, которые действуют в сочетании с онкогенными типами ВПЧ в процессе, приводящем к раку.
КОИНФЕКЦИЯ ВИРУСА ЭПШТЕЙНА — БАРР И ВИРУСА ПАПИЛЛОМЫ ЧЕЛОВЕКА В КАНЦЕРОГЕНЕЗЕ ШЕЙКИ МАТКИ
В конце прошлого тысячелетия было доказано, что ВЭБ может передаваться половым путем [23] и размножаться в клетках шейки матки [24].
Обнаружение ВЭБ во влагалищной, уретральной и семенной жидкости подтверждает возможность передачи вируса половым путем и синергию с ВПЧ в этиологии рака половых органов [13].
Примечательно, что вирусные инфекции внутри раковых клеток не действуют взаимоисключающе, и вероятны синергические онкогенные эффекты этих вирусов. При карциноме шейки матки уровень коинфекции ВЭБ/ВПЧ был самым высоким (67%), тогда как в здоровом эпителии — самым низким (7%). Заметная разница в выявляемом уровне ВЭБ, отмеченная между нормальным эпителием шейки матки и плоскоклеточным раком, позволяет предположить, что коинфекция двух вирусов может способствовать прогрессированию заболевания и выступать в качестве маркера плохого прогноза у пациенток с установленным раком шейки матки [7].
Одним из наиболее интригующих вопросов является возможное синергетическое воздействие ВПЧ и ВЭБ на развитие и прогрессирование рака шейки матки. Подобный синергизм уже наблюдался при карциноме носоглотки, особенно в эндемичных регионах, таких как Китай и Юго-Восточная Азия [25].
Один из возможных сценариев, при котором реализуется синергическая модель взаимодействия ВЭБ и ВПЧ, — трансформация клеток шейки матки посредством комплемента C3d, он широко экспрессируется в шейке матки, делая эпителиальные клетки более чувствительными к различным онкогенным стимулам [26, 27]. Это свидетельствует о том, что ВЭБ может быть «помощником» в развитии рака шейки матки.
Присутствие ВЭБ в клетках эпителия шейки матки способно также ускорить интеграцию генома ВПЧ в геном клеток шейки матки, усиливая геномную нестабильность инфицированного эпителия [28].
Особый интерес представляет то, как аномальный иммунный статус организма, вызванный вирусными коинфекциями, модулирует экспрессию генов эпителия. В результате недавнего исследования выявлены очевидные изменения транскриптома в тканях CIN при коинфекции ВЭБ и ВПЧ по сравнению с нормальными тканями при инфицировании только ВПЧ [29].
Как и в предыдущих исследованиях, продемонстрировано, что инфекция ВПЧ сама по себе в эпителиальных клеточных линиях негативно влияет на дифференцировку эпителия клеток шейки матки и формирование эпителиального барьера, вызывая развитие предраковых и онкологических процессов [30].
Экспериментальные подходы к оценке молекулярных механизмов, вовлеченных в коинфекцию ВЭБ/ВПЧ, ограничены. Однако уже известно, что белок ВЭБ LMP1 в сочетании с вирусным белком ВПЧ E6 в трансформированных мышиных эмбриональных фибробластах снижает компоненты реакции на повреждение ДНК, например активность p53 [31].
В клетках шейки матки повышенный уровень ядерного белка ВЭБ может способствовать переходу от воспалительных изменений, связанных с ВПЧ, к раковому перерождению эпителия шейки матки путем модулирования врожденных иммунных ответов [32]. Ранее установлено, что воспалительное микроокружение клеток становится важным компонентом развития онкологического процесса. Известно, что до 20% всех опухолей связаны с хроническим воспалением, а воспаление при вирусной инфекции увеличивает риск рака [33, 34].
Дендритные клетки, являясь одним из видов иммунных клеток, находящихся в микроокружении опухоли, связываются с другими иммунными или эпителиальными клетками путем прямого контакта или продукции цитокинов и хемокинов. Нарушение регуляции экспрессии генов, связанных с интерферонами в дендритных клетках, наступающее в результате воздействия продуктов ВЭБ, приводит к несбалансированной продукции провоспалительных цитокинов и к стимуляции клеточной пролиферации [32].
Проводимые сегодня исследования предполагают потенциальную связь ВЭБ с развитием рака шейки матки посредством двух различных механизмов: инфицирование эпителиальных клеток, возможно, синергическое с ВПЧ (прямой механизм), и инфицирование тканевых лимфоцитов и генерация местной иммуносупрессии (непрямой механизм).
Кроме того, известно, что онкопротеины ВЭБ и ВПЧ имеют несколько общих сигнальных путей [28], поэтому было высказано предположение, что совместная активация может стать основным механизмом метастатической прогрессии [35-37]. Однако точный механизм взаимодействия между обоими вирусами и его роль в канцерогенезе пока неизвестны.
Инфицирование как типами ВПЧ высокого риска, так и ВЭБ демонстрирует значительную географическую изменчивость, и до проведения эпидемиологических исследований необходимо определить, какой тип ВПЧ может коинфицировать с ВЭБ. Более того, клиническая значимость генитальной инфекции, вызванной ВЭБ, может быть обусловлена способностью вируса к клеточной трансформации, которая, возможно, в качестве кофактора способствует развитию злокачественных новообразований.
Необходимы дальнейшие исследования для лучшего понимания роли коинфекции ВЭБ и ВПЧ в канцерогенезе цервикального эпителия. Следует также оценить потенциальную роль нагрузки циркулирующей ДНК ВЭБ в развитии рака шейки матки.
СОВРЕМЕННЫЕ ВОЗМОЖНОСТИ ПРОФИЛАКТИКИ
Учитывая значительное глобальное бремя рака шейки матки, составляющее ≤ 4 на 100 000 женщин во всем мире, в 2018 году генеральный директор ВОЗ Тедрос Аданом Гебреисус призвал к глобальным превентивным действиям по ликвидации рака шейки матки посредством стратегии «тройного вмешательства»: 1) вакцинация 90% всех девочек в возрасте до 15 лет; 2) скрининговые программы, охватывающие 70% женщин в возрасте от 35 до 45 лет; 3) лечение не менее 90% всех предраковых поражений, выявленных во время скрининга2.
Согласно последним данным Американского онкологического общества, женщинам рекомендуется начинать скрининг рака шейки матки в возрасте 25 лет и проходить первичное тестирование на ВПЧ каждые 5 лет до достижения 65 лет [38].
Исследования в отношении профилактической вакцинации против ВПЧ продемонстрировали впечатляющую эффективность, иммуногенность и безопасность, однако их внедрение в странах как с низким, так и с высоким уровнем жизни по-прежнему сопряжено с трудностями. С 2006 года рекомендации по вакцинации неоднократно обновлялись в отношении возраста, режима дозирования и пола. Несмотря на эти изменения, основной принцип остается прежним: приоритетно иммунизация проводится перед началом половой жизни и последующим контактом с ВПЧ. Важность равноценной иммунизации мужчин и женщин и роль «наверстывающей» вакцинации в позднем подростковом и взрослом возрасте также были подтверждены последующими исследованиями [39, 40].
Совсем недавно Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США одобрило расширение круга пациентов, имеющих право на введение неавалентной (9vHPV) вакцины, за счет женщин и мужчин в возрасте от 27 до 45 лет для профилактики рака и заболеваний, связанных с ВПЧ.
На данный момент в России зарегистрированы два препарата — двухвалентная и четырехвалентная вакцины. В настоящее время вакцинация против ВПЧ не включена в национальный календарь профилактических прививок в России, однако внедрена в региональные программы иммунизации в некоторых субъектах РФ (Московская область, Свердловская область, Санкт-Петербург, Якутск и др.) [41].
В отличие от профилактических вакцин против ВПЧ разработка терапевтических стратегий значительно отстает.
Три профилактические вакцины против ВПЧ лицензированы для предотвращения заболеваний, связанных с ВПЧ: бивалентная вакцина против ВПЧ 16/18, четырехвалентная вакцина против ВПЧ 6/11/16/18, невалентная вакцина против ВПЧ 6/11/16/18/31/33/45/52/58. Все три вакцины состоят из вирусоподобных частиц [42].
Важными вопросами остаются продолжительность иммунного ответа на вакцину против ВПЧ и потенциальные показания для ревакцинации. Однако предварительные долгосрочные исследования демонстрируют стойкую эффективность вакцины [42]. Данные вышеупомянутого исследования показывают 100%-ную серопозитивность в отношении ВПЧ 16/18, а также крайне низкую частоту инфицирования ВПЧ 16/18 через 7 лет у пациенток, получивших бивалентную вакцину [43]. Данные исследования FUTURE II, представленные S.K. Kjaer и соавт. в 2017 году, подтвердили постоянную эффективность четырехвалентной вакцины от штаммов ВПЧ вакцинного типа без случаев CIN2+ в течение 10 лет наблюдения [44].
В Кокрейновском обзоре 2018 года, включающем 26 рандомизированных контролируемых испытаний с участием более 70 000 женщин разного возраста, обобщена эффективность и безопасность би- и четырехвалентных вакцин против ВПЧ. Метаанализ не показал увеличения частоты нежелательных явлений по сравнению с таковой в контрольной группе и значительного снижения риска прединвазивного заболевания у молодых женщин [45].
Опубликованное в 2019 году ретроспективное исследование национальной шотландской программы вакцинации против ВПЧ и скрининга рака шейки матки, включающее 138 692 вакцинированных и невакцинированных женщин, родившихся между 1988 и 1996 годами, демонстрирует значительно меньшую распространенность прединвазивных заболеваний у женщин 20 лет в вакцинированной группе: снижение частоты CIN3+ на 89%, CIN2+ — на 88%, CIN1+ — на 79% [46].
В отличие от известной и достаточно широко применяемой сегодня тактики в отношении вакцинирования против ВПЧ, иммунизация против ВЭБ пока представляет собой «молодое» направление и находится на стадии активной разработки.
Со временем стало ясно, что иммунная защита от ВЭБ должна быть надежной, поскольку в случае, если она окажется преходящей и отсрочит первичную инфекцию ВЭБ, последующие начальные встречи с вирусом будут нести более высокий риск развития инфекционного мононуклеоза [47]. Таким образом, установление или поддержание иммунного контроля над бессимптомной персистирующей ВЭБ-инфекцией, вероятно, должно быть целью вакцинации против ВЭБ. Следует отметить, что вакцины против ВЭБ, направленные на предотвращение первичной инфекции и лечение злокачественных новообразований, связанных с ВЭБ, прошли этап разработки, но все еще не были одобрены [48]. Профилактические вакцины сосредоточены на белке ВЭБ gp350, который представляет собой основную мишень нейтрализующих антител, в то время как терапевтические вакцины нацелены на LMP и ядерный антиген ВЭБ (EBNA).
У пациенток с уже диагностированными злокачественными новообразованиями, связанными с ВЭБ, терапевтическая вакцинация представляет собой сложную задачу из-за установленных иммуносупрессивных механизмов. Кроме того, профилактическую вакцинацию, вероятно, трудно оценить в начальных клинических испытаниях из-за ее редкого проведения, обычно менее 50 случаев на 100 000 человек [49]. Таким образом, наиболее вероятными кандидатами для тестирования вакцин против ВЭБ становятся подростки или молодые люди, которые все еще являются серонегативными по ВЭБ (около одной трети популяции) и имеют высокий риск заражения ВЭБ (30–50%) [50].
Несмотря на значительный прогресс в области разработки противовирусной вакцинации, испытания продолжаются для изучения эффективности различных стратегий дозирования и долгосрочной эффективности вакцин.
ЗАКЛЮЧЕНИЕ
Вирус Эпштейна — Барр (ВЭБ) играет важную роль в возникновении и прогрессировании некоторых злокачественных новообразований человека, включая лимфомы (как В-, так и Т-клеточных линий) и карциномы (носоглотки и желудка). Имеющиеся данные свидетельствуют о возможной причинно-следственной связи между ВЭБ и патогенезом рака шейки матки. Часто встречающаяся коинфекция ВЭБ и ВПЧ при раке шейки матки также указывает на потенциальное онкогенное взаимодействие между двумя вирусами. Из этого следует, что необходимы дальнейшие более углубленные исследования для выяснения механизмов синергизма ВЭБ и ВПЧ и его клинического воздействия.
С учетом успеха предотвращения рака шейки матки с помощью вакцинации против ВПЧ и предстоящей вакцинации против ВЭБ требуется дальнейшее изучение механизма канцерогенеза шейки матки для улучшения профилактики развития онкологического процесса.
Поступила: 24.01.2022
Принята к публикации: 10.02.2022
________
1 Sung H., Ferlay J., Siegel R.L. et al. Global Cancer Statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: a Cancer Journal for Clinicians. 2021; 71(3): 209–49. DOI: 10.3322/caac.21660
2 World Health Organization (WHO). WHO Director-General calls for all countries to take action to help end the suffering caused by cervical cancer. WHO; 2018. URL: who.int/reproductivehealth/call-to-action-elimination-cervical-cancer/en/ (дата обращения — 15.01.2022).








