ВВЕДЕНИЕ
Сердечно-сосудистые заболевания (ССЗ) являются причиной более 30% всех случаев смерти женщин[1]. В последние десятилетия были установлены несколько специфических для женщин факторов риска (ФР) ССЗ, включая использование контрацептивов, преэклампсию и синдром поликистозных яичников[2]. Вместе с тем недостаточно изучена взаимосвязь ФР ССЗ с наличием миомы матки у женщин в пременопаузе.
Миома матки — наиболее распространенное доброкачественное новообразование у женщин с почти 70%-ной заболеваемостью к возрасту 50 лет[3]. Данное заболевание существенно снижает качество жизни пациенток, поскольку ему сопутствуют тяжелые и длительные менструальные кровотечения, анемия, хроническая тазовая боль, снижение фертильности, а также нарушение функции смежных органов[4].
Недавние исследования показали наличие ассоциации между миомой матки и такими ФР ССЗ, как АГ, ожирение, дислипидемия, толщина комплекса интима-медиа[5]. С одной стороны, эти наблюдения могут свидетельствовать о наличии общих предрасполагающих ФР, лежащих в основе как патогенеза миомы матки, так и появления метаболического и сердечно-сосудистого риска. С другой стороны, метаболические факторы могут играть определенную роль в биологических механизмах развития миомы. Известно, что с началом менопаузы риск миомы уменьшается; однако в этот период значимо возрастает сердечно-сосудистый риск, и наличие у пациентки ФР ССЗ его усугубляет[1, 5]. Таким образом, в настоящее время как ССЗ, так и миома матки являются значимыми проблемами общественного здравоохранения, затрагивающими женщин различных возрастных групп.
Целью нашего исследования стала оценка ассоциации основных факторов сердечно-сосудистого риска и миомы матки у женщин в пременопаузальном периоде.
МАТЕРИАЛЫ И МЕТОДЫ
Проведено сплошное проспективное исследование, включавшее 296 пациенток, проходивших обследование и лечение в клинике ФГБОУ ВО «Кубанский государственный медицинский университет» Минздрава России в 2020 году. Пациенток разделили на две группы: основная группа — 160 женщин с установленным диагнозом миомы матки, контрольная группа — 136 женщин без миомы, сопоставимых по возрасту. Критерии исключения: злокачественные новообразования любой локализации, беременность, лактация, менопауза, поликистоз яичников, любые хронические заболевания в стадии декомпенсации.
Проводили общеклиническое обследование всех участниц, включавшее изучение анамнеза и клинической симптоматики, стандартные лабораторные и инструментальные исследования.
ИМТ рассчитывали по стандартной формуле (индекс Кетле): масса тела (кг)/рост (м)2. Измеряли окружность талии (ОТ), окружность бедер (ОБ) — абдоминальный тип ожирения диагностировали при ОТ/ОБ > 0,8.
АД оценивали с помощью механического тонометра Little Doctor LD-71A (Сингапур). АГ соответствовало АД ≥ 140/90 мм рт. ст. или АГ в анамнезе при использовании или без использования медикаментов[6].
Статус курения определялся как наличие активного курения в течение последних 12 месяцев[6]. Нарушения углеводного обмена диагностировали, согласно клиническим рекомендациям Российской ассоциации эндокринологов[7]. Исследовали липидный состав крови (общий холестерин (ОХС), повышенным считали уровень > 5,0 ммоль/л)[6].
Лабораторные исследования выполнены на гематологическом анализаторе МЕК 8222 (Nihon Kohden, Япония) и автоматическом анализаторе для клинической биохимии SAPPHIRE 400 (Hirose Electronic System, Япония).
Исследование проведено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации. До включения в исследование у всех участниц получено письменное информированное согласие.
Статистическая обработка произведена с использованием пакета статистической программы Exсel 2013 совместно с надстройкой AtteStat 12.0.5. Показатели представлены в виде M (SD), где M — среднее значение, SD — стандартное отклонение при параметрическом распределении, в виде медианы (Ме) и интерквартильных интервалов (р25–75) — при непараметрическом. Оценку статистической значимости различий двух или нескольких относительных показателей (частот, долей) выполняли при помощи критерия χ2 Пирсона. Корреляционный анализ для уточнения взаимосвязи показателей осуществлен с использованием коэффициента корреляции Пирсона (r). Ассоциацию различных переменных изучали с помощью логистического регрессионного анализа. Корреляционные связи и различия сравниваемых показателей считали статистически значимыми при р < 0,05.
РЕЗУЛЬТАТЫ
Исходные характеристики участниц исследования представлены в таблице.
Таблица
Клинико-лабораторные характеристики участниц исследования (n = 296)
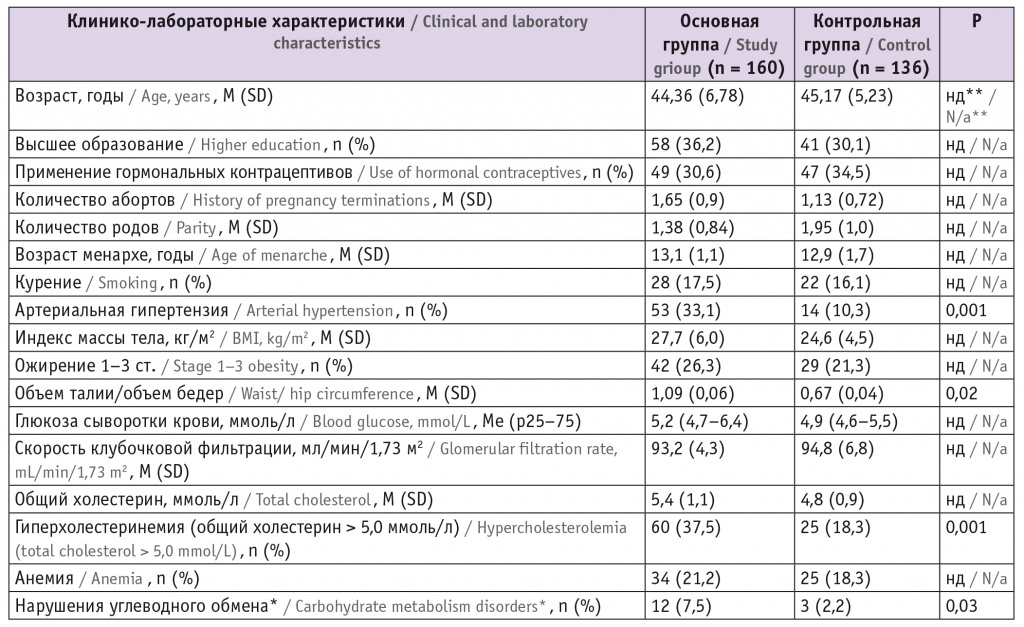
* В том числе сахарный диабет и нарушение гликемии натощак.
** нд — различия статистически незначимы.
Частота АГ была статистически значимо выше у женщин с миомой, чем в контрольной группе (33,1% vs 10,3% соответственно; χ2 = 21,8, p = 0,001). Вместе с тем у пациенток с миомой АГ чаще была контролируемой (23 (43,3%) vs 2 (14,3%), χ2 = 4,012, р = 0,046), они также чаще использовали ≥ 3 антигипертензивных препарата (21 (39,6%) vs 1 (7,1%), р = 0,02).
Наиболее распространенными антигипертензивными препаратами были ингибиторы АПФ, их принимали 32 (47,8%) пациентки; блокаторы рениновых рецепторов получали 16 (23,9%) женщин с АГ, β-блокаторы — 9 (13,4%), тиазидоподобные диуретики — 8 (11,9%); блокаторы кальциевых каналов применялись только в основной группе — у 2 пациенток.
Гипертрофия левого желудочка (ГЛЖ) как маркер бессимптомного поражения органов-мишеней выявлялась только в группе пациенток с миомой (13 (24,5%), χ2 = 3,841, р = 0,04).
Статистически значимые различия в частоте ожирения между исследуемыми группами отсутствовали (42 (26,3%) vs 29 (21,3%); χ2 = 0,97, p = 0,33). Однако избыточной массой тела статистически значимо чаще страдали пациентки с миомой (56 (35%) vs 32 (23,5%); χ2 = 4,63, p = 0,03). Кроме того, средние значения индекса ОТ/ОБ как показателя висцерального ожирения были статистически значимо выше у пациенток основной группы (1,09 (0,06) vs 0,67 (0,04), р = 0,02).
Распространенность курения и анемии в исследуемых группах оказалась сопоставимой.
Нарушения углеводного обмена статистически значимо чаще встречались у пациенток с миомой (12 (7,5%) vs 3 (2,2%), χ2 = 4,283 р = 0,03). Среди 12 пациенток основной группы с нарушениями углеводного обмена у пяти был СД, у семи — нарушение гликемии натощак. Все пациентки получали пероральную сахароснижающую терапию.
Были получены статистически значимые различия в частоте гиперхолестеринемии между исследуемыми группами (60 (37,5%) в 1-й vs 25 (18,3%), χ2 = 18,524, р = 0,001).
Статистически значимые различия по уровню образования между группами отсутствовали (36,2% женщин c высшим образованием в основной и 30,1% в контрольной группе).
Логистический регрессионный анализ показал независимые положительные ассоциации наличия миомы матки с АГ (ОШ = 2,02; 95%-ный ДИ: 1,25–3,27, р = 0,004), гиперхолестеринемией (ОШ = 2,51; 95%-ный ДИ: 1,82–3,79, р = 0,001), абдоминальным ожирением (ОШ = 2,98; 95%-ный ДИ: 1,95–4,19, р = 0,004), нарушениями углеводного обмена (ОШ = 2,43; 95%-ный ДИ: 1,23–4,79, р = 0,01).
В основной группе размеры миомы положительно коррелировали с возрастом (r = 0,146, p = 0,004), ОТ/ОБ (r = 0,201, p = 0,001), ИМТ (r = 0,153, p = 0,001). Выявлена статистически значимая корреляция между количеством миоматозных узлов и наличием висцерального ожирения (r = 0,167, p = 0,001), углеводными нарушениями (r = 0,181, p = 0,001), степенью АГ (r = 0,243, p = 0,001).
При анализе данных репродуктивного анамнеза установлено, что в группе пациенток с миомой возраст наступления менархе был меньше, чем в контрольной группе, однако разница оказалась статистически незначима (р = 0,06). В группе женщин с миомой среднее количество абортов оказалось выше, а среднее количество родов ниже, чем у участниц контрольной группы, однако разница также не была статистически значимой (p = 0,06). Частота приема гормональных контрацептивов в обеих группах был сопоставимой (49 (30,6%) и 47 (34,5%); р = 0,06).
Все пациентки основной группы были прооперированы в плановом порядке. Наиболее часто выполнялась влагалищная экстирпация матки — 83 (51,9%), затем шли миомэктомия лапароскопическим доступом — 48 (30%), надвлагалищная ампутация матки лапароскопическим доступом — 21 (13,1%), экстирпация матки лапароскопическим доступом — 4 (2,5%), экстирпация матки лапаротомным доступом — 2 (1,25%) и миомэктомия лапаротомным доступом — 2 (1,25%). По результатам послеоперационного гистологического исследования, у 102 (63,8%) пациенток выявлена лейомиома, у 55 (34,4%) — сочетание лейомиомы и аденомиоза, у 3 (1,8%) — аденомиоз.
ОБСУЖДЕНИЕ
Результаты нашего исследования показали, что наличие миомы матки ассоциировано с такими ФР ССЗ, как АГ, нарушения углеводного обмена, гиперхолестеринемия, абдоминальное ожирение. Полученные данные в целом согласуются с результатами зарубежных исследований[8]. Так, Y.C. Haan и соавт. в кросс-секционном исследовании сообщили о значимой взаимосвязи между миомой матки, АГ и бессимптомным поражением органов-мишеней[9]. В недавно проведенном японском исследовании с участием 2015 женщин показано, что риск развития миомы у женщин без АГ ассоциировался с наличием АГ у их матерей[10]. Возможно, это объясняется тем, что ангиотензин II (АТ II) и альдостерон участвуют в пролиферации клеток, ангиогенезе, воспалении и фиброзе[6].
В подтверждение этого в исследованиях зарубежных коллег выявлена индуцированная АТ II пролиферация клеток лейомиомы[11]. Хорошо известна и значительная роль АТ II в патогенезе АГ как фактора, непосредственно индуцирующего вазоконстрикцию и косвенно стимулирующего синтез альдостерона[6]. Кроме того, в некоторых исследованиях обнаружена значительная ассоциация между полиморфизмом участка А1166С в гене рецептора АТ II типа 1 (АGТR1) и лейомиомой[11].
Ингибирование АПФ, а также блокада АGТR1 подавляют ангиогенез и рост опухоли, уменьшают митотический индекс и пролиферацию клеток[10, 11]. Поэтому не исключено, что ингибиторы АПФ и антагонисты рецепторов АТ могут использоваться для предотвращения или уменьшения развития опухоли у восприимчивых субъектов, несущих эти генетические полиморфизмы[11].
А. Isobe и соавт. сообщили о том, что клетки лейомиомы экспрессируют минералокортикоидные рецепторы (МР) и альдостерон стимулирует пролиферацию клеток[12]. Вместе с тем инкубация клеток с МР-блокаторами спиронолактоном или эплереноном in vitro эффективно подавляет альдостерон-индуцированную и индуцированную АТ II пролиферацию клеток[12]. Эти данные предполагают возможное использование антагонистов МР для лечения миомы; однако можно рассматривать только чистый антагонист МР, такой как эплеренон, поскольку спиронолактон часто ассоциируется с метроррагией из-за его влияния на прогестероновые рецепторы[13].
По мнению некоторых авторов, в развитии АГ у женщин определенную роль может играть обструкция мочевыводящих путей при крупных размерах миомы[14].
АГ, вызванную контрацептивами, традиционно связывают с повышением уровня ангиотензиногена и активацией ренин-ангиотензин-альдостероновой системы, а также с прямым действием эстрадиола на уровне почек, провоцирующего задержку натрия[3]. Однако статистически значимо более высокая частота АГ у пациенток с миомой в нашем исследовании, очевидно, не связана с применением контрацептивов, поскольку частота их использования в исследуемых группах статистически значимо не различалась.
В нашем исследовании выявлена взаимосвязь наличия миомы и нарушений углеводного обмена. Вероятно, это вызвано тем, что гиперинсулинемия стимулирует пролиферацию гладкомышечных клеток миометрия, а также способна повышать циркулирующие уровни яичниковых гормонов[3, 4]. В ряде исследований показано, что инсулин способствует митозу клеток, стимулирует пролиферацию сосудистой гладкой мускулатуры, в частности рост клеток лейомиомы в культуре тканей[3, 4]. Некоторые исследователи обнаружили, что инсулин уменьшает ассоциацию между половыми гормонами и глобулинами, что повышает уровни эстрогеновых гормонов и других факторов, способствующих развитию миомы[3, 4]. Вместе с тем есть мнение, что существует отрицательная ассоциация миомы матки с СД при условии, что пациентки находятся на заместительной инсулинотерапии[3, 4].
В нашем исследовании не выявлено статистически значимой взаимосвязи курения с наличием миомы. Однако частота курения достигла в целом по выборке 16,8%, что сопоставимо с цифрами, полученными в российских исследованиях[15, 16]. Интересно, что в некоторых источниках сообщается, что курение снижает риск развития лейомиомы[3]. Имеются данные, что курение в течение более чем 19 лет ассоциируется с 40%-ным уменьшением риска лейомиомы[3, 17].
По мнению некоторых коллег, курение ассоциировано с эстроген-дефицитным состоянием, что является основной причиной меньшей частоты миомы у курящих женщин[3]. Однако не стоит забывать, что курение — один из основных факторов риска развития атеросклероза[17]. Кроме того, никотин непосредственно участвует в пролиферации гладкомышечных клеток[17].
Лейомиома имеет моноклональное происхождение, которое также было постулировано для атероматозной бляшки[17]. Поэтому с учетом пролиферации гладкомышечных клеток разумно ожидать положительной ассоциации курения с миомой.
Статистически значимо более высокая распространенность избыточной массы тела, а также висцерального ожирения в группе пациенток с миомой находит свое подтверждение в многочисленных исследованиях. Избыточная масса тела, особенно в сочетании с низкой физической активностью на фоне хронического стресса, повышает риск миомы матки в 2–3 раза[18].
Увеличение ИМТ после 18 лет влияет более значительно, чем ожирение в детском и пубертатном возрасте[19]. Это объясняется повышенной периферической конверсией в жировых клетках андрогенов в эстрогены под воздействием ароматазы и более высокой биодоступностью факторов роста, например инсулиноподобного фактора роста 1[19].
В недавнем исследовании на животных обнаружено, что инсулинорезистентность, индуцированная диетами с высоким содержанием жиров и легких углеводов, усиливает влияние половых гормонов на рост миометрия у самок крыс[20]. Однако есть мнение, что ожирение связано с ановуляцией, которая может уменьшить риск развития миомы[21].
Полученная в нашем исследовании ассоциация между гиперхолестеринемией и наличием миомы матки подтверждается литературными данными зарубежных коллег. Так, О. Uimari и соавт. сообщили о более высоком риске развития лейомиомы у женщин с повышенными уровнями ЛПНП и триглицеридов (ТГ)[5].
Хорошо известно, что эстроген и его рецепторы являются регуляторами нескольких аспектов липидного обмена и нарушение эстрогенной сигнализации связано с развитием метаболических заболеваний[5]. Эстрогены влияют на накопление ТГ, увеличивают уровень ОХС и модулируют экспрессию липопротеиновой липазы, которая катализирует превращение ТГ в свободную жирную кислоту в печени[17, 19]. Поскольку лейомиома является эстроген-связанной опухолью, считается, что существует связь между дислипидемией и риском развития миомы, что нашло подтверждение в нашем исследовании.
Из бессимптомных поражений органов-мишеней нами выявлена только ГЛЖ, частота которой была статистически значимо выше в группе женщин с миомой. Это согласуется с данными китайского исследования, в котором зафиксированы значимо более высокий лодыжечно-плечевой индекс и тенденция к более высокой скорости пульсовой волны у женщин с миомой[22]. Однако в исследовании S.К. Laughlin-Tommaso и соавт. с участием 972 женщин, в котором также обнаружена более высокая частота факторов риска ССЗ, наличие миомы не ассоциировалось с субклиническим поражением органов-мишеней[8]. Не исключено, что это связано с многоэтническим составом исследования.
Выявление более раннего менархе, большего среднего количества абортов и меньшего числа родов при миоме подтверждается и данными других современных исследований. Показано, что риск миомы увеличивается при более раннем менархе, что связывают с более высокой митотической активностью миометрия во время лютеиновой фазы[3]. Наличие родов связано со снижением риска развития миомы от 20% до 50%, и риск в большинстве случаев уменьшается пропорционально количеству детей[3]. В связи с этим интересными представляются результаты крупного проспективного британского исследования, включавшего 482 000 пациенток[23]. В нем показано, что раннее менархе, ранняя менопауза, возраст матери при первых родах, анамнез выкидышей, мертворождений и гистерэктомии были связаны с более высоким риском развития ССЗ[23].
ЗАКЛЮЧЕНИЕ
Полученные нами данные свидетельствуют о том, что у женщин с миомой маткой в пременопаузе профиль сердечно-сосудистого риска хуже, чем в контрольной группе. Необходимо всестороннее исследование метаболических и сердечно-сосудистых профилей риска и их ассоциации с миомой матки, что позволит снизить кардиоваскулярный риск у этих женщин к моменту наступления менопаузы.
Поступила: 05.03.2021
Принята к публикации: 07.06.2021








