ВВЕДЕНИЕ
На сегодняшний день трансплантация донорской почки рассматривается как оптимальный метод почечно-заместительной терапии, в большей степени, чем программный гемодиализ и постоянный амбулаторный перитонеальный диализ, улучшающий качество и увеличивающий продолжительность жизни пациентов с хроническим нарушением функции почек. Трансплантация почки способствует снижению кардиоваскулярной летальности больных, получающих почечно-заместительную терапию, но частота встречаемости сердечно-сосудистых нарушений у реципиентов трансплантата почки остается более высокой, чем в общей популяции. Трансплантация донорской почки устраняет явление хронической анемии и необходимость применения методов экстракорпоральной детоксикации, но после нее больным требуется иммуносупрессивная терапия, оказывающая негативное влияние на кардиоваскулярную систему[1].
Изучение распространенности факторов кардиоваскулярного риска у реципиентов трансплантата почки для повышения эффективности трансплантации и профилактики сердечно-сосудистых заболеваний в послеоперационном периоде не теряет научной актуальности и медико-социальной значимости.
Метаболический синдром (МС) — это совокупность факторов кардиоваскулярного риска, способных усиливать действие друг друга и увеличивать риск сердечно-сосудистых заболеваний и смерти в общей популяции[2, 3].
Диагностика МС в Республике Беларусь осуществляется на основании наличия основного и двух дополнительных критериев, определенных Международной диабетической федерацией (2005). Основным критерием является абдоминальное ожирение, которое диагностируется при окружности талии более 94 см у мужчин и более 80 см у женщин. К дополнительным критериям относятся уровень триглицеридов (ТГ) 1,7 ммоль/л и выше, уровень ЛПВП менее 1,0 ммоль/л у мужчин и менее 1,3 ммоль/л у женщин, АД выше 130/85 мм рт. ст., концентрация глюкозы в плазме крови натощак 5,6 ммоль/л и более или установленный диагноз СД 2 типа.
МС сопровождается усилением воспалительного цитокинового ответа, что вызывает увеличение протромботической и провоспалительной активности организма и ассоциируется с ускорением процессов атерогенеза, развитием эндотелиальной дисфункции, прогрессированием хронических заболеваний почек и кардиоваскулярных нарушений[3].
Вопрос влияния МС на общий кардиоваскулярный риск у пациентов, получающих почечно-заместительную терапию, остается недостаточно изученным. В то время как одни исследователи утверждают, что МС провоцирует развитие воспалительных процессов, но никак не влияет на исходы у пациентов, получающих диализную терапию[4], другие свидетельствуют об увеличении распространенности кардиоваскулярной патологии и показателей общей смертности у больных, находящихся на диализе[5].
Распространенность МС у реципиентов трансплантата почки велика и составляет от 20% до 60%. Посттрансплантационная иммуносупрессивная терапия оказывает негативное воздействие на АД, липидный обмен, усиливает инсулинорезистентность. Формирование МС в послеоперационном периоде также негативно влияет на функцию трансплантата и увеличивает вероятность его отторжения[6, 7]. Однако в некоторых исследованиях показано, что распространенность МС у реципиентов трансплантата почки ниже, чем у пациентов, получающих диализную терапию, главным образом за счет снижения АД и повышения уровня ЛПВП после трансплантации почки[8].
В настоящее время не существует единого мнения относительно прогностического значения МС у реципиентов трансплантата почки. Ряд исследований рассматривают МС как фактор риска прогрессирования дисфункции трансплантата и увеличения кардиоваскулярной летальности, который при этом не оказывает влияния на общую смертность реципиентов[9]. Другие авторы отрицают наличие прогностического значения МС у данной категории пациентов, утверждая, что основными прогностическими факторами в когорте реципиентов являются показатели функционирования трансплантата почки и ИМТ[10].
Цель исследования: изучить частоту встречаемости МС и его компонентов у реципиентов трансплантата почки, у которых произошли неблагоприятные кардиоваскулярные события в отдаленном послеоперационном периоде.
МАТЕРИАЛЫ И МЕТОДЫ
В одноцентровое проспективное когортное исследование включены 237 пациентов, которым была выполнена гетеротопическая трансплантация трупной донорской почки в ГУ «Минский научно-практический центр хирургии, трансплантологии и гематологии» (директор Центра — доктор медицинских наук, профессор, член-корреспондент Национальной академии наук Беларуси Олег Олегович Руммо). Участники были разделены на две группы: 79 (33,3%) пациентов, у которых за период наблюдения произошли неблагоприятные кардиоваскулярные события, составили основную группу, 158 (66,7%) реципиентов, которые не имели кардиоваскулярных осложнений, — группу сравнения.
Отбор пациентов для участия в исследовании проводился в 2015–2016 гг. Период наблюдения составил 3 года. В исследование вошли реципиенты трансплантата почки в возрасте от 18 до 70 лет, которые являлись гражданами Республики Беларусь, имели предшествующий стаж диализной почечно-заместительной терапии и подписали информированное согласие на участие. Критерием невключения стало наличие в анамнезе острого коронарного синдрома (ОКС), острого нарушения мозгового кровообращения (ОНМК), кардиохирургического оперативного вмешательства, онкологического заболевания.
К неблагоприятным кардиоваскулярным событиям отнесены ОКС, жизнеугрожающие нарушения ритма и проводимости, осложненный гипертонический криз, которые возникли впервые и требовали экстренной госпитализации.
АД определяли троекратно на руке, на которой не была сформирована артериовенозная фистула. Рост пациентов, массу тела, окружности талии (ОТ) и бедер (ОБ) измеряли утром натощак. Измерение ОТ проводилось в положении стоя, в средней точке между нижним краем нижнего последнего ребра и верхней частью гребня подвздошной кости, ОБ — в области наиболее широкой части ягодиц.
Забор крови для анализов выполнялся из локтевой вены натощак после двенадцатичасового голодания.
Систематизация и анализ данных осуществлялись с использованием программы SPSS Statistics (версия 17.0, SPSS Incorporation, США). Качественные признаки сравнивали с помощью теста χ2 Пирсона, количественные признаки, которые имели нормальное распределение, — при помощи t-критерия Стъюдента, количественные признаки, чье распределение не соответствовало нормальному, — при помощи теста Манна — Уитни. Различия между группами считались статистически значимыми при вероятности безошибочного прогноза 95,5% (p < 0,05).
Исследование рассмотрено и одобрено этическим комитетом ГУ «Минский научно-практический центр хирургии, трансплантологии и гематологии».
РЕЗУЛЬТАТЫ
Группы исследования были сопоставимы по возрасту и полу. Средний возраст реципиентов с неблагоприятными кардиоваскулярными событиями составил 48,8 ± 10,4 года, больных без них — 46,3 ± 10,9 года. Среди реципиентов основной группы был 41 (51,9%) мужчина и 38 (48,1%) женщин, среди реципиентов группы сравнения — 83 (52,5%) мужчины и 75 (47,5%) женщин.
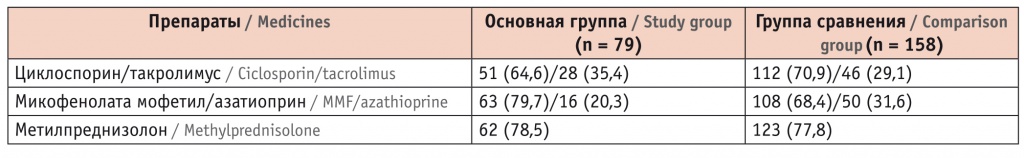
Статистически значимых различий в частоте заболеваний почек, приведших к необходимости почечно-заместительной терапии, и по получаемой иммуносупрессивной терапии между группами не было (табл. 1, 2).
Таблица 1
Заболевания почек, приведшие к необходимости почечно-заместительной терапии, у реципиентов трансплантата почки, n (%)
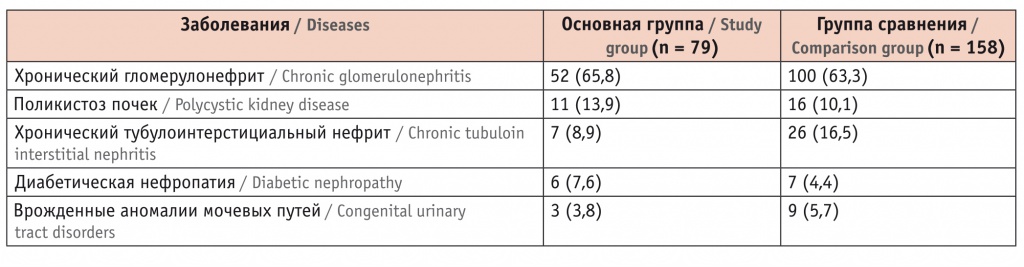
Таблица 2
Иммуносупрессивная терапия у реципиентов трансплантата почки, n (%)
В группах исследования изучена частота встречаемости традиционных факторов кардиоваскулярного риска. Обнаружено, что их распространенность среди больных с кардиоваскулярными осложнениями и без таковых значимо не различается (табл. 3).
Таблица 3
Факторы кардиоваскулярного риска у реципиентов трансплантата почки, n (%)
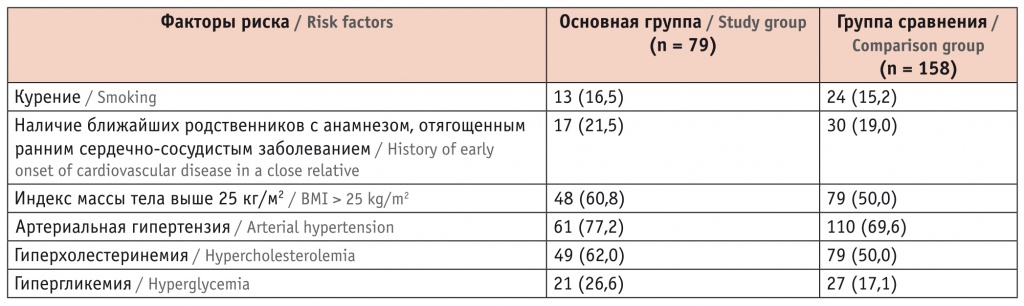
* P < 0,05.
При оценке функционального состояния почечного трансплантата установлено, что средняя скорость клубочковой фильтрации у реципиентов с неблагоприятными кардиоваскулярными событиями не отличалась от данного показателя у реципиентов без неблагоприятных кардиоваскулярных событий — 51 ± 20 мл/мин и 54 ± 16 мл/мин соответственно.
С целью диагностики абдоминального ожирения у реципиентов трансплантата почки измеряли ОТ, ОБ и рассчитывали коэффициент отношения ОТ к ОБ (табл. 4).
Таблица 4
Антропометрические показатели реципиентов трансплантата почки, M ± m
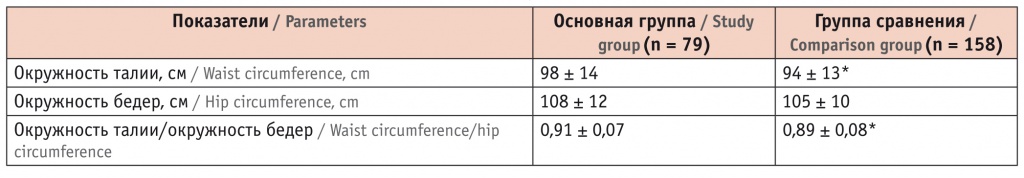
Средняя ОТ у реципиентов трансплантата почки с кардиоваскулярными осложнениями была больше, чем у участников без таковых (p < 0,05). Абдоминальное ожирение диагностировали у 59 (74,7%) пациентов основной группы и у 104 (65,8%) в группе сравнения (p > 0,05).
Среднее значение коэффициента ОТ/ОБ у лиц с неблагоприятными кардиоваскулярными событиями было существенно выше, чем у реципиентов без них (p < 0,05). Увеличенный коэффициент ОТ/ОБ, определяемый при значениях выше 0,85 у женщин и выше 1,0 у мужчин, чаще наблюдался в основной группе, чем в группе сравнения: 57 (72,2%) против 93 (58,9%), p < 0,05.
ИМТ более 30 кг/м2 чаще выявлялся у реципиентов с неблагоприятными кардиоваскулярными событиями, чем у лиц без них: 22 (27,8%) против 20 (12,7%), p < 0,01. Сочетание ожирения и абдоминального ожирения также чаще встречалось у больных с кардиоваскулярными осложнениями: 21 (26,6%) против 20 (12,7%), p < 0,01.
Уровень ТГ в основной группе реципиентов трансплантата почки был значимо выше, в группе сравнения (p < 0,01) (рис.). Повышение уровня ТГ в крови выше 1,7 ммоль/л чаще диагностировалось у реципиентов с неблагоприятными кардиоваскулярными событиями — 44,3% (n = 35) против 27,8% (n = 44), p < 0,05.
Рис. Уровень триглицеридов (ТГ) в сыворотке крови реципиентов трансплантата почки
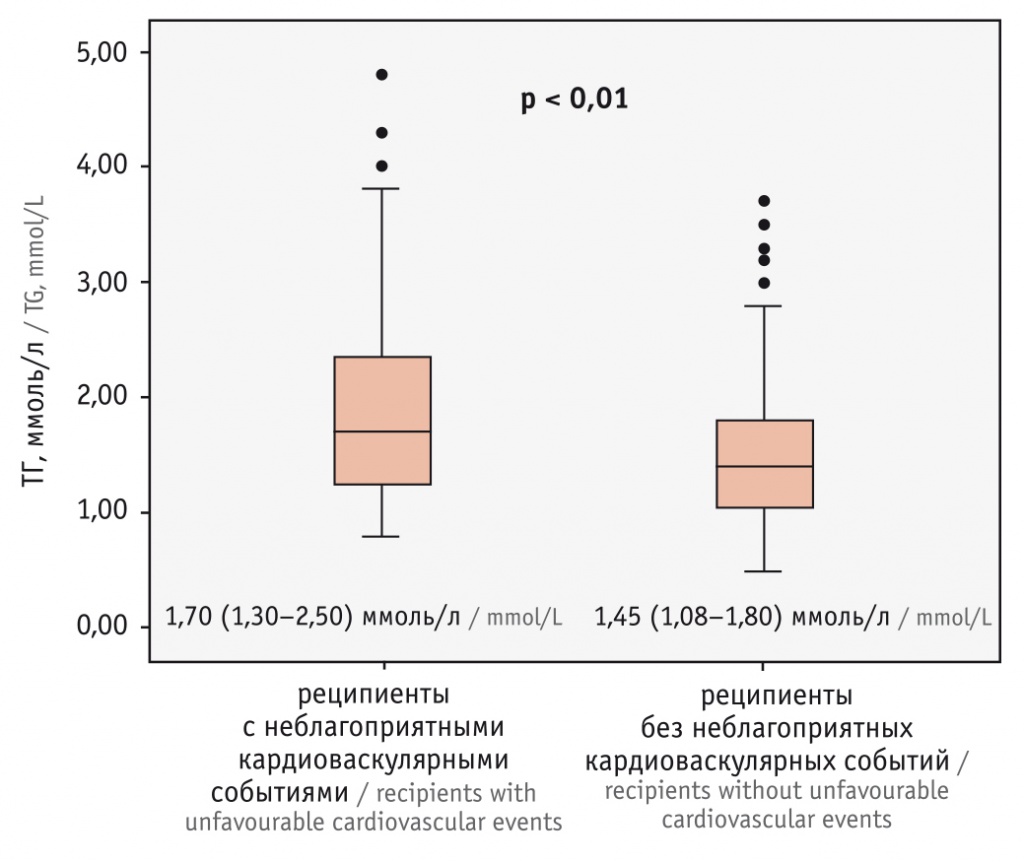
В группах исследования не установлено статистически значимых различий в уровне ЛПВП в зависимости от возникновения либо отсутствия неблагоприятных кардиоваскулярных событий — 1,30 (1,21–1,42) ммоль/л и 1,31 (1,21–1,45) ммоль/л соответственно. Сниженный уровень ЛПВП (ниже 1,0 ммоль/л у мужчин и ниже 1,3 ммоль/л у женщин) был диагностирован у 20,3% (n = 16) реципиентов с неблагоприятными кардиоваскулярными событиями и у 18,4% (n = 29) реципиентов без неблагоприятных кардиоваскулярных событий, p > 0,05.
Систолическое АД у участников обеих групп не имело статистически значимых различий: 140 (130–160) мм рт. ст. против 140 (125–150) мм рт. ст. Диастолическое АД в обеих группах составляло 90 (80–100) мм рт. ст. Антигипертензивные лекарственные средства принимали 69 (87,3%) человек с кардиоваскулярными осложнениями и 127 (80,4%) реципиентов без них, p > 0,05.
Уровень глюкозы в крови у реципиентов основной группы и группы сравнения тоже существенно не различался: 5,51 (5,12–6,32) ммоль/л против 5,46 (5,07–5,82) ммоль/л, p > 0,05. Диагностически значимый уровень гликемии (выше 5,6 ммоль/л) встречался у 36 (45,6%) пациентов с неблагоприятными кардиоваскулярными событиями и у 58 (36,7%) без таковых.
На момент включения в исследование у 31 (13,1%) реципиента диагностировано посттрансплантационное нарушение толерантности к глюкозе или посттрансплантационный СД, причем данные нарушения у реципиентов с кардиоваскулярными осложнениями имели место чаще: 16 (20,3%) против 15 (9,5%), p < 0,05.
На основании диагностических критериев Международной диабетической федерации установлено, что у 99 (41,8%) пациентов, включенных в исследование, присутствовал МС, причем у лиц с неблагоприятными кардиоваскулярными событиями он встречался значительно чаще — 46 (58,2%) против 53 (33,5%), p < 0,001.
МС преимущественно отмечался у реципиентов пожилого и среднего возраста: 71 (71,7%) против 70 (50,7%) молодых людей, p < 0,01; у реципиентов с избыточной массой тела или ожирением: 79 (79,8%) против 48 (34,8%) пациентов с нормальной массой тела, p < 0,001; у реципиентов с отягощенным семейным анамнезом раннего сердечно-сосудистого заболевания: 26 (26,3%) против 21 (15,2%), p < 0,05.
ЗАКЛЮЧЕНИЕ
Проведенное исследование доказало, что метаболический синдром (МС) и некоторые его компоненты чаще встречаются у реципиентов трансплантата почки с кардиоваскулярными осложнениями, что позволяет рассматривать МС в отдаленном послеоперационном периоде как независимый фактор кардиоваскулярного риска, требующий динамического контроля и модификации.
Благодарности: авторы выражают признательность коллективу кафедры кардиологии и внутренних болезней УО «Белорусский государственный медицинский университет», коллективам отделений трансплантации, нефрологии и гемодиализа ГУ «Минский научно-практический центр хирургии, трансплантологии и гематологии».
Поступила: 24.03.2020
Принята к публикации: 06.05.2020








