ВВЕДЕНИЕ
Основными целями лечения пациентов с ИБС являются устранение симптомов заболевания и профилактика сердечно-сосудистых осложнений[1, 2]. В рекомендациях European Society of Cardiology (ESC) 2019 г. по лечению хронического коронарного синдрома (ХКС)[2] отмечается, что оптимальным можно считать то лечение, которое удовлетворительно контролирует симптомы и предупреждает сердечные события, ассоциированные с ХКС, с максимальной приверженностью пациента и минимальными нежелательными явлениями[3].
Вторичная профилактика сердечных событий или снижение риска развития инфаркта миокарда (ИМ), сердечной недостаточности и внезапной смерти способствует решению
важнейшей задачи здравоохранения по увеличению продолжительности жизни, поскольку именно смертность, обусловленная ИБС, доминирует в структуре смертности в нашей стране[4].
В соответствии с новыми рекомендациями по лечению ХКС[2], профилактика осложнений ИБС осуществляется с помощью назначения на постоянной основе антиагрегантов (ацетилсалициловой кислоты или клопидогрела), а при высоком ишемическом риске антитромботическая терапия усиливается с помощью присоединения второго антиагреганта или антикоагулянта ривароксабана в низкой дозе (табл. 1); липид-снижающих препаратов, в первую очередь статинов с присоединением при необходимости эзетимиба и ингибиторов пропротеин-конвертазы субтилизин/кексин типа 9 (PCSK9) с обязательным достижением целевого уровня холестерина ЛПНП (ХсЛПНП); препаратов, блокирующих активность ренин-ангиотензиновой системы, с доказательствами эффективности — ингибиторов АПФ периндоприла и рамиприла, а при их непереносимости — блокаторов ангиотензиновых рецепторов, в первую очередь у пациентов с низкой фракцией выброса ЛЖ, перенесенным ИМ, СД, АГ, однако и у больных ИБС без указанных состояний можно рассчитывать на снижение сердечно-сосудистого риска.
Таблица 1
Рекомендации European Society of Cardiology 2019 г.: антитромботическая терапия у лиц с хроническим коронарным синдромом и синусовым ритмом[2]
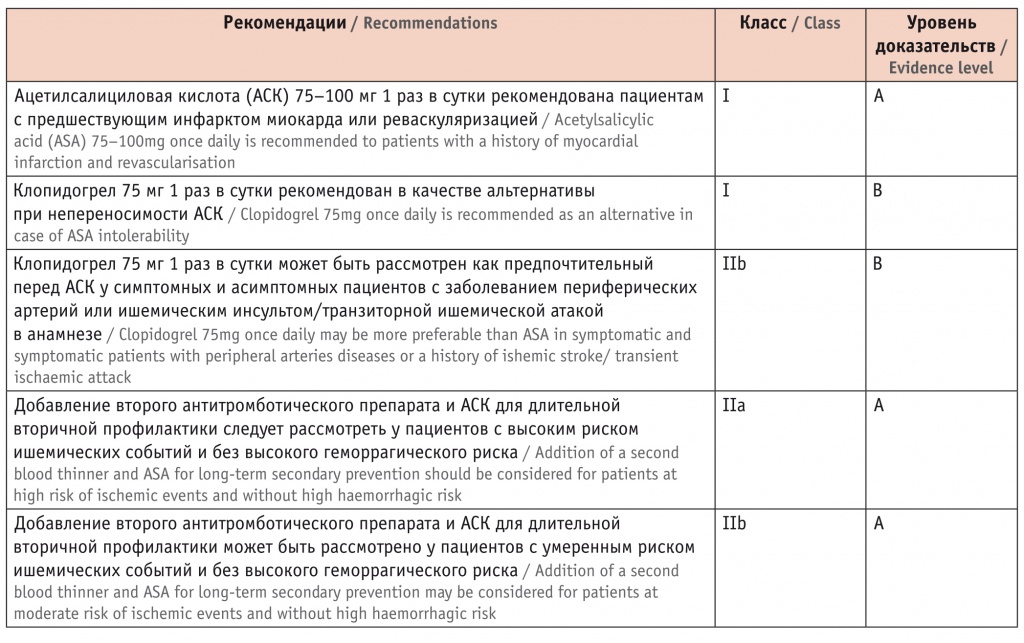
В схеме превентивного лечения ИБС также указаны β-блокаторы, которые рекомендуются всем пациентам после перенесенного ИМ (табл. 2).
Таблица 2
Рекомендации European Society of Cardiology 2019 г.: профилактика сердечно-сосудистых событий[2]
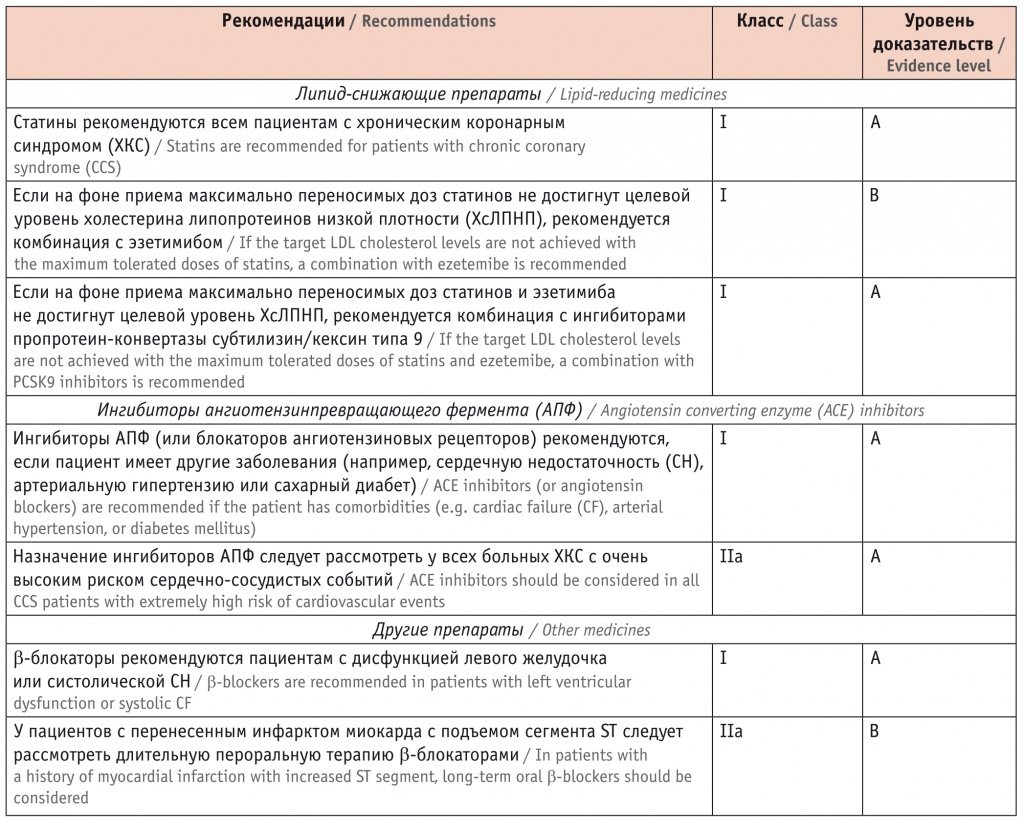
Среди перечисленных направлений снижения риска неблагоприятных событий у больных ИБС особое место занимает липид-снижающая терапия, которая не только должна быть назначена всем больным с установленным диагнозом ИБС, но и предполагает проведение контроля уровня ХсЛПНП с достижением и поддержанием целевого показателя без ограничений по длительности.
Следует напомнить, что необходимость назначения статинов пациентам со стабильной ИБС с целью снижения риска сердечно-сосудистых осложнений впервые доказана более 25 лет тому назад в клиническом исследовании 4S[5].
В этом исследовании впервые установлена эффективность статинов у больных ИБС с исходным уровнем общего холестерина (ОХ) от 5,2 до 8,0 ммоль/л. На фоне терапии симвастатином 20 мг с увеличением дозы до 40 мг при уровне ОХ через 18 недель свыше 5,2 ммоль/л общая смертность в течение в среднем 5,4 года снизилась на 30%, а сердечно-сосудистая — на 42% по сравнению с таковыми в группе плацебо. Такое улучшение прогноза достигнуто при снижении содержания ОХ в среднем на 35%.
Во всех последующих исследованиях показано, что клинический результат главным образом зависит от степени уменьшения концентрации ХсЛПНП. Например, в клиническом исследовании PROVE IT большее снижение уровня ХсЛПНП у пациентов с ОКС на фоне назначенного вскоре после поступления аторвастатина в дозе 80 мг сопровождалось более выраженным уменьшением заболеваемости и смертности, чем у пациентов, получавших правастатин в дозе 40 мг[6]. Эти и другие многочисленные данные стали основанием для создания концепции целевого уровня ХсЛПНП, достижение которого — важнейшая задача при лечении больных ИБС[7].
ОТ ЧЕГО ЗАВИСИТ СТЕПЕНЬ СНИЖЕНИЯ КОНЦЕНТРАЦИИ ХОЛЕСТЕРИНА ЛИПОПРОТЕИНОВ НИЗКОЙ ПЛОТНОСТИ?
Выраженность снижения уровня ХсЛПНП является дозозависимой и определяется выбранным статином, они значительно различаются по мощности действия[8]. Как видно из представленных на рисунке 1 данных, самое мощное липид-снижающее действие среди статинов имеет розувастатин, в дозе 40 мг он уменьшает содержание ХсЛПНП в среднем до 50–60%.
Рис. 1. Гиполипидемическая эффективность статинов: данные систематического обзора и метаанализа[8]
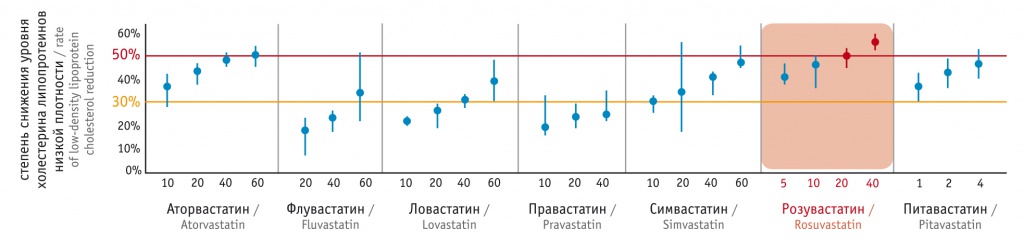
Однако надо помнить о вариабельности индивидуального ответа при назначении любых статинов. Плохой ответ на статинотерапию в клинических исследованиях отчасти может быть связан с недостаточной приверженностью к терапии, но он может объясняться и индивидуальными генетическими особенностями как метаболизма холестерина, так и захвата статина и метаболизма в печени[9]. Это лишний раз подтверждает необходимость повторного определения липидных показателей через 4 недели после назначения препаратов (оценка индивидуального ответа), а также периодического контроля в дальнейшем (оценка приверженности к терапии).
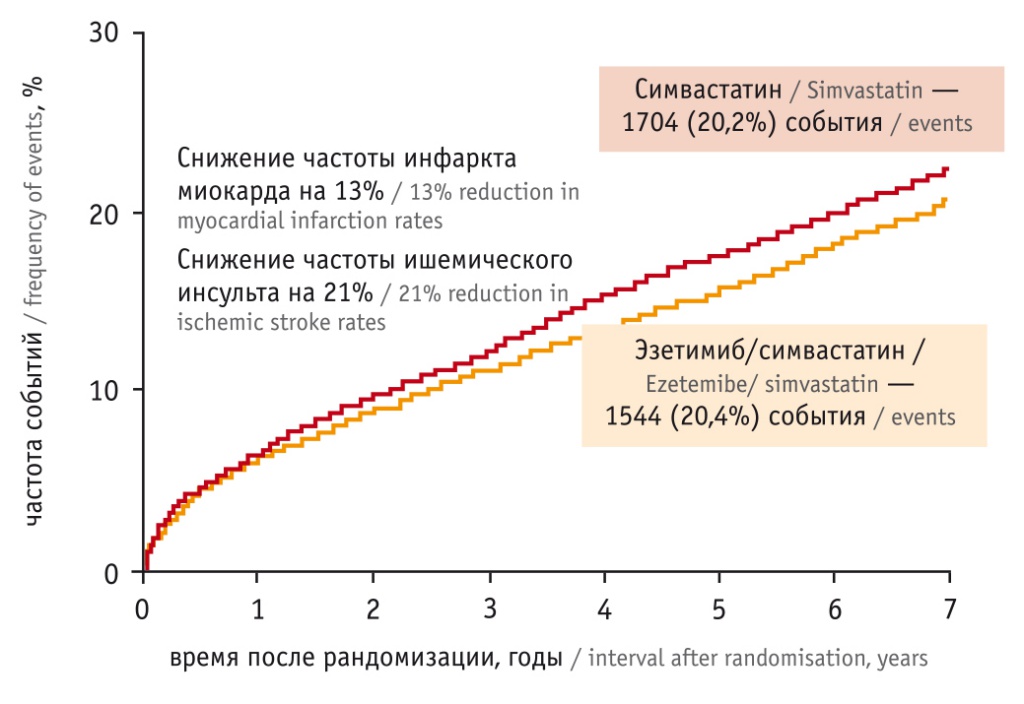
Дальнейшее уменьшение уровня ХсЛПНП и дополнительные клинические преимущества может обеспечить назначение липид-снижающих препаратов с другим механизмом действия, например эзетимиба, в комбинации со статинами. Это убедительно показано в исследовании IMPROVE-IT, в котором были рандомизированы 18 144 пациента с различными формами ОКС и содержанием ХсЛПНП < 2,5 ммоль/л для приема либо комбинации эзетимиба 10 мг и симвастатина 40 мг, либо монотерапии симвастатином 40 мг (на первом этапе исследования симвастатин можно было титровать до 80 мг, если концентрация ХсЛПНП > 2,04 ммоль/л)[10]. В течение 7 лет наблюдения риск событий, входящих в первичную конечную точку (сердечно-сосудистой смерти, ИМ, госпитализации с нестабильной стенокардией, коронарной реваскуляризации и инсульта), был значительно ниже в группе комбинированной терапии, чем в группе монотерапии статинами (32,7% против 34,7%; ОШ = 0,94 (95%-ный ДИ: 0,89–0,99; p < 0,016) (рис. 2).
Рис. 2. Исследование IMPROVE-IT: влияние комбинированной терапии эзетимибом/симвастатином и монотерапии симвастатином на риск развития первичной конечной точки[10]
IMPROVE-IT стало первым исследованием, в котором была получена клиническая выгода — снижение сердечно-сосудистого риска при присоединении нестатинового липид-снижающего препарата к статинам. С учетом результатов этого исследования эзетимиб рекомендован для дальнейшего уменьшения содержания ХсЛПНП у пациентов, не достигших целевого уровня (≥ 1,8 ммоль/л), с очень высоким сердечно-сосудистым риском, в частности после перенесенного ОКС, несмотря на прием максимально переносимых доз статинов[11].
С появлением моноклональных антител ингибиторов PCSK9, которые позволяют дополнительно к эффекту статинов снижать уровень ХсЛПНП на 50–60%, стало очевидно, что еще большее усиление контроля уровня холестерина вполне возможно, безопасно и приносит новые клинические выгоды[12].
В международном исследовании ODYSSEY OUTCOMES, в котором приняли участие 18 924 пациента, перенесших ОКС, в группе плацебо уровень ХсЛПНП составлял в среднем 2,4 ммоль/л (93,3 мг/дл), а на фоне 4-месячной терапии ингибитором PCSK9 алирокумабом — 1,0 ммоль/л (39,8 мг/дл), что в дальнейшем сопровождалось статистически значимым снижением частоты таких сердечно-сосудистых событий, как ИМ, ишемический инсульт, смерть, связанная с ИБС, или нестабильная стенокардия, потребовавшая госпитализации, при хорошей переносимости терапии[13].
Особенно следует подчеркнуть, что выгоды, связанные с уменьшением уровня ХсЛПНП, являются неспецифическими для статинотерапии и отмечались при его дополнительном снижении вследствие присоединения к статинам эзетимиба в исследовании IMPROVE-IT[10] и эволокумаба или алирокумаба в исследованиях ODYSSEY[13] и FOURIER[14]. Эти и другие исследования позволили экспертам в 2019 г. сформулировать новые целевые уровни ХсЛПНП в зависимости от степени сердечно-сосудистого риска[15].
Пациентам с ИБС необходимо достигать содержания ХсЛПНП 1,4 ммоль/л (класс I), а в тех случаях, когда в течение 2 лет на фоне терапии максимально переносимыми дозами статинов развивается повторное сосудистое событие (не обязательно того же типа, что и первичное), может быть рассмотрено достижение целевого уровня ХсЛПНП 1,0 ммоль/л (класс IIb). Если такой уровень не достигнут, к статинам присоединяется эзетимиб, а в дальнейшем, при необходимости, и ингибиторы PCSK9[16].
Следует напомнить о том, что в дополнение к физической нагрузке, диете и контролю веса, которые рекомендуются всем больным, диетические добавки, включающие фитостеролы, могут также снижать концентрацию ХсЛПНП, хотя и нет доказательств улучшения клинических исходов при их использовании[17].
Что касается целевого показателя, то в настоящее время не установлен какой-либо «нижний предел» уровня ХсЛПНП, после достижения которого дальнейшее снижение риска сердечно-сосудистых событий прекратится и появятся нежелательные эффекты. Согласно данным одного из метаанализов, наибольшее уменьшение риска сердечно-сосудистых осложнений отмечалось в подгруппе пациентов, у которых уровень ХсЛПНП оказался < 1,30 ммоль/л[18]. Таким образом, в настоящее время есть все основания предполагать, что чем более выраженным будет снижение уровня ХсЛПНП при назначении статинов и других липид-снижающих препаратов, тем лучше прогноз при ИБС.
СТАТИНЫ И КЛИНИЧЕСКАЯ ПРАКТИКА
Как показал целый ряд исследований, включая и российское эпидемиологическое исследование ЭССЭ-РФ, несмотря на высокую эффективность и доказанную безопасность, назначение статинов врачами первичного звена и терапевтами в России остается явно недостаточным[19]. Согласно этому исследованию, только 42% больных стабильной ИБС знают свой уровень холестерина, меньше 10% получают статины и менее чем 10% из них достигли целевого уровня ХсЛПНП.
В нашей стране, по данным регистра РЕКВАЗА, настороженность врачей в отношении выявления и коррекции гиперхолестеринемии остается низкой[20]. Так, например, пациентам с высоким и очень высоким риском сердечно-сосудистых осложнений (т. е. с абсолютными показаниями к их приему) статины были назначены лишь в 17,8% случаев. В исследовании показано, что даже в тех случаях, когда статины назначались, их дозы были недостаточными и не позволяли достичь целевых значений ХсЛПНП.
Приводим клинический случай, в котором при ведении пациента применена современная технология липид-снижающей терапии, в соответствии с рекомендациями, с достижением целевого уровня ХсЛПНП.
Больной А., 62 лет, осенью 2019 г. поступил в НМИЦ кардиологии с жалобами на давящие боли слева от грудины в 3-м межреберье при ускорении шага через 5 минут, проходящие после замедления темпа ходьбы, редко — перебои в работе сердца, повышение АД до 160/100 мм рт. ст. С 2009 г. отмечается повышение АД до 160/95 мм рт. ст., регулярное лечение не получал.
В 2011 г. в связи с появлением дискомфорта в грудной клетке при нагрузке при обследовании в одной из московских клиник был поставлен диагноз эссенциальной АГ. По данным выполненной в то время коронароангиографии (КАГ), выявлены в передней нисходящей артерии стеноз 40% в среднем сегменте, в устье диагональной артерии — стеноз 80% (артерия малого диаметра), в среднем сегменте интермедиарной ветви — стеноз 40%.
При проведении стрессЭхоКГ не отмечены признаки ишемии миокарда.
В то же время содержание ОХ было 5,69 ммоль/л, ХсЛПНП — 3,79 ммоль/л, триглицеридов — 1,2 ммоль/л, в связи с чем был установлен диагноз первичной гиперхолестеринемии IIa типа.
Больному рекомендовано наряду с контролем АД принимать Омакор 1 капсулу в день и провести курс неинвазивной контрпульсации. Пациент прошел курс неинвазивной контрпульсации, а назначенную медикаментозную терапию в связи с хорошим самочувствием не принимал.
Состояние ухудшилось около года тому назад, когда стали беспокоить боли в грудной клетке при ускоренной ходьбе, проходившие в покое. После обращения к врачу при суточном мониторировании ЭКГ во время болевых ощущений выявлены преходящие ишемические изменения (депрессии сегмента SТ более 1 мм). Проведена нагрузочная проба, которая была прекращена из-за развившегося приступа стенокардии без изменений ЭКГ.
По данным ультразвуковой допплерографии брахиоцефальных артерий, обнаружены стенозы до 40–45%. Амбулаторно назначена терапия: Тромбо АСС 100 мг, аторвастатин 30 мг, бисопролол 1,25 мг, периндоприл 2,5 мг утром и 5 мг вечером, амлодипин 5 мг, пантопразол 20 мг. Поступил для проведения КАГ и лечения.
Из сопутствующих заболеваний — диффузный пневмосклероз, хронический гастрит вне обострения, язвенная болезнь двенадцатиперстной кишки вне обострения. При поступлении АД — 122/80 мм рт. ст., ЧСС — 60 уд/мин. Признаков недостаточности кровообращения нет. Общий анализ крови и мочи без особенностей. Уровень ОХ — 4,2 ммоль/л, ХсЛПВП — 1,25 ммоль/л, ХсЛПНП — 2,6 ммоль/л, триглицеридов — 0,82 ммоль/л. Креатинин — 75,8 мкмоль/л (норма: 62,0–115,0 мкмоль/л). АЛТ — 35,0 Ед/л (норма: 3,0–40,0 Ед/л), АСТ — 25,0 Ед/л (норма: 3,0–34,0 Ед/л).
На ЭКГ ритм синусовый, ЧСС — 64 уд/мин, вегето-метаболические либо гипоксические сдвиги, нарушение внутрижелудочковой проводимости. При ЭхоКГ локальных нарушений сократительной функции нет, удовлетворительная глобальная сократимость миокарда ЛЖ, фракция выброса — 60% (по Симпсону).
При КАГ обнаружен стенозирующий атеросклероз коронарных артерий: передняя нисходящая артерия в проксимальном сегменте стенозирована на 50%; в первой диагональной артерии в проксимальной трети — стеноз 90%; огибающая артерия в проксимальной трети стенозирована на 50%; интермедиарная артерия в проксимальной трети окклюзирована (диаметр — около 3,5 мм) с заполнением дистальной трети по межсистемным коллатералям; правая коронарная артерия в проксимальной трети стенозирована на 70%, далее с неровными контурами. Сделано заключение о возможности проведения ангиопластики со стентированием правой коронарной и диагональной артерии, реканализации интермедиарной артерии.
Таким образом, больной с анамнезом гипертонической болезни с 2009 г. и атеросклерозом коронарных артерий с 2011 г., который не получал регулярное лечение, поступил в отделение с клиникой стенокардии 2-го функционального класса. При обследовании выявлены ишемические изменения ЭКГ при Холтеровском мониторированим ЭКГ (депрессии сегмента SТ более 1 мм) и положительный тест на ишемию при нагрузочной пробе.
Для уточнения поражения коронарных артерий и решения вопроса о дальнейшей тактике лечения проведена КАГ (значительное прогрессирование атеросклероза коронарных артерий), во время которой выполнена транслюминальная баллонная ангиопластика со стентированием в проксимальном сегменте правой коронарной артерии. Установлен стент Promus Element 4,0 × 28 мм с остаточным стенозом в месте установки 0%. Процедура прошла без осложнений.
Инвазивное вмешательство произведено в связи с тем, что, несмотря нормализацию АД и проведение комбинированной антиангинальной терапии, приступы стенокардии сохранялись. После чрескожного коронарного вмешательства в отделении в последующем болей в грудной клетке не было. АД стабилизировалось на уровне 125/80 мм рт. ст., ЧСС — 58 уд/мин. В удовлетворительном состоянии через 2 дня после операции больной был выписан домой с рекомендациями соблюдения диеты и режима физической активности. Назначены ацетилсалициловая кислота 100 мг в день после еды, клопидогрел 75 мг вечером в течение 1 года, бисопролол 5 мг 1/4 таблетки утром под контролем ЧСС (не менее 50 уд/мин); периндоприл 5 мг утром и 2,5 мг вечером (под контролем АД), амлодипин 2,5 мг (под контролем АД), розувастатин 20 мг 1 таблетка вечером с контролем уровня холестерина (рекомендованный уровень ХсЛПНП < 1,4 ммоль/л) и активности трансаминаз печени (АЛТ, АСТ) через 1 месяц.
При недостижении целевого показателя холестерина рекомендовано дополнительно назначить эзетимиб 10 мг. Показано наблюдение гастроэнтеролога с курсовым приемом пантопразола 20 мг осенью и весной по 4 недели.
Одной из задач последующего амбулаторного лечения пациента стали контроль эффективности и возможная коррекция статинотерапии, которую из-за краткости пребывания в стационаре решить невозможно. Здесь особенно важно помнить об обязательной преемственности в ведении пациента после выписки из стационара и его продолжения в амбулаторных условиях.
До госпитализации пациент принимал аторвастатин 20 мг, однако повторный анализ липидов в стационаре показал недостаточный контроль содержания ХсЛПНП. В стационаре для усиления терапии был назначен розувастатин 20 мг вместо аторвастатина 20 мг. Амбулаторно через 1 месяц при повторном анализе крови уровень ОХ оказался 3,44 ммоль/л, ХсЛПВП — 1,1 ммоль/л, ХсЛПНП — 1,89 ммоль/л, триглицеридов — 0,99 ммоль/л, а активность трансаминаз была в пределах нормальных значений. Для усиления контроля за содержанием липидов и достижения нового целевого уровня холестерина в соответствии с рекомендациями Национального общества по изучению атеросклероза 2017 г.[21] и ESC/European Atherosclerosis Society (EAS) 2019 г.[15] назначена комбинация розувастатина 20 мг и эзетимиба 10 мг, на фоне приема которой через 1,5 месяца концентрация ОХ стала 2,82 ммоль/л, ХсЛПВП — 1,25 ммоль/л, ХсЛПНП — 1,27 ммоль/л, триглицеридов — 0,66 ммоль/л, причем какой-либо динамики активности трансаминаз не было.
Таким образом, применение фиксированной комбинации розувастатина в дозе 20 мг и эзетимиба в дозе 10 мг (Розулип Плюс) позволило значительно улучшить показатели липидного профиля с достижением рекомендуемого в настоящее время целевого уровня ХсЛПНП у пациента с ИБС.
ОБСУЖДЕНИЕ
Представлен клинический случай успешного лечения, однако имеется и большая доказательная база, свидетельствующая об эффективности примененной комбинации[22–25]. Убедительные данные получены в многоцентровом рандомизированном исследовании ACTE с использованием двойного слепого метода, в котором изучались эффективность и безопасность фиксированной комбинации эзетимиба 10 мг с розувастатином 5 или 10 мг/сут в сравнении с удвоением дозы розувастатина от 5 до 10 мг/сут и от 10 до 20 мг/сут у 440 больных с различной степенью сердечно-сосудистого риска, в том числе с диагнозом стабильной ИБС, принимавших розувастатин без достижения соответствующих целевых уровней ХсЛПНП[22].
Добавление эзетимиба к розувастатину значительно чаще, чем удвоение дозы последнего, приводило к достижению целевых уровней ХсЛПНП < 70 или < 100 мг/дл (59,4% против 30,9%, p < 0,001) и < 70 мг/дл среди всех пациентов (43,8% против 17,5%, p < 0,001). При этом частота побочных эффектов в группах была сопоставимой.
Ранее показано, что при присоединении эзетимиба к статинотерапии не увеличивается частота повышения уровня креатинфосфокиназы более того уровня, который отмечался в группе монотерапии статинами[26].
Что касается тактики назначения комбинированной терапии, возможны два основных варианта. Можно назначить статины до максимально переносимой дозы с присоединением эзетимиба в случае недостижения целевого показателя ХсЛПНП (< 1,4 ммоль/л) в группе очень высокого риска, а затем перевести на прием фиксированной комбинации розувастатина и эзетимиба, если цель была достигнута, для удобства и повышения приверженности к терапии.
Возможен и другой вариант, когда при недостаточно эффективной монотерапии статинами назначается фиксированная комбинация розувастатина и эзетимиба, что и было сделано в описанном клиническом случае. Переход на комбинированную терапию вместо увеличения дозы розувастатина до 40 мг представляется более целесообразным. Согласно клиническим исследованиям, при удвоении доз статинов, например розувастина с 20 мг до 40 мг, уровень ХсЛПНП дополнительно уменьшается на 5–6%, а при присоединении второго липид-снижающего препарата эзетимиба — на 15–20%, а нередко и более значительно[22]. Подобная тактика оказалась вполне успешной у нашего пациента.
ПОВЫШЕНИЕ ПРИВЕРЖЕННОСТИ К ЛИПИД-СНИЖАЮЩЕЙ ТЕРАПИИ
Не менее важным представляется вопрос переносимости и безопасности липид-снижающей терапии, которые коррелируют с приверженностью к лечению. В целом статинотерапия характеризуется высокой безопасностью и хорошей переносимостью, однако с увеличением дозы статинов возрастает вероятность нежелательных эффектов (повышения активности трансаминаз, нарушения углеводного обмена и др.).
Здесь также очевидны преимущества комбинированной липид-снижающей терапии: при значительно возросшем липид-снижающем эффекте сохраняется безопасность терапии. Следует напомнить, что лечение эзетимибом хорошо переносится. Наш пациент хорошо переносил терапию фиксированной комбинацией розувастатина и эзетимиба, жалоб или изменения анализов нет.
После назначения липид-снижающей терапии с достижением целевого уровня ХсЛПНП следующей важной задачей амбулаторного лечения ИБС является сохранение приверженности. В рекомендациях европейских экспертов ESC/EAS указывается, что, несмотря на большое количество доказательств эффективности и безопасности статинов в первичной и вторичной профилактике, низкая приверженность остается постоянным барьером с показателями < 50% в ряде исследований[11] Особенно уменьшается приверженность при длительном лечении. Между тем нет сомнений в том, что нарушения предписанного режима лечения повышают заболеваемость и смертность[15, 21].
В одном из наших исследований показано, что приверженность к терапии статинами в течение первого года наблюдения после чрескожного коронарного вмешательства у пациентов со стабильной стенокардией статистически значимо связана с меньшим количеством сердечно-сосудистых событий и фатальных исходов при продолжении приема через 5 лет после вмешательства[27].
В других российских исследованиях также установлено, что статины назначаются недостаточно часто, их дозы были небольшими и не позволяли достичь целевых значений ХсЛПНП, однако и такая терапия продолжается даже после перенесенного ИМ только несколько месяцев[19, 20, 28].
Международное исследование EUROASPIRE, которое началось почти два десятилетия назад, в недавнем пятом анализе продемонстрировало, что количество больных стабильной ИБС, принимающих статины, в последние годы значительно увеличилось, а частота достижения целевого уровня ХсЛПНП < 1,8 ммоль/л остается низкой (табл. 3)[29].
Таблица 3
Исследование EUROASPIRE: доля пациентов с уровнем холестерина липопротеинов низкой плотности < 1,8 ммоль/л на фоне липид-снижающей терапии, %[29]
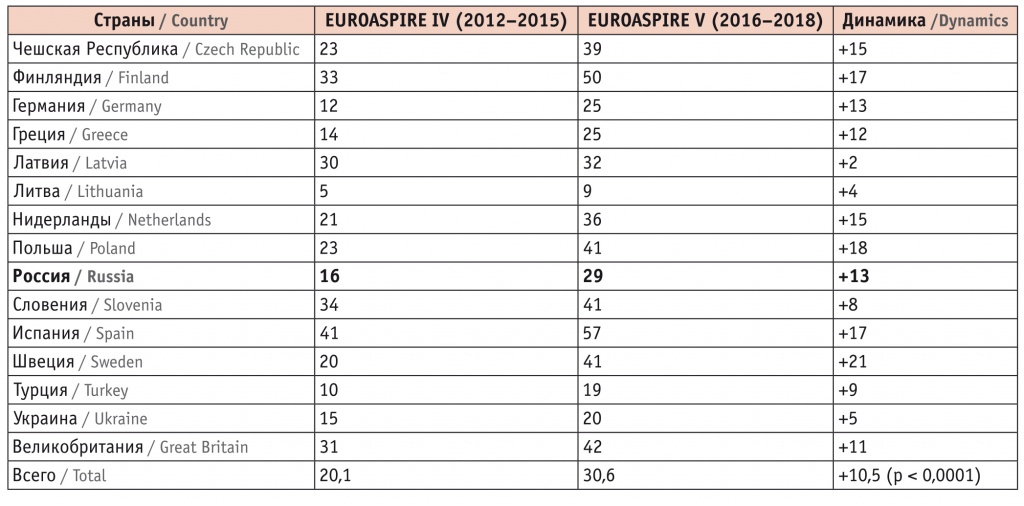
Назначение более эффективных и удобных, с хорошей переносимостью алгоритмов лечения, в частности фиксированных комбинаций липид-снижающих препаратов (розувастатин + эзетимиб), будет способствовать формированию нового порядка приема лекарственных препаратов и приведет к снижению заболеваемости и смертности пациентов с различными вариантами течения ИБС.
ЗАКЛЮЧЕНИЕ
Дислипидемию следует корригировать с использованием фармакологических вмешательств, а также с помощью модификации образа жизни. Пациенты с установленным диагнозом ИБС имеют очень высокий риск сердечно-сосудистых осложнений, поэтому у них рекомендуется добиваться значительного снижения уровня атерогенных фракций холестерина, холестерина ЛПНП (ХсЛПНП) менее 1,4 ммоль/л, согласно новым рекомендациям европейских и российских экспертов. Низкий и очень низкий уровень ХсЛПНП хорошо переносится и ассоциируется с меньшим количеством сердечно-сосудистых событий.
С помощью комбинации препаратов, особенно в фиксированных дозировках, с механизмами действия, дополняющими друг друга, можно в значительной степени усилить их гиполипидемическое действие, что позволит у подавляющего большинства пациентов достичь целевого показателя.
Показан отличный клинический и лабораторный результат применения новой фиксированной комбинации розувастатина и эзетимиба, а в качестве дополнительных аргументов в ее пользу можно привести уменьшение стоимости терапии и удобство приема с увеличением приверженности пациентов к лечению.
Поступила: 15.06.2020
Принята к публикации: 08.07.2020








