Темпы распространения ожирения в мире сопоставимы с масштабами эпидемии[1]. Распространенность избыточной массы тела и ожирения в России составляет 59,2% и 24,1% соответственно[2]. По данным российского многоцентрового наблюдательного исследования ЭССЕ-РФ, распространенность ожирения составила 29,7%[3]. Ожирение — хроническое прогрессирующее заболевание, ассоциированное с риском развития СД 2 типа (СД2), сердечно-сосудистой и онкологической патологии, нарушениями функции репродуктивной системы и другими осложнениями[1]. В настоящее время известно, что не столько общее, сколько висцеральное ожирение (ВО) и его нейрогуморальные факторы участвуют в формировании системного воспаления, атерогенеза, АГ, тромбообразования, что в значительной степени может определять сердечно-сосудистый риск (CCР). Одним из наиболее доступных методов прямой визуализации ВО является оценка толщины эпикардиальной жировой ткани (тЭЖТ), расположенной между миокардом и висцеральным листком перикарда, с помощью ЭхоКГ[4].
ЭЖТ, как и висцеральные жировые депо других локализаций, обладает нейроэндокринной активностью, синтезирует адипокины, цитокины, хемокины и другие факторы, участвующие в патогенезе кардиометаболических осложнений[5, 6]. Особенности распределения жировой ткани в организме зависят от разных факторов, одним из которых является нарушение обмена лептина с развитием лептинорезистентности (ЛР) вследствие нарушения чувствительности рецепторов к лептину в гипоталамусе и периферических тканях[7]. При этом происходят отложение жира в висцеральных жировых депо, нарушение физиологической регуляции выработки инсулина, активация атерогенных адипокинов, что может привести к развитию инсулинорезистентности, атеросклероза и других метаболических нарушений[8]. В зависимости от соотношения подкожного или висцерального ожирения и наличия или отсутствия метаболических нарушений выделяют разные фенотипы ожирения: метаболически тучный фенотип ожирения (МТФО) при преобладании ВО и метаболических нарушений и метаболически здоровый фенотип ожирения (МЗФО) при наличии общего ожирения, отсутствии патологического ВО и метаболических нарушений.
Целью исследования стало изучение взаимосвязей показателей лептинового обмена с нарушениями углеводного, липидного обменов, а также развитием субклинического атеросклероза у мужчин с разными метаболическими фенотипами ожирения.
МАТЕРИАЛЫ И МЕТОДЫ
Отбор больных проводился в поликлиническом отделении Алтайского краевого кардиологического диспансера при первичном обращении в учреждение по поводу нелеченой АГ. В исследование были включены 110 мужчин в возрасте 44–65 лет с АГ, с ИМТ 25–30 кг/м2 и отсутствием клинических проявлений атеросклероза любых локализаций и СД2. Обследуемые были разделены на 2 группы в зависимости от метаболического фенотипа ожирения, определенного по величине тЭЖТ. Патологическим эпикардиальным ожирением считалось увеличение тЭЖТ ≥ 7 мм, показавшее в клинических исследованиях взаимосвязь с риском развития инсулинорезистентности (ИР), дислипидемии и другими метаболическими нарушениями[9, 10]. В группу 1 были включены 50 пациентов с МЗФО, тЭЖТ < 7 мм, в группу 2 — 60 пациентов с МТФО и тЭЖТ ≥ 7 мм. У всех участников измеряли уровни инсулина, свободного лептина (СЛ), растворимых рецепторов к лептину (РРЛ), определяли индекс ИР Homeostasis Model Assessment of Insulin Resistance (HOMA-IR), свободный лептиновый индекс (СЛИ), вычисленный как отношение СЛ/РРЛ, липидный спектр, а также наличие субклинического мультифокального атеросклероза. Лабораторное исследование проводилось с использованием стандартных наборов реактивов фирмы Human (Германия). В сыворотке крови натощак оценивали содержание общего холестерина (ХС), триглицеридов (ТГ) энзиматическим методом. Определяли также уровень ХС ЛПВП в супернатантной плазме. Концентрацию ХС ЛПНП рассчитывали по формуле Фривальда. Содержание глюкозы в капиллярной крови определяли глюкозооксидазным методом. Уровни лептина, РРЛ, инсулина сыворотки крови оценивали методом иммуноферментного анализа. СЛИ определялся как соотношение СЛ/РРЛ. Вычисление индекса HOMA-IR производилось по формуле:
[инсулин натощак (мкМЕ/мл) × глюкоза крови натощак (ммоль/л)]/22,5.
При показателе HOMА-IR > 2,77 диагностировалась ИР.
Эпикардиальное ожирение оценивали с помощью ЭхоКГ в В-режиме на аппарате Vivid 5 с механическим секторным датчиком 3,5 МГц. Измеряли тЭЖТ за свободной стенкой правого желудочка в области атриовентрикулярной борозды в миллиметрах в парастернальной позиции по длинной оси ЛЖ[9]. Субклинический атеросклероз коронарных артерий (КА) оценивали с помощью мультиспирального рентгеновского компьютерного томографа Aquilion 64 Toshiba (Япония) с обработкой данных на рабочей станции VITREA, брахиоцефальных артерий (БЦА) — на аппарате VIVID S6 линейным широкополосным многочастотным датчиком 8L-RS с диапазоном частот 4–13,3 МГц в В-режиме. Постоянную медикаментозную терапию пациенты обеих групп не получали.
Статистическая обработка данных проводилась с помощью программы STATISTICA 10.0. Для каждой из непрерывных величин, имеющих нормальное распределение, приведены среднее (М) и стандартное отклонение (SD), для величин с ненормальным распределением приведены медиана (Ме), нижний и верхний квартили (НКв; ВКв). Гипотеза о нормальном распределении проверялась с использованием критерия Шапиро — Уилка. Достоверность различий между двумя независимыми группами проверялась с помощью U-критерия Манна — Уитни. Для статистического описания связи между разными параметрами вычислялся коэффициент ранговой корреляции Спирмена.
Для прогнозирования данных использовался регрессионный анализ. Также проводился многофакторный регрессионный анализ для оценки вклада различных факторов в формирование субклинического атеросклероза. Уровнем статистической значимости считали p < 0,05.
РЕЗУЛЬТАТЫ
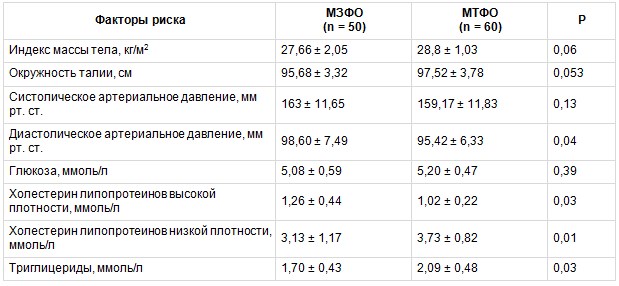
При анализе основных метаболических факторов риска (ФР) и антропометрических показателей было выявлено, что у больных с МТФО более высокие показатели ТГ, ХС ЛПНП, более низкие значения ХС ЛПВП, чем в группе МЗФО. Не было различий в окружности талии (ОТ), являющейся до настоящего времени основным критерием ВО. Значения ИМТ также значимо не различались в исследуемых группах. Полученные данные представлены в таблице 1.
Таблица 1
Анализ метаболических факторов риска и антропометрических показателей в группах с метаболически тучным (МТФО) и метаболически здоровым (МЗФО) фенотипами ожирения, М ± SD
При сравнении ЛР в исследуемых группах наблюдались более высокие средние показатели СЛ, СЛИ в группе МТФО и более низкий уровень РРЛ в сравнении с группой МЗФО. Все различия были статистически значимыми (табл. 2). Также в группе МТФО отмечались более высокие показатели ИР по сравнению с группой МЗФО (табл. 3).
Таблица 2
Показатели лептинорезистентности в группах с метаболически тучным (МТФО) и метаболически здоровым (МЗФО) фенотипами ожирения, М ± SD

Таблица 3
Показатели инсулинорезистентности в группах с метаболически тучным (МТФО) и метаболически здоровым (МЗФО) фенотипами ожирения, М ± SD
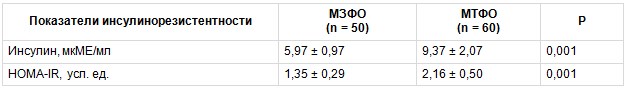
При проведении корреляционного анализа между уровнем СЛ и факторами ССР в группе МТФО была выявлена значимая положительная взаимосвязь уровня СЛ с тЭЖТ, содержанием инсулина, индексом HOMA-IR (рис. 1). В группе МЗФО уровень СЛ положительно коррелировал с тЭЖТ, индексом HOMA-IR, уровнем ТГ, однако сила корреляционной взаимосвязи была слабой (r = 0,15, p < 0,05; r = 0,17, p < 0,05; r = 0,17, p < 0,05).
Рис. 1. Корреляции между уровнем свободного лептина (СЛ) и факторами риска в группе метаболически тучного фенотипа ожирения: А — между уровнем СЛ и толщиной эпикардиальной жировой ткани (тЭЖТ); В — между уровнями СЛ и инсулина; С — между уровнем СЛ и индексом HOMA-IR
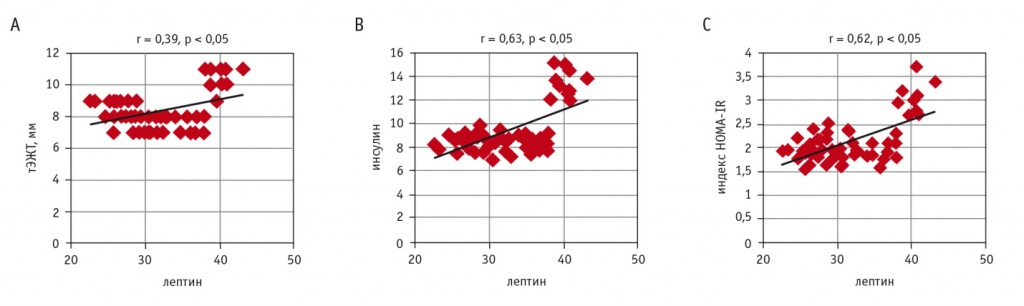
При проведении корреляционного анализа между СЛИ и ФР в группе эпикардиального ожирения (ЭО) была выявлена значимая положительная корреляция СЛИ с тЭЖТ, уровнем инсулина, индексом HOMA-IR, причем наибольшая сила взаимосвязи была между СЛИ и индексом HOMA-IR (рис. 2). В группе без ЭО СЛИ положительно коррелировал с тЭЖТ, ТГ, но корреляция была слабой (r = 0,12, p < 0,05; r = 0,15, p < 0,05).
Рис. 2. Корреляции между свободным лептиновым индексом (СЛИ) и факторами риска в группе метаболически тучного фенотипа ожирения: А — между СЛИ и толщиной эпикардиальной жировой ткани (тЭЖТ); В — между СЛИ и уровнем инсулина; С — между СЛИ и индексом HOMA-IR
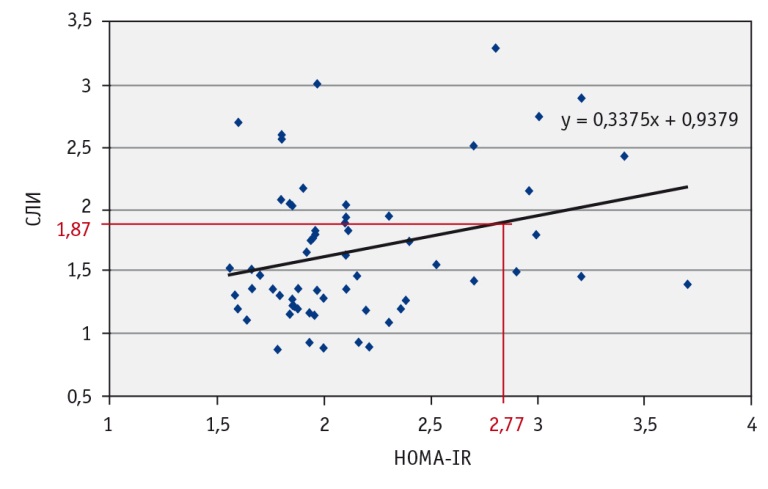
В результате анализа данных в группе МТФО у 11 пациентов была выявлена ИР с индексом HOMA-IR ≥ 2,77, после чего внутри группы были выделены пациенты с наличием ИР (n = 11) и отсутствием ее (n = 49), у которых определили средние значения СЛИ. Данный параметр был взят для оценки в связи с найденной наибольшей силой корреляции между СЛИ и индексом HOMA-IR в группе МТФО. У пациентов с ИР наблюдался более высокий средний показатель СЛИ, чем у больных без нее: 2,15 ± 0,68 против 1,56 ± 0,5 (р < 0,005). Используя линейный регрессионный анализ, мы получили уравнение регрессии и вычислили значение СЛИ, с которого начинала определяться ИР с HOMA-IR ≥ 2,77. Данный показатель составил 1,87 (рис. 3).
Рис. 3. Линия регрессии, отражающая зависимость между свободным лептиновым индексом (СЛИ)и наличием инсулинорезистентности. Примечание: y = 0,3375x + 0,9379 — уравнение регрессии, где y — СЛИ; х — индекс HOMA-IR, равный 2,77; 0,3375, 0,9379 — поправочные коэффициенты
При оценке субклинического атеросклероза КА в группе МТФО, по данным МСКТ КА, было выявлено, что 90% пациентов имели атеросклероз одной и более КА. В группе МЗФО атеросклероз КА встречался у 8% пациентов. Кроме того, в группе МЗФО не было гемодинамически значимых стенозов КА. В группе МТФО гемодинамически значимые стенозы КА (50–55%) наблюдались у 8 (13,3%) пациентов.
Распространенность атеросклероза БЦА в группе МТФО составила 57%. В группе МЗФО атеросклеротические бляшки БЦА 20–25% встречались у 4% больных.
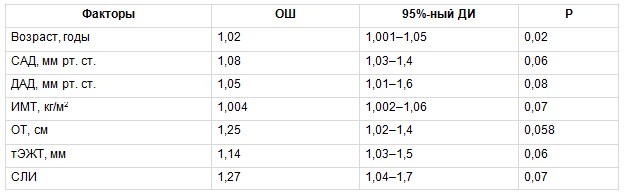
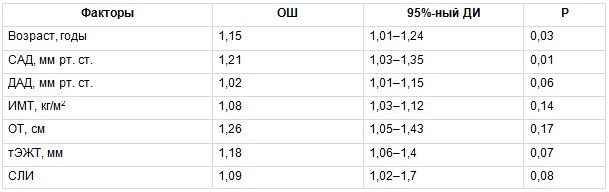
Для оценки связи изучаемых ФР с наличием субклинического атеросклероза КА в группе МТФО был проведен биномиальный регрессионный анализ, в котором зависимой переменной было наличие атеросклеротических бляшек КА у обследованных. В число ковариантов включены следующие факторы: возраст, систолическое АД (САД), диастолическое АД, ИМТ, ОТ, тЭЖТ, СЛИ. В результате установлено, что повышали вероятность наличия субклинического атеросклероза КА у пациентов с МТФО не только традиционные ФР — возраст и ОТ, но и новые маркеры ССР — тЭЖТ и СЛИ, причем их влияние было более значимым (табл. 4). В группе МЗФО также проведена оценка взаимосвязи вышеприведенных ФР с наличием субклинического атеросклероза КА. В данной группе только возраст статистически значимо повышал вероятность наличия субклинического атеросклероза КА (табл. 5).
Таблица 4
Многофакторный биномиальный регрессионный анализ, отражающий связь между изучаемыми факторами риска и вероятностью развития субклинического атеросклероза коронарных артерий в группе метаболически тучного фенотипа ожирения
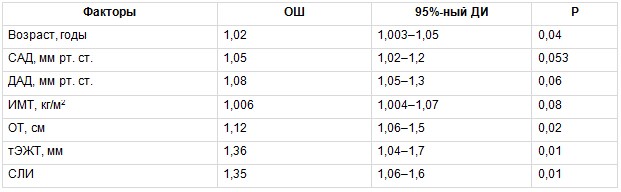
Примечание. Здесь и в таблицах 5–7: ДАД — диастолическое артериальное давление, ДИ — доверительный интервал, ИМТ — индекс массы тела, ОТ — окружность талии, ОШ — отношение шансов, САД — систолическое артериальное давление, СЛИ — свободный лептиновый индекс, тЭЖТ — толщина эпикардиальной жировой ткани.
Таблица 5
Многофакторный биномиальный регрессионный анализ, отражающий связь между изучаемыми факторами риска и вероятностью развития субклинического атеросклероза коронарных артерий в группе метаболически здорового фенотипа ожирения
Затем методом биномиального регрессионного анализа был изучен вклад традиционных ФР, а также тЭЖТ и СЛИ в развитие атеросклероза БЦА. В группе МТФО вероятность наличия субклинического атеросклероза увеличивали возраст, уровень САД, а также показатели тЭЖТ и СЛИ (табл. 6). В группе МЗФО вероятность наличия субклинического атеросклероза БЦА увеличивалась только в зависимости от традиционных ФР, таких как возраст, САД (табл. 7).
Таблица 6
Многофакторный биномиальный регрессионный анализ, отражающий связь между изучаемыми факторами риска и вероятностью развития субклинического атеросклероза брахиоцефальных артерий в группе метаболически тучного фенотипа ожирения
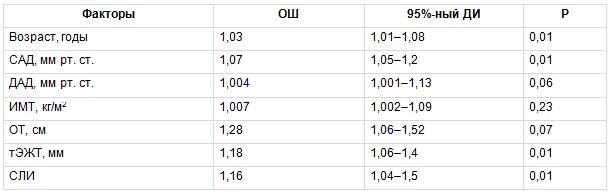
Таблица 7
Многофакторный биномиальный регрессионный анализ, отражающий связь между изучаемыми факторами риска и вероятностью развития субклинического атеросклероза брахиоцефальных артерий в группе метаболически здорового фенотипа ожирения
ОБСУЖДЕНИЕ
Ожирение является гетерогенным заболеванием с различным риском метаболических нарушений. При этом показатели ИМТ и ОТ учитывают общее количество жировой ткани в организме, т.е. как нейрогуморально активного висцерального жира, так и инертного подкожного жира, не обладающего значимой эндокринной активностью.
Взаимосвязь эпикардиального ожирения (ВО) с атеросклерозом КА доказана в ряде клинических исследований[10, 11]. При этом статистически значимая взаимосвязь ОТ и ВО выявляется далеко не во всех исследованиях, хотя традиционно ОТ считается критерием ВО. Так, в исследовании S.E. Litwin (2012) продемонстрировано, что при наличии ВО по данным КТ показатель ОТ у многих больных мог быть в норме[12], а при наличии абдоминального ожирения по ОТ сохранялся нормальный метаболический профиль. В нашем исследовании в группе пациентов с МЗФО с ИМТ от 25 до 30 кг/м2 и ОТ около 95 см наблюдался практически нормальный метаболический профиль, что говорит о низкой значимости традиционных критериев ожирения, таких как ИМТ и ОТ, в прогнозе ССР.
Причины разного распределения жировой ткани в организме до конца не ясны. В настоящее время активно изучается роль ЛР в формировании ВО. В норме лептин — белок, кодируемый Ob геном, регулирует пищевой и инсулиновый обмен, препятствуя развитию ВО и ИР[7]. Свое действие лептин осуществляет через специфические рецепторы (РРЛ), расположенные в гипоталамусе и периферических тканях. В условиях нарушения чувствительности к РРЛ исчезает физиологическое действие лептина по регуляции пищевого поведения, формируются гиперлептинемия и ее основное осложнение — ВО, приводящее к формированию МТФО.
В нашем исследовании в группе пациентов с МТФО наблюдался более высокий уровень лептина, меньший уровень РРЛ, чем в группе МЗФО. Полученные нами результаты подтверждаются данными современных исследований, в которых установлено, что уменьшение количества рецепторов к лептину и/или нарушения чувствительности к РРЛ приводят к гиперлептинемии вследствие ЛР и к формированию ВО[13, 14].
Также в нашем исследовании в группе пациентов с МТФО наблюдались более высокие показатели инсулина и индекса HOMA-IR. Полученные результаты могут объясняться эндокринной активностью эпикардиального жира, синтезирующего адипокины и хемокины, приводящие к ИР[15]. C другой стороны, более высокие показатели ИР в группе МТФО связаны и с гиперлептинемией, что подтверждается современными исследованиями[16].
Корреляционный анализ, проведенный в исследуемых группах, подтвердил положительную статистически значимую взаимосвязь между уровнем СЛ и индексом HOMA-IR, содержанием инсулина, а также тЭЖТ, которая является истинным депо висцеральной жировой ткани.
В настоящее время активно изучается роль СЛИ в увеличении ССР. Так, в исследовании M.A Donoso и соавт. (2013) была выявлена положительная корреляционная взаимосвязь между СЛИ и индексом HOMA-IR в группе с общим ожирением[17]. В нашем исследовании у пациентов с МТФО (группа 2) наблюдался более высокий показатель СЛИ, чем в группе пациентов с МЗФО (группа 1). При проведении многофакторного биномиального регрессионного анализа мы обнаружили, что наиболее значимый вклад в развитие субклинического мультифокального атеросклероза в группе 2 вносят СЛИ и тЭЖТ. На основании полученных нами данных можно использовать СЛИ в качестве лабораторного маркера ЛР в клинической практике в отсутствие общепринятых критериев ЛР.
В нашем исследовании была выявлена наиболее сильная связь между СЛИ и индексом HOMA-IR (r = 0,67, p = 0,001) в группе 2. После выделения подгрупп пациентов с наличием и отсутствием ИР мы обнаружили, что в группе с ИР наблюдался более высокий средний показатель СЛИ. Это еще раз подтверждает, что СЛИ может иметь предикторную значимость в отношении риска развития ИР.
ЗАКЛЮЧЕНИЕ
Нарушение обмена лептина с развитием лептинорезистентности (ЛР) может приводить к формированию метаболически тучного фенотипа ожирения и его осложнениям. Значение свободного лептинового индекса, равное 1,87, может быть использовано не только как лабораторный маркер ЛР, но и как ранний критерий риска развития инсулинорезистентности и будущих кардиометаболических осложнений.








