Сердечно-сосудистые заболевания (ССЗ), связанные с атеросклерозом, по-прежнему остаются основными причинами заболеваемости и смертности в мире, в том числе в Российской Федерации[1, 2]. За последние несколько десятилетий выявлены основные факторы риска развития ССЗ, в том числе АГ, гиперхолестеринемия, СД и др.[3]. И хотя наиболее доступным и эффективным способом профилактики ССЗ является постоянное поддержание здорового образа жизни, за последние десятилетия разработаны эффективные и безопасные методы коррекции факторов риска, например антигипертензивные, липид-снижающие, сахароснижающие и другие лекарственные препараты.
Тем не менее распространенность нездорового образа жизни по-прежнему высока, а факторы сердечно-сосудистого риска недостаточно активно модифицируются, в том числе у пациентов, которые считаются подверженными высокому и очень высокому сердечно-сосудистому риску[1].
Когда диетические мероприятия и модификация образа жизни недостаточны для снижения риска атеросклеротических ССЗ, требуется фармакотерапия. Предотвращение сердечно-сосудистых событий (осложнений) путем уменьшения риска ССЗ является главной темой недавно представленных новых рекомендаций Европейского кардиологического общества (European Society of Cardiology, ESC) по предупреждению ССЗ в реальной клинической практике[3].
С помощью новых рекомендаций ESC предполагается решить следующие задачи: создание единого документа по первичной профилактике для первичного звена и стационаров; персонализация сердечно-сосудистой профилактики вместо принципа «Один размер подходит всем»; внимание к вопросам профилактики у лиц пожилого возраста; вовлечение пациента, совместное принятие решений; обновление шкалы (предикторов) сердечно-сосудистого риска (SCORE2, SCORE2-OP); оценка потенциальных расходов/стоимости профилактических программ[3].
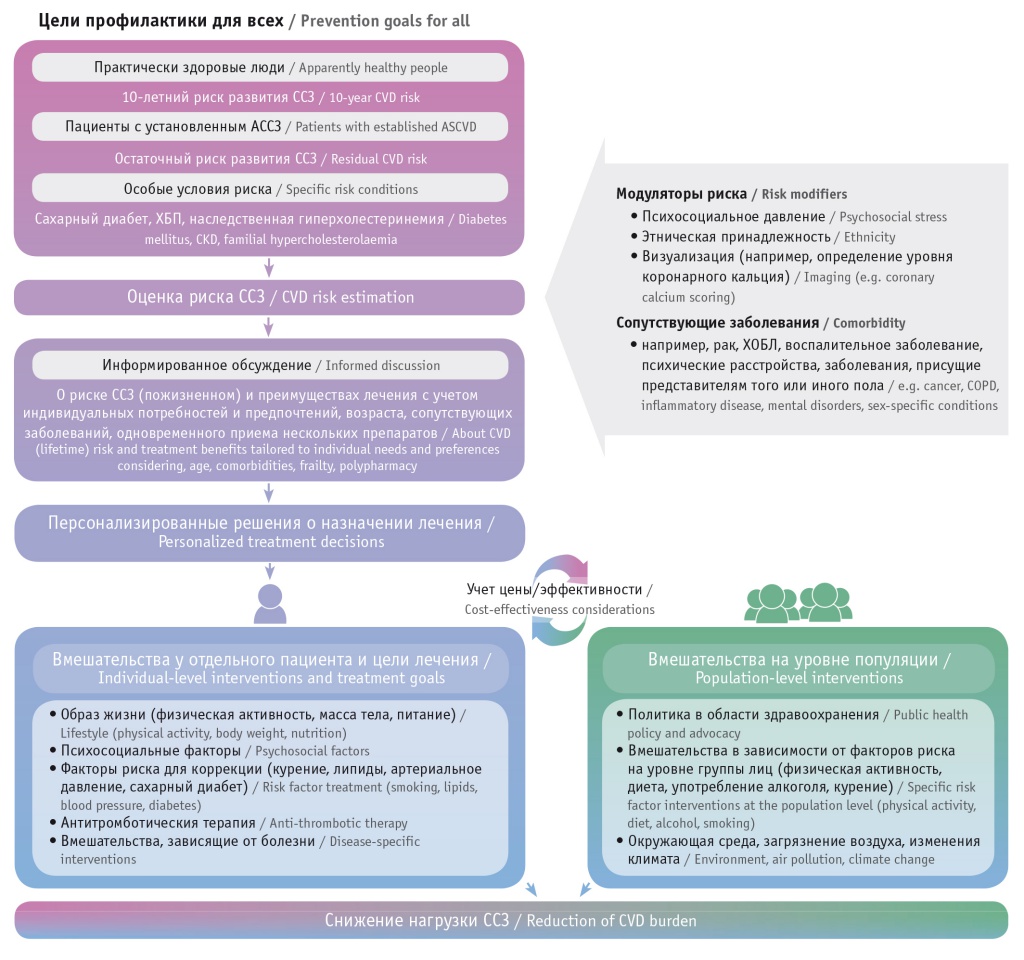
В центральной иллюстрации этих рекомендаций отражен поэтапный подход к комплексной оценке сердечно-сосудистого риска, на который планируется влиять (рис. 1). С целью упрощенного использования конкретных алгоритмов по снижению риска ССЗ предложено классифицировать людей на три категории:
- практически здоровые люди (отсутствуют ССЗ и факторы их риска);
- пациенты с установленным диагнозом связанного с атеросклерозом ССЗ;
- больные, имеющие специфические факторы риска ССЗ (СД, хроническую болезнь почек и гиперхолестеринемию).
Рис. 1. Поэтапный подход и комплексная оценка сердечно-сосудистого риска, на который планируется оказать влияние[3].
Примечание: АССЗ — атеросклеротическое сердечно-сосудистое заболевание, ССЗ — сердечно-сосудистое заболевание, ХБП — хроническая болезнь почек, ХОБЛ — хроническая обструктивная болезнь легких
КЛАССИФИКАЦИЯ РИСКА СЕРДЕЧНО-СОСУДИСТЫХ ЗАБОЛЕВАНИЙ
Нынешние клинические рекомендации по профилактике ССЗ в клинической практике сосредоточены главным образом, но не исключительно, на риске и профилактике ССЗ. Сюда входят факторы риска, прогнозирование и модификаторы риска, а также клинические состояния, при которых часто повышается вероятность возникновения ССЗ. Выявление пациентов, которые получат наибольшую пользу от коррекции факторов риска ССЗ, имеет решающее значение для эффективности профилактических мероприятий[3].
В целом чем выше абсолютный риск ССЗ, тем выше абсолютная польза от коррекции факторов риска и, следовательно, тем меньше число случаев, которые необходимо пролечить, чтобы предотвратить одно сердечно-сосудистое событие (осложнение) в течение определенного времени.
НОВАЯ ШКАЛА ОЦЕНКИ СЕРДЕЧНО-СОСУДИСТОГО РИСКА
Практически здоровые люди — это лица без установленного диагноза ССЗ, СД 2 типа или тяжелых сопутствующих заболеваний. В клинических рекомендациях по профилактике ESC 2016 года[4]/span> алгоритм оценки системного коронарного риска (шкала SCORE) использовался для определения 10-летнего риска смерти от сердечно-сосудистых причин. Однако заболеваемость ССЗ (нефатальный инфаркт миокарда (ИМ), нефатальный инсульт) в сочетании с сердечно-сосудистой смертностью лучше отражает общее бремя ССЗ. Обновленная шкала SCORE — SCORE2 и SCORE2-ОР, используемая в новых рекомендациях (рис. 2), оценивает 10-летний риск фатальных и нефатальных сердечно-сосудистых событий (ИМ, инсульта) у практически здоровых людей в возрасте 40–69 лет и 70–89 лет соответственно с факторами риска, которые не лечились или находились в стабильном состоянии в течение нескольких лет[5].
Рис. 2. Шкалы для оценки риска фатальных (сердечно-сосудистой смерти) и нефатальных (инфаркта миокарда, инсульта) атеросклеротических сердечно-сосудистых событий: А — SCORE2-OP, В — SCORE2[3].
Примечание: ССЗ — сердечно-сосудистые заболевания, SCORE2 — систематическая оценка риска заболеваний коронарной артерии 2, SCORE2-OP — систематическая оценка риска заболеваний коронарной артерии 2 у пожилого населения
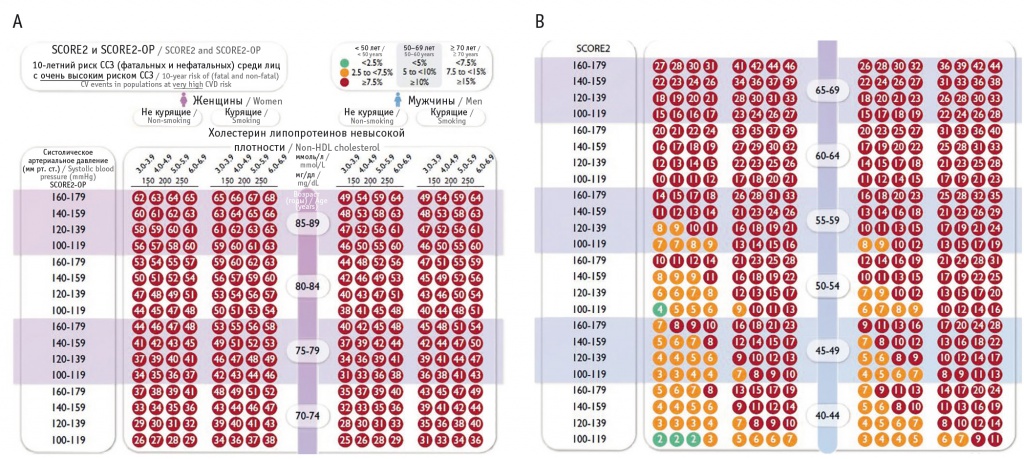
Несколько конкретных соображений применимы к оценке риска ССЗ у пожилых людей. Во-первых, связь между классическими факторами риска, такими как дислипидемия и АГ, с риском развития ССЗ ослабевает с возрастом[6]. Во-вторых, выживаемость без ССЗ постепенно отделяется от общей выживаемости с увеличением возраста, поскольку риск смертности и без ССЗ возрастает («конкурирующий риск»)[7]. По этим причинам традиционные модели риска, которые не учитывают конкурирующий риск смерти, не связанной с ССЗ, как правило, переоценивают фактический 10-летний риск ССЗ, а следовательно, и потенциальную пользу лечения[8]. С помощью шкалы SCORE2-OP определяют 5-летний и 10-летний риск фатальных и нефатальных сердечно-сосудистых событий (ИМ, инсульта) с поправкой на конкурирующие риски у практически здоровых людей в возрасте > 70 лет[9].
ГИПЕРХОЛЕСТЕРИНЕМИЯ КАК ГЛАВНЫЙ И НЕЗАВИСИМЫЙ ФАКТОР РИСКА
При рассмотрении рекомендаций видно, что выявление и коррекция гиперхолестеринемии имеют огромное значение в профилактике ССЗ и у практически здоровых людей, и особенно у пациентов с атеросклерозом и ССЗ на его основе[3]. Причинная роль ХС ЛПНП и других липопротеинов, содержащих аполипопротеин В (апоВ), в развитии ССЗ получила подтверждение в генетических, наблюдательных и интервенционных (на фоне липид-снижающих препаратов) исследованиях, что констатировано в первом консенсусном документе европейских экспертов по атеросклерозу[10].
Однако каковы ключевые биологические механизмы, лежащие в основе центральной роли ХС ЛПНП в сложной патофизиологии ССЗ, хронического и многогранного процесса на протяжении всей жизни, который в итоге завершается атеротромботическим событием? Во втором консенсусном документе, опубликованном в 2020 году, рассматриваются факторы, модулирующие атерогенность ХС ЛПНП в процессе проникновения в артериальную стенку, и последующее влияние частиц ЛПНП на атерогенный процесс внутри стенки артерий[11].
Хотя ХС ЛПНП однозначно признается основной движущей силой в развитии связанных с атеросклерозом ССЗ и их основных клинических последствий[10, 12], появляются доказательства причинной роли других липопротеинов, содержащих апоB. Подробное рассмотрение различных механизмов, с помощью которых эти липопротеины, в том числе богатые триглицеридами (ТГ) липопротеины и их остатки, часто называемые липопротеинами промежуточной плотности и липопротеином (a), вносят вклад не только в основной патофизиологический механизм ССЗ, но и, потенциально, в атеротромботические события[13, 14].
Повышенный уровень ХС ЛПНП формирует риск ССЗ, который возрастает с увеличением концентрации ХС ЛПНП и продолжительности воздействия[15, 16]. Используя данные исследования CARDIA (Риск развития коронарной болезни у молодых взрослых), M.J. Domanski и соавт. оценили взаимосвязь площади под кривой ХС ЛПНП в зависимости от возраста с риском развития ССЗ и модуляцией риска по времени в зависимости от площади накопления — отличается ли увеличение риска для одного и того же прироста площади в разном возрасте[17].
В проспективное исследование CARDIA включены 4958 бессимптомных взрослых в возрасте от 18 до 30 лет, в 1985–1986 годах. Во время медианного 16-летнего наблюдения после 40 лет у 275 участников произошло одно из событий, составивших первичную конечную точку (комбинация нефатальной ИБС, инсульта, транзиторной ишемической атаки, госпитализации с сердечной недостаточностью, реваскуляризации сердца, вмешательства при заболеваниях периферических артерий или сердечно-сосудистой смерти).
После поправки на пол, расу и традиционные факторы риска площадь под кривой ХС ЛПНП по сравнению с кривой возраста и временно́й кривой, область накопления (наклон кривой ХС ЛПНП) были значительно связаны с риском развития сердечно-сосудистого события (отношение рисков — 1,053; р < 0,0001 на 100 мг/дл × лет; отношение рисков — 0,797 мг/дл/год; р = 0,045 соответственно).
Таким образом, показано, что риск развития ССЗ зависит от кумулятивного предшествующего воздействия ХС ЛПНП и, независимо, от временно́го хода накопления области. Та же самая область, накопленная в более молодом возрасте, привела к большему увеличению риска, чем накопленная в старшем возрасте, что особо подчеркивает важность оптимального контроля уровня ХС ЛПНП начиная с раннего возраста[17].
Другим ключевым признаком ХС ЛПНП как фактора риска ССЗ являются данные о том, что длительное снижение концентрации ХС ЛПНП связано с более низким риском ССЗ во всем изученном диапазоне, причем результаты рандомизированных контролируемых исследований свидетельствуют, что даже при таких низких уровнях ХС ЛПНП, как < 1,4 ммоль/л (< 55 мг/дл), продолжается безопасное уменьшение риска ССЗ[18].
Поскольку абсолютная выгода зависит от базового риска и абсолютного снижения уровня ХС ЛПНП, у больных с существенным риском он может быть смягчен путем более интенсивного уменьшения уровня ХС ЛПНП[19]. В рекомендациях отмечается:
- относительное снижение риска ССЗ пропорционально абсолютному размеру изменения уровня ХС ЛПНП, независимо от препарата или препаратов, используемых для достижения такого изменения[20];
- абсолютная польза от уменьшения содержания ХС ЛПНП зависит от абсолютного его снижения и от абсолютного риска ССЗ, поэтому даже небольшое абсолютное уменьшение концентрации ХС ЛПНП может быть полезным для пациентов с высоким или очень высоким риском[21];
- ХС липопротеинов невысокой плотности (ЛПнеВП) охватывает все атерогенные (содержащие апоВ) липопротеины и рассчитывается так: общий ХС – ХС ЛПВП = ХС ЛПнеВП.
Взаимосвязь между уровнем ХС ЛПнеВП и риском ССЗ по крайней мере так же сильна, как взаимосвязь с уровнем ХС ЛПНП. Определение содержания ХС ЛПнеВП дает, по сути, ту же информацию, что и оценка концентрации апоВ плазмы[22, 23]. Уровни ХС ЛПнеВП используются в качестве исходных данных в новых шкалах оценки системного коронарного риска SCORE2 и SCORE2-OP.
Содержание ХС ЛПВП обратно пропорционально риску ССЗ, но очень высокие уровни ХС ЛПВП могут сигнализировать о повышенном риске ССЗ. Однако до сих пор нет доказательств того, что рост уровня ХС ЛПВП в плазме снижает риск ССЗ[24, 25]. ХС ЛПВП, тем не менее, является полезным биомаркером для уточнения оценки риска с использованием шкалы SCORE2.
Шкала SCORE2 не может быть использована для пациентов с генетическим нарушением липидного обмена, таким как семейная гиперхолестеринемия. Конкретные пороговые значения и целевые показатели ХС ЛПНП рекомендуются независимо от предполагаемого риска ССЗ у пациентов с семейной гиперхолестеринемией или другими редкими/генетическими нарушениями липидного обмена.
СТРАТЕГИИ БОРЬБЫ С ДИСЛИПИДЕМИЯМИ
Наличие дислипидемии, вторичной по отношению к другим состояниям, должно быть исключено до начала лечения, так как терапия основного заболевания может устранить или уменьшить выраженность гиперлипидемии без назначения липид-снижающих препаратов[3, 18]. Это особенно важно в случае гипотиреоза. Вторичные дислипидемии также могут быть вызваны злоупотреблением алкоголем, СД, синдромом Кушинга, заболеваниями печени и почек, лекарственными препаратами (например, кортикостероидами). Следует отметить, что оптимизация образа жизни имеет решающее значение для всех пациентов с уровнем липидов выше оптимального.
Стратегии контроля уровня холестерина липопротеинов низкой плотности
Диетические факторы влияют на развитие ССЗ либо напрямую, либо через воздействие на традиционные факторы риска, такие как высокие уровни липидов плазмы, АД или глюкозы. Данные эпидемиологических исследований показывают, что большее потребление фруктов, не содержащих крахмал овощей, орехов, бобовых, рыбы, растительных масел, йогурта и цельнозерновых продуктов наряду с меньшим потреблением красного и обработанного мяса, продуктов с высоким содержанием рафинированных углеводов и соли связано с более низкой частотой ССЗ[26]. Кроме того, замена животных жиров, включая молочный жир, растительными источниками жиров и полиненасыщенными жирными кислотами может снизить риск развития ССЗ[27]. Такие рекомендации следует дать всем людям независимо от степени сердечно-сосудистого риска.
Препараты для лечения дислипидемий
В настоящее время доступные гиполипидемические препараты включают ингибиторы 3-гидрокси-3-метилглутарил-кофермента А редуктазы (статины), фибраты, секвестранты желчных кислот (не зарегистрированы в Российской Федерации), селективные ингибиторы абсорбции ХС (эзетимиб) и ингибиторы субтилизина/кексина пропротеиновой конвертазы 9-го типа (PCSK9) (подкожное введение алирокумаба или эволокумаба 1 раз в 2–4 недели)[3, 18, 28].
Бемпедоевая кислота, ингибитор синтеза ХС для приема внутрь, недавно была одобрена в нескольких странах (в Российской Федерации не зарегистрирована). Препарат в основном предназначен для приема в комбинации с эзетимибом у пациентов с непереносимостью статинов. Результаты исследований по оценке эффективности влияния бемпедоевой кислоты на риск ССЗ ожидаются в конце 2022 года[3].
Инклизиран, новая малая интерферирующая РНК, способствует снижению уровня ХС ЛПНП на 50–55% при подкожном применении 2 раза в год либо на фоне статинов, либо без других гиполипидемических средств лечения при хорошей переносимости. Этот препарат одобрен в нескольких европейских странах (в Российской Федерации не зарегистрирован). Данные по влиянию инклизирана на сердечно-сосудистые исходы ожидаются в 2023 году[3].
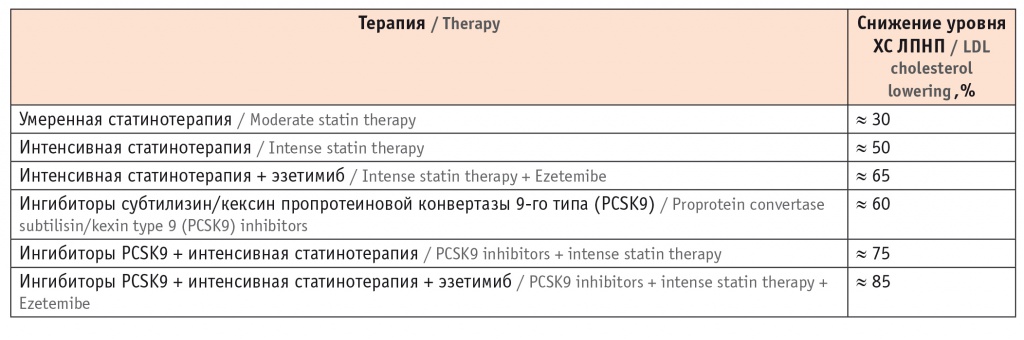
Следует напомнить, что ожидаемое снижение уровня ХС ЛПНП в ответ на монотерапию, как правило, с помощью статинов или их комбинации с другими липид-снижающими препаратами, показанное в таблице, может сильно различаться у разных людей[18]. Поэтому рекомендуется контролировать влияние терапии на содержание ХС ЛПНП с его оценкой через 4–6 недель после начала или изменения любой стратегии лечения.
Таблица
Ожидаемое снижение уровня холестерина липопротеинов низкой плотности (ХС ЛПНП) при моно- и комбинированной терапии[18]
Статины как препараты первого выбора в лечении гиперхолестеринемии
Контролировать уровень ХС стало возможно с появлением статинов, которые и в настоящее время являются основным классом липид-снижающих препаратов[3, 18]. Они уменьшают синтез ХС в печени за счет конкурентного ингибирования фермента ГМГ-КоА-редуктазы, ограничивающего скорость биосинтеза ХС. Наблюдаемое в этой ситуации снижение содержания внутриклеточного ХС способствует увеличению экспрессии рецепторов ЛПНП на поверхности гепатоцитов, что сопровождается усилением поглощения ХС ЛПНП из крови и снижением его концентрации в плазме, а также других липопротеинов, содержащих апоВ, включая частицы, богатые ТГ.
Несмотря на принадлежность по механизму действия к одному классу, статины отличаются по липофильности и некоторым другим характеристикам, среди которых в практическом отношении наибольшее значение имеет липид-снижающая активность. По выраженности холестерин-снижающего действия статины подразделяются на препараты для интенсивной (розувастатин, аторвастатин), средней интенсивности (питавастатин, симвастатин, правастатин) и умеренной интенсивности (флувастатин, ловастатин) терапии.
В связи с тем, что в последние годы взят курс на интенсификацию липид-снижающей терапии, препараты с более высокой эффективностью занимают приоритетные позиции, причем не только в лечении пациентов с высоким и очень высоким сердечно-сосудистым риском, но и у лиц с менее высоким риском, в том числе в рамках первичной профилактики[18].
Статины не только существенно снижают концентрацию ХС ЛНПН, но обычно и уменьшают уровень ТГ на 10–20% от исходных значений[29]. Более мощные статины (розувастатин, аторвастатин и питавастатин) способствуют устойчивому снижению уровня ТГ, особенно в высоких дозах, у пациентов с их повышенным содержанием, у которых абсолютный риск и, следовательно, абсолютное снижение риска больше.
Механизм уменьшения концентрации ТГ до конца не выяснен, но, по-видимому, он частично независим от пути, реализуемого через рецепторы ЛПНП. Он может включать в себя регуляцию поглощения ХС липопротеинов очень низкой плотности (ЛПОНП) гепатоцитами, а также снижение скорости биосинтеза ЛПОНП; эти эффекты, вероятно, зависят от концентрации ЛПОНП до начала лечения[30].
По данным метаанализа, в зависимости от дозы соответствующих статинов повышение уровня ХС ЛПВП варьировало от 1% до 10%[31]. Однако с учетом выраженного опосредованного статинами уменьшения уровней атерогенных липопротеинов, содержащих апоB, относительно небольшое влияние на уровень ХС ЛПВП может способствовать общему наблюдаемому снижению риска ССЗ в исследованиях со статинами, но степень этого влияния не может быть достоверно определена.
Представляет интерес воздействие статинов на еще один атерогенный липопротеин — липопротеин (а). Статины лишь незначительно влияют на его уровень в плазме крови, причем есть данные как об отсутствии действия на концентрацию липопротеина (а), так и об увеличении его уровня после лечения статинами[32, 33]. Механизмы, с помощью которых статины повышают содержание окисленных фосфолипидов в липопротеине (а), требуют дальнейшего изучения.
Помимо основного липид-снижающего действия статинов, выделяют и другие, плейотропные, эффекты[34, 35], среди которых потенциально важными для профилактики ССЗ могут быть противовоспалительные и антиоксидантные. Хотя эти эффекты продемонстрированы in vitro и в экспериментальных исследованиях, их клиническая значимость остается недоказанной[36, 37].
В качестве примера противовоспалительного действия розувастатина можно представить результаты крупнейшего исследования JUPITER[38]. В него включались лица с факторами риска, но без ССЗ, с уровнем ХС ЛПНП < 3,4 ммоль/л и концентрацией СРБ > 2,0 мг/л. Всего включены 17 802 пациента, рандомизированных для приема розувастатина в дозе 20 мг и плацебо.
Исследование завершилось досрочно со снижением риска событий первичной конечной точки (ИМ, инсульта, реваскуляризации миокарда, госпитализации по поводу нестабильной стенокардии или сердечно-сосудистой смерти) на 44% (отношение рисков — 0,56; 95%-ный ДИ: 0,46–0,69; p < 0,00001), включая уменьшение риска смерти от всех причин на 20% (отношение рисков — 0,80; 95%-ный ДИ: 0,67–0,97; р = 0,02)[38]. Благоприятные эффекты наблюдались во всех оцениваемых подгруппах.
В группе розувастатина не было значительного увеличения частоты миопатии или онкозаболеваний, но наблюдалась более высокая частота СД, о чем сообщил врач.
В этом исследовании у практически здоровых людей без гиперлипидемии, но с повышенным уровнем высокочувствительного СРБ розувастатин значительно снизил частоту основных сердечно-сосудистых событий. Таким образом, убедительно продемонстрирован не только выраженный липид-снижающий эффект (уменьшение уровня ХС ЛПНП на 50%), но и противовоспалительное действие розувастатина (снижение уровня СРБ на 37%), что указывает на участие воспаления в развитии атеросклероза и его тромботических осложнений.
Розувастатин в дозе 10 мг был изучен в другом крупномасштабном исследовании НОРЕ-3, в которое включены более 12,5 тыс. пациентов с умеренным риском сердечно-сосудистых осложнений (АГ — у 37%, нарушение толерантности к глюкозе или нарушенная гликемия натощак — у 12,7%, СД — у 6%, курение — у 27%, низкий уровень ХС ЛПВП — у 36%, отягощенный семейный анамнез по ИБС — у 26%)[39]. Средний уровень общего ХС составил 5,2 ммоль/л, ХС ЛПНП — 3,3 ммоль/л, медиана высокочувствительного СРБ — 2,0 мг/л.
В липид-снижающей части этого исследования в группе получавших розувастатин риск событий первичной конечной точки (ИМ, инсульта или сердечно-сосудистой смерти) был ниже на 24%, число госпитализаций по поводу ССЗ — на 25%, уровень высокочувствительного СРБ — на 0,19 мг/л. В этом исследовании впервые продемонстрирована эффективность статинов (розувастатина 10 мг) у пациентов с умеренным сердечно-сосудистым риском, рассчитанным на основании клинических шкал[39].
В 2021 году опубликованы результаты отдаленного наблюдения за участниками исследования НОРЕ-3 после его завершения[40]. Интерес к продолжению наблюдения за участниками клинических исследований связан с тем, что результаты, полученные в период активного лечения, могут не отражать его долгосрочные эффекты[41]. В частности, статины могут вызвать структурные изменения в сосудистой стенке, такие как изменения морфологии и состава атером, которые способны привести к пролонгации или усилению преимуществ во время дальнейшего наблюдения[42–44].
Исследователи предположили, что даже после прекращения активного лечения в рамках исследования преимущества статинов будут сохраняться или усиливаться в течение нескольких лет. Отслеживание долгосрочных последствий профилактических стратегий имеет большое значение как для здравоохранения в целом, так и для конкретных пациентов.
После рандомизированного периода лечения (5,6 года) участникам было предложено продолжение наблюдения в течение 3,1 года (в общей сложности 8,7 года)[40]. Первой конечной точкой на протяжении всего периода наблюдения была комбинация ИМ, инсульта или смерти от сердечно-сосудистых заболеваний (MACE-1), а в дополнительную первичную конечную точку вошли события MACE-1 плюс остановка сердца с последующей реанимацией, сердечная недостаточность или коронарная реваскуляризация (MACE-2).
В общей сложности 9326 (77,7%) из 11 994 участников HOPE-3 согласились находиться под более длительным наблюдением. В течение дополнительного наблюдения у больных, первоначально рандомизированных для получения розувастатина 10 мг (для сравнения с плацебо), дополнительно снижался риск событий первичной конечной точки MACE-1 на 20% (95%-ный ДИ: 0,64–0,99) и MACE-2 на 17% (95%-ный ДИ: 0,68–1,01).
В целом за 8,7 года наблюдения риск MACE-1 уменьшился на 21% (95%-ный ДИ: 0,69–0,90, р = 0,005), MACE-2 — тоже на 21% (95%-ный ДИ: 0,69–0,89, р = 0,002) (рис. 3).
Рис. 3. Кумулятивная частота основных сердечно-сосудистых событияй (MACE-1) в группах розувастатина 10 мг и плацебо за весь период наблюдения (8,7 года)[40]. Розувастатин 10 мг обеспечивает дополнительные преимущества даже после прекращения лечения
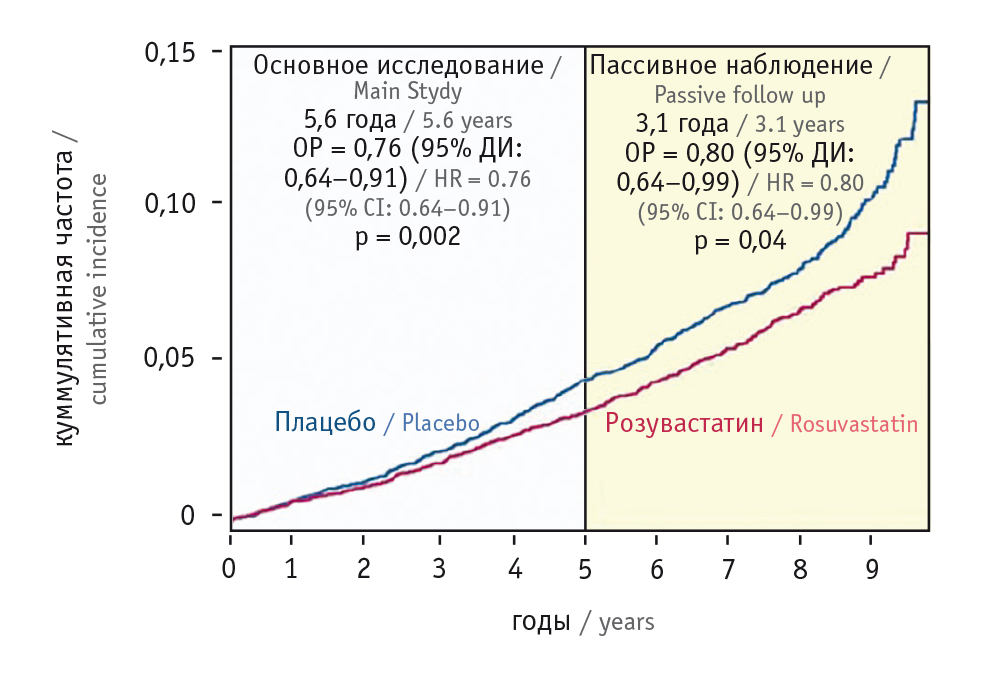
Был сделан вывод о том, что преимущества при лечении розувастатином по сравнению с плацебо в снижении риска сердечно-сосудистых событий продолжают нарастать в течение как минимум 3 лет после прекращения рандомизированного лечения у лиц исходно без ССЗ, что указывает на унаследованный эффект[40].
Эти результаты согласуются с ранее установленным влиянием снижения уровня ХС ЛПНП с помощью статинов на структуру артериальной стенки, морфологию и состав атеросклеротических бляшек, что может объяснить длительный эффект даже после прекращения терапии[45, 46]. Статины могут уменьшить размер липидного ядра, приводящего к стабилизации бляшек, и даже индуцировать их регрессию. Сообщалось также, что статины улучшают ремоделирование сосудов[47]. Влияние их на замедление прогрессирования, стабилизацию и регрессию атером зависит от выраженности снижения уровня ХС ЛПНП и продолжительности вмешательства.
Для оценки состояния сосудистой стенки крупных артерий используются ультразвуковые методы исследования, в первую очередь УЗИ сонных артерий. Другой метод — внутрисосудистое УЗИ коронарных артерий[26], оно позволяет оценивать не только просвет сосуда, но и размер и состав бляшки, локализующейся внутри сосудистой стенки. Метод считается наиболее чувствительным для оценки коронарного атеросклероза.
В исследование METEOR включены лица среднего возраста с низким риском развития коронарной болезни сердца (10-летний риск < 10% по Фрамингемской шкале) и ультразвуковыми признаками субклинического атеросклероза. В группе получавших розувастатин 40 мг/сут в течение 2 лет отмечено снижение уровня ХС ЛПНП на 48% (в среднем с 4,01 до 2,02 ммоль/л) и значимое уменьшение толщины комплекса интима-медиа в сонных артериях в сравнении с показателями группы плацебо[48].
Важность полученных в исследовании METEOR результатов становится более очевидной после изучения данных исследования PESA (Прогрессирование раннего субклинического атеросклероза), в котором использовались методы неинвазивной визуализации[49]. Показано, что 71% мужчин и 43% женщин среднего возраста имеют признаки субклинического атеросклероза. Это подтверждает ранее полученные данные о том, что связанные с атеросклерозом ССЗ начинаются рано, еще в детстве[50].
В клиническом исследовании ASTEROID в течение 2 лет 507 больных стабильной ИБС получали розувастатин 40 мг/сут либо плацебо[51]. В группе активной терапии средний уровень ХС ЛПНП снизился с 3,39 до 1,58 ммоль/л (на 54,3%), что сопровождалось уменьшением средней величины стеноза с 35,7% до 34,5% диаметра сосуда, по данным количественной коронароангиографии, и объема атеромы на 14,7%, по данным внутрисосудистого УЗИ[51]. Таким образом, назначение розувастатина привело к значительному снижению уровня ХС ЛПНП, скорости прогрессирования и даже регрессу атером.
Следует отметить, что клинические преимущества статинов в уменьшении риска сердечно-сосудистых событий становятся очевидными по меньшей мере через 6–12 месяцев[51, 52]. Результаты пролонгированного наблюдения за участниками исследования НОРЕ-3, ранее получавшими лечение в течение 5,6 года, демонстрирующие дальнейшие клинические преимущества розувастатина (улучшение сердечно-сосудистого прогноза) в течение 3,1 года пассивного наблюдения, предполагают, что они, возможно, обусловлены стабилизацией бляшек, регрессией и ремоделированием сосудов и могут продолжаться в течение нескольких лет после прекращения терапии статинами[40]. Однако из этого не следует, что прием статинов нужно прекратить после 5 или 6 лет лечения, полученные данные лишь указывают на то, что клинические преимущества наблюдаются даже после прекращения терапии статинами.
Определение целей по холестерину липопротеинов низкой плотности
В новых рекомендациях достижение целевого уровня ХС ЛПНП (см. далее) предлагается осуществлять с помощью липид-снижающих препаратов поэтапно, и необходимо совместное принятие решений врачами и пациентом[3]. Это новый поэтапный подход к целям лечения, в том числе к содержанию ХС ЛПНП, фактически отражающий клиническую практику, когда интенсификация лечения рассматривается на основе ожидаемой пользы, побочных эффектов и, что важно, предпочтений пациента.
Выделяются три поэтапных алгоритма: у практически здоровых людей, пациентов с установленным диагнозом связанного с атеросклерозом ССЗ и лиц, имеющих специфические факторы риска ССЗ (СД, хроническую болезнь почек и гиперхолестеринемию). Один из этих алгоритмов — для пациентов с ССЗ — представлен на рисунке 4. Должны достигаться конечные цели лечения: систолическое АД < 130 мм рт. ст. и уровень ХС ЛПНП в зависимости от степени риска, в соответствии с соответствующими клиническими рекомендациями ESC[3]. Поэтапный подход должен применяться в целом: после шага 1 рассмотрение вопроса о переходе к более интенсивным целям шага 2 является обязательным. Оценки риска доступны в приложении ESC «Калькулятор риска ССЗ для мобильных устройств» (https://www.escardio.org/Education/ESC-Preventionof-CVD) и на таких веб-сайтах, как https://www.u-prevent.com. Польза от лечения выражается в дополнительной продолжительности жизни без ССЗ, полученной в результате определенного вмешательства или интенсификации лечения.
Рис. 4. Схема коррекции сердечно-сосудистого риска и факторов риска у пациентов с установленным атеросклеротическим сердечно-сосудистым заболеванием[3].
Примечание: АССЗ — атеросклеротическое сердечно-сосудистое заболевание, САД — систолическое артериальное давление, ССЗ — сердечно-сосудистое заболевание, ХС ЛПНП — холестерин липопротеинов низкой плотности
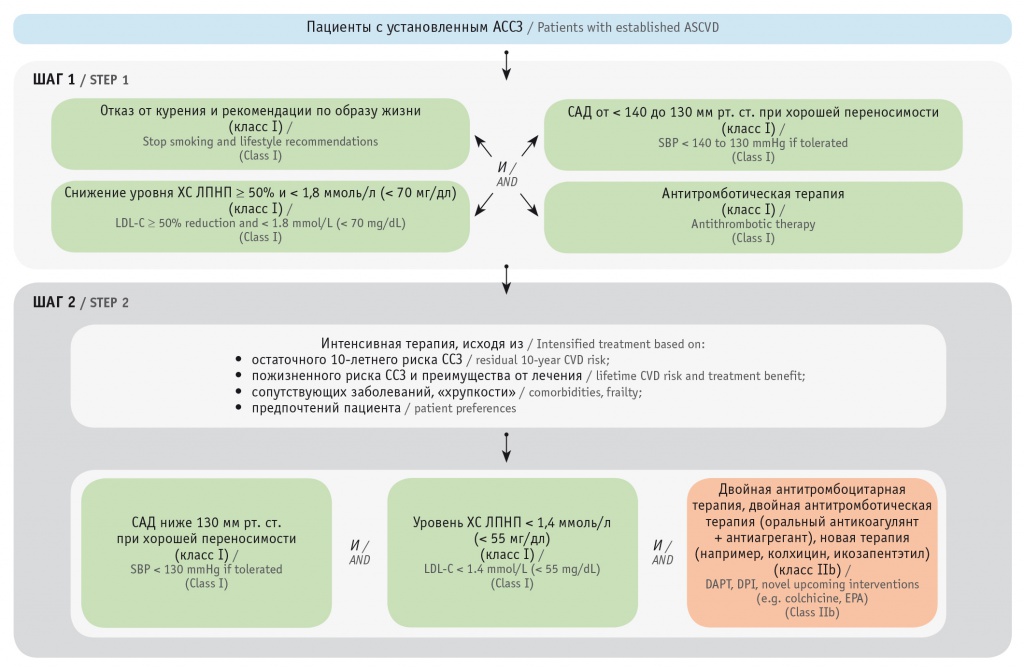
Что касается целевых уровней ХС ЛПНП, то они такие же, как и в рекомендациях ESC/European Atherosclerosis Society (EAS) по дислипидемии 2019 года[18]. В конкретных случаях (при очень высоком риске) врач может выбрать объединение обоих этапов и перейти непосредственно к более низкому целевому уровню ХС ЛПНП, достижение которого рекомендуется на этапе 2.
У практически здоровых людей пожизненная польза от лечения, связанная со снижением содержания ХС ЛПНП, может играть роль в совместном принятии решений наряду с модификаторами риска, сопутствующими заболеваниями, предпочтениями пациентов и «хрупкостью». На рисунке 5 показаны предполагаемые пожизненные выгоды (годы жизни без ССЗ) по отношению к общему профилю риска ССЗ в странах с низким и умеренным риском ССЗ[3]. Эта информация может помочь в обсуждении и принятии решения пациентом.
Рис. 5. Увеличение в среднем количества лет жизни без сердечно-сосудистых заболеваний (ССЗ) при снижении уровня холестерина липопротеинов низкой плотности (ХС ЛПНП) на 1 ммоль/л (40 мг/дл) у практически здоровых людей[3]. Для индивидуальных оценок пожизненного пособия можно использовать эту таблицу или электронную версию LIFE-CVD (приложение ESC CVD risk или https://u-prevent.com/)
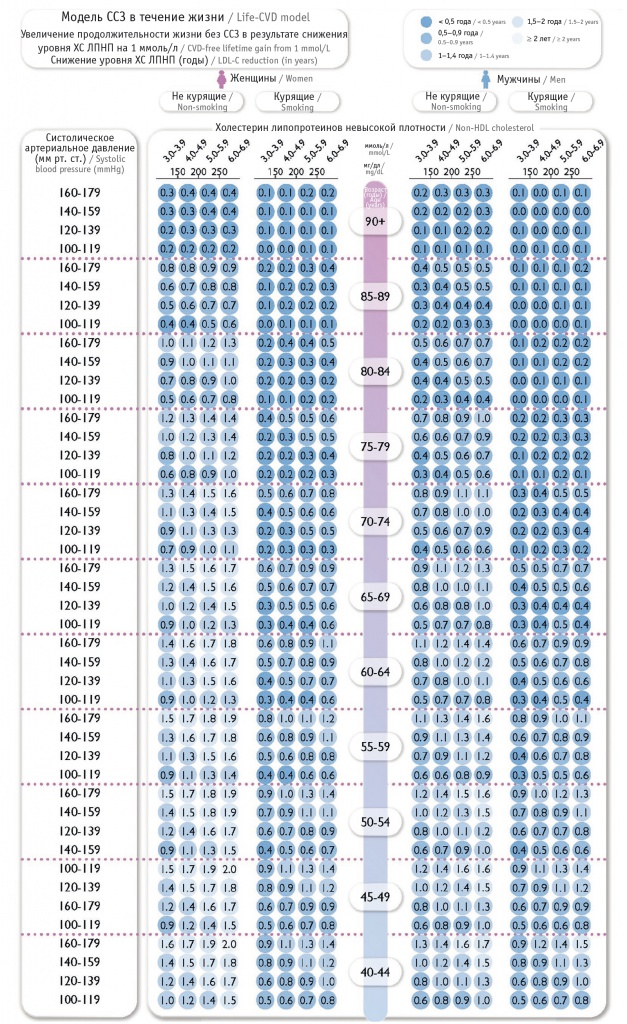
В настоящее время эта шкала апробирована для стран с низким и средним уровнем риска (для стран с высоким и очень высоким сердечно-сосудистым риском, к которым относится Российская Федерация, шкала не валидизирована). Пожизненное преимущество снижения уровня ХС ЛПНП на 1 ммоль/л для практически здоровых людей основано на следующих факторах риска: возраст, пол, курение, систолическое АД и содержание ХС ЛПнеВП. Пожизненная выгода выражается как годы средней ожидаемой продолжительности жизни без ИМ или инсульта, полученные в результате снижения уровня ХС ЛПНП на 1 ммоль/л. При снижении концентрации ХС ЛПНП на 2 ммоль/л увеличение средней ожидаемой продолжительности здоровой жизни почти вдвое больше и так далее. Пожизненная выгода рассчитывается путем оценки риска ССЗ в течение жизни с помощью модели LIFE-CVD, умноженной на коэффициент (0,78) из метаанализа по оценке эффекта снижения уровня липидов[21].
После этапа 1 у всех пациентов необходимо рассмотреть возможность интенсификации лечения на этапе 2. Цель лечения — концентрация ХС ЛПНП < 1,4 ммоль/л (< 55 мг/дл) на этапе 2 у пациентов с установленным ССЗ или без него, но с очень высоким риском. Такой низкий уровень определен на основании данных недавних рандомизированных исследований Менделя[53], метаанализа the Cholesterol Treatment Trialists’ Collaboration[54], рандомизированных клинических исследований (IMPROVE-IT[55]) и совсем недавних клинических результатов применения ингибиторов PCSK9[56, 57]. Класс I и уровень доказательств А, подтверждающие целевой уровень ХС ЛПНП < 1,4 ммоль/л (< 55 мг/дл) для пациентов с ССЗ, идентичны таковым в предыдущих рекомендациях ESC/EAS по дислипидемии[18].
Однако для первичной профилактики у пациентов с очень высоким риском класс рекомендаций ниже (класс I в рекомендациях ESC/EAS по дислипидемии 2016 года, класс IIA в текущих рекомендациях), так как эксперты не проявили единодушия в отношении этой цели (более низкого уровня ХС ЛПНП) в рамках первичной профилактики[3, 58].
Для пациентов с ССЗ, у которых в течение 2 лет происходит второе сосудистое событие (не обязательно того же типа, что и первое) на фоне максимально переносимой терапии на основе статинов, может быть рассмотрен более низкий целевой уровень ХС ЛПНП < 1,0 ммоль/л (< 40 мг/дл). Важно отметить, что нет различий в снижении ОР между мужчинами и женщинами, а также между молодыми и пожилыми пациентами (по крайней мере в возрасте до 75 лет) или между пациентами с СД и без него[3].
ЗАКЛЮЧЕНИЕ
Выявление пациентов, которые получат наибольшую пользу от коррекции факторов риска сердечно-сосудистых заболеваний (ССЗ), имеет первостепенное значение для эффективности профилактических мероприятий. Предотвращение сердечно-сосудистых событий (осложнений) путем снижения риска ССЗ является главной темой недавно представленных рекомендаций Европейского кардиологического общества по предупреждению ССЗ в реальной клинической практике. Обновленный алгоритм SCORE–SCORE2, используемый в новых рекомендациях, оценивает 10-летний риск фатальных и нефатальных сердечно-сосудистых событий (инфаркта миокарда, инсульта) у практически здоровых людей в возрасте 40–69 лет с факторами риска, а по шкале SCORE2-OP оценивается 5-летний и 10-летний риск фатальных и нефатальных сердечно-сосудистых событий у практически здоровых людей в возрасте > 70 лет. Представлена впервые схема 2-этапного достижения целевых показателей.
Выявление и коррекция гиперхолестеринемии имеют огромное значение в профилактике ССЗ даже у здоровых людей, но особенно у больных с атеросклерозом и ССЗ на его основе. В коррекции дислипидемии главная роль по-прежнему отводится статинам, причем с учетом необходимости достижения более низких целевых уровней холестерина ЛПНП предпочтительно использование препаратов с высокоинтенсивным действием, например розувастатина.
Поступила: 12.11.2021
Принята к публикации: 25.11.2021








