В последние годы отмечается рост частоты развития ТЭЛА, что связано с распространенностью тромботического поражения вен вследствие общего старения населения, с увеличением встречаемости онкологических заболеваний, все более частым возникновением наследственных и приобретенных нарушений системы гемостаза, неконтролируемым приемом гормональных средств и ростом травматизма. Несмотря на значительные успехи современной медицины, диагностика и лечение ТЭЛА остаются одними из самых трудных проблем[1]. Это обусловлено вариабельностью клинической симптоматики заболевания, что затрудняет его своевременную диагностику и лечение, и высокой летальностью, которая составляет 7–50%. По данным Фрамингемского исследования, на долю ТЭЛА приходится 15,6% всей внутригоспитальной летальности, причем у подавляющего большинства пациентов причинами смерти являются заболевания терапевтического профиля[4]. При этом специфические методы диагностики, такие как ангиопульмонография, сцинтиграфия, перфузионно-вентиляционные исследования с изотопами, мультиспиральная компьютерная томография (МСКТ) и МРТ, доступны далеко не во всех медицинских учреждениях, что является одним из препятствий для своевременной диагностики ТЭЛА[16].
Сведения о частоте ТЭЛА у различных авторов весьма разноречивы[7, 12]. По результатам российской части международного регистра ENDORSE факторы риска венозных тромбозов и ТЭЛА выявлены у 52% хирургических и 40% терапевтических больных, госпитализированных в стационары соответствующего профиля, а при аутопсии частота верифицированной ТЭЛА составила более 14%[4].
По данным того же регистра, мишенью для ТЭЛА в последнее время являются не только женщины детородного возраста, принимающие оральные контрацептивы и имеющие такой фактор риска, как курение, но и пациентки в постменопаузе. Приведенные факты определяют необходимость анализа существующих в реальной клинической практике подходов к ведению пациентов с ТЭЛА с учетом обновленных рекомендаций по диагностике и лечению Европейского общества кардиологов (European Society of Cardiology — ESC)[19].
Цель настоящего исследования — оценка гендерных различий частоты выявления ТЭЛА, факторов риска ее развития и неблагоприятного госпитального исхода.
МАТЕРИАЛЫ И МЕТОДЫ
За период с января 2013 г. по февраль 2014 г. в Кемеровский кардиологический диспансер были госпитализированы 55 пациентов с диагнозом ТЭЛА, что составило 1,03% от 5332 больных с патологией системы кровообращения, поступивших в учреждение в этот период. Из них 28 (50,9%) больным диагноз ТЭЛА был установлен на этапе приезда скорой медицинской помощи, 23 (41,8%) — в стационаре. Трем (5,5%) пациентам, обратившимся за медицинской помощью самостоятельно, диагноз ТЭЛА установили в приемном покое, одному (1,8%) — в стационаре через 3 суток после поступления в неврологическое отделение с ишемическим инсультом. В отделения неотложной кардиологии были госпитализированы 94,5% больных, двум (3,6%) проводилось лечение в инфарктном отделении с предварительным диагнозом инфаркта миокарда, который впоследствии был исключен.
Всем пациентам проведено стандартное лабораторное обследование, в том числе измерение уровней D-димера и тропонина Т в периферической крови, а также сделаны ЭхоКГ, ЭКГ, рентгенография органов грудной клетки, МСКТ легких, цветное дуплексное сканирование вен нижних конечностей. Определялся оригинальный и упрощенный прогностический индекс 30-дневной летальности от ТЭЛА — Pulmonary Embolism Severity Index (PESI)[19].
Статистическая обработка полученных результатов осуществлялась с помощью программы Statistica 8.0. Для исследования зависимостей между переменными использовали коэффициент ранговой корреляции Спирмена. Две независимые группы по количественному признаку сравнивали с помощью U-критерия Манна — Уитни. Анализ различия частот в двух независимых группах проводили при помощи критерия χ2 Пирсона и точного критерия Фишера. Различия считали статистически значимыми при р ˂ 0,05.
РЕЗУЛЬТАТЫ
Частота выявления ТЭЛА составила 1,03% от всего количества пациентов с патологией системы кровообращения, поступивших в учреждение в течение одного года. Около 50% больных были госпитализированы в первые 24 часа от момента появления симптоматики, при этом у 13 (23,6%) пациентов ТЭЛА развилась первично, а у 12 (21,9%) был ее рецидив.
Давность возникновения ТЭЛА от 24 до 48 часов наблюдалась у 5 (9,1%) больных, от 2 до 14 суток — у 13 (23,6%), а более 14 суток — у 10 (18,2%); еще у 2 (3,6%) человек давность развития симптоматики установить не удалось.
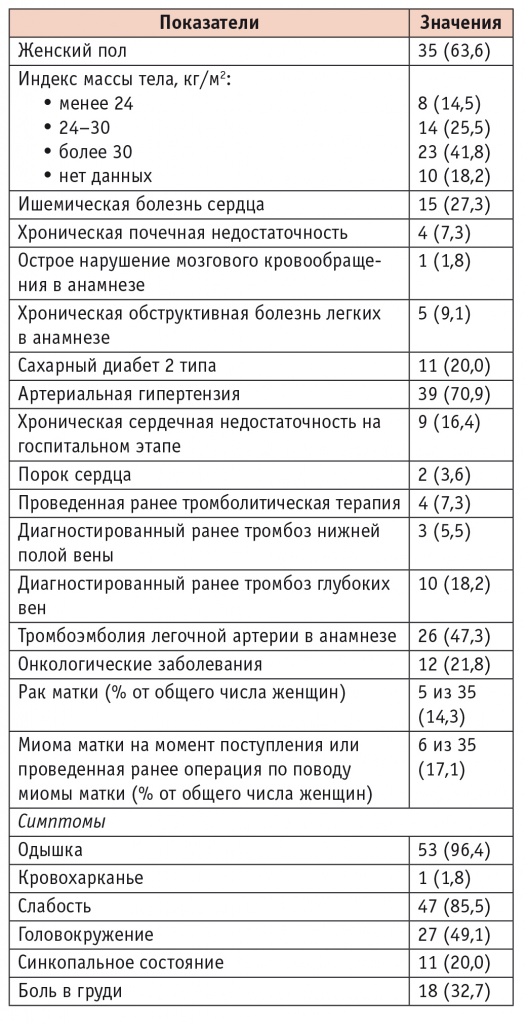
В таблице 1 представлена исходная клиническая характеристика больных ТЭЛА. Средний возраст пациентов составил 64,32 ± 15,14 года (от 23 до 85 лет), при этом женщины были старше мужчин. В исследуемой выборке преобладали лица женского пола — 35 (63,6%). Обращает на себя внимание превалирование лиц с ожирением, у которых ИМТ составил 30 кг/м2 и более, с наличием АГ, сахарного диабета (СД) 2 типа и ИБС. Такие классические факторы риска, как онкологические заболевания и тромбоз глубоких вен (ТГВ) нижних конечностей, имели место в 21,8% и 18,2% случаев соответственно. Значительно реже в качестве фактора риска выступал диагностированный ранее тромбоз нижней полой вены — в 3 (5,5%) случаях. У 2 (3,6%) пациентов в анамнезе была хирургическая коррекция порока митрального клапана механическим протезом. Наиболее часто у больных ТЭЛА наблюдались такие симптомы, как одышка (n = 53; 96,4%) и слабость (n = 47; 85,5%). Кровохарканье отмечалось лишь у одного пациента.
Таблица 1
Исходная клиническая характеристика больных тромбоэмболией легочной артерии (n = 55), n (%)
Тактика ведения больных ТЭЛА была различной. Так, тромболитическую терапию (ТЛТ) получали 29 (52,7%), консервативную — 23 (41,8%) пациента. Для ТЛТ использовались стрептокиназа (21 случай), альтеплаза (7 случаев) и в одном случае тенектеплаза. В качестве антикоагулянтного лечения в отделении интенсивной терапии проводилась непрерывная инфузия нефракционированного гепарина, в отделении кардиологии применялся низкомолекулярный гепарин в сочетании с насыщающей дозой антагониста витамина К (АВК) варфарина до достижения целевого значения МНО.
Трем пациентам произведено оперативное вмешательство в виде тромбэктомии из ствола легочной артерии (ЛА) в сроки от 2 до 12 дней от начала развития симптомов.
Среди пациентов смертельный исход наступил у 12 (21,9%) больных, из них 8 (66,7%) получали ТЛТ, а 4 (33,3%) — только консервативную антикоагулянтную терапию (табл. 2). Из 12 умерших пациентов у 6 ТЭЛА развилась первично. Всем им диагноз был установлен в течение первых суток. Больные, подвергшиеся оперативному лечению в виде тромбэктомии из ствола ЛА, имели благоприятный госпитальный исход. В числе тех, кто получал ТЛТ, смертельный исход статистически значимо чаще наступал при поражении ствола ЛА (по результатам МСКТ): среди умерших поражение ствола ЛА имело место в 3 (37,5%) случаях из 8.
Таблица 2
Факторы риска тромбоэмболии легочной артерии у больных с различными исходами (n = 55)
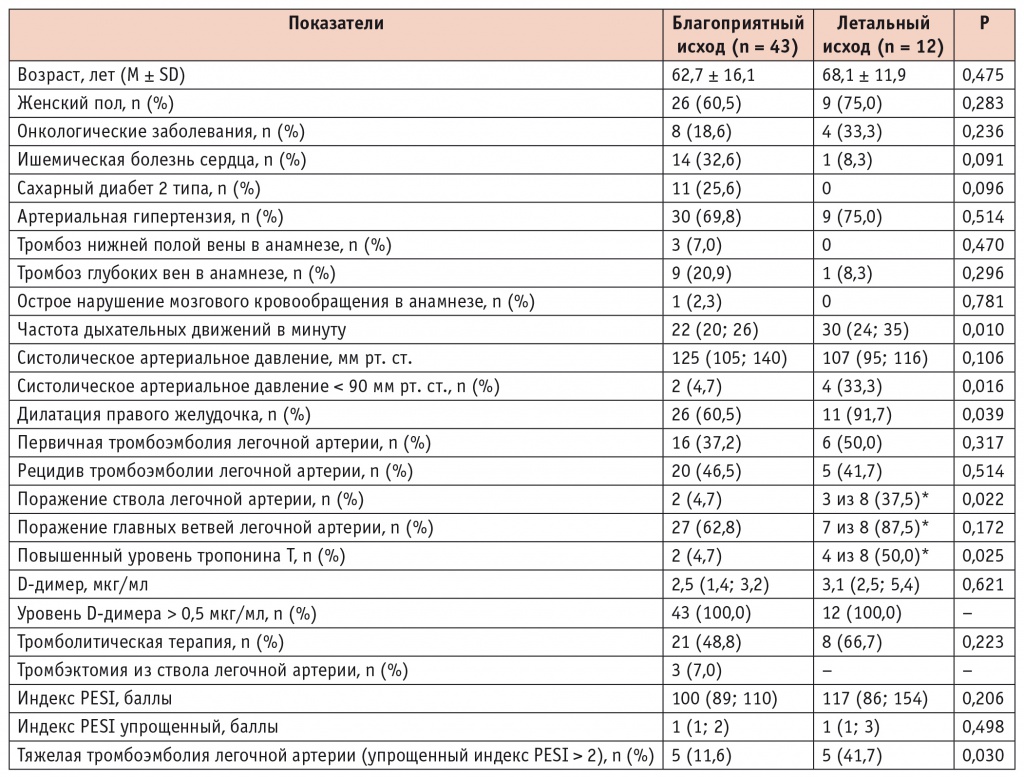
Высокая летальность в первые сутки у пациентов, подвергшихся ТЛТ, была обусловлена их крайне тяжелым состоянием: 6 (75,0%) из 8 человек были госпитализированы в состоянии кардиогенного шока с рецидивирующим течением и признаками массивной ТЭЛА. Установлено, что в группе больных с летальным исходом статистически значимо чаще наблюдались следующие неблагоприятные прогностические факторы (см. табл. 2): низкий исходный уровень САД (< 90 мм рт. ст.), дилатация правого желудочка (ПЖ), поражение ствола ЛА по результатам МСКТ, повышенный уровень кардиоспецифического белка тропонина Т, высокая ЧДД, а также высокий (более 2) балл по упрощенной шкале PESI.
В отношении остальных клинико-анамнестических факторов риска существенных различий в группах пациентов с разными исходами не выявлено. ИБС установлена в 32,6% случаев у выживших пациентов, в то время как в группе больных с летальным исходом — у одного (8,3%). Следует отметить, что уровень D-димера в крови был повышен у всех пациентов с ТЭЛА независимо от течения и исходов заболевания.
По сравнению с мужчинами женщины имели более высокий ИМТ (p = 0,09) и более низкую сатурацию кислородом (p = 0,07) (табл. 3). В анамнезе у них чаще встречались СД 2 типа, ИБС, онкологические заболевания, АГ, ХСН (во всех случаях p > 0,05). У женщин было статистически значимо более выраженное тахипноэ (p = 0,033), в 2,6 раза чаще отмечалось синкопе, в то же время одышка была характерна для всех пациентов. Позитивный тропонин Т имел место только у женщин (в 14,3% случаев). Для женщин также были характерны более высокие уровни D-димера (p = 0,072).
Таблица 3
Факторы риска и исходы тромбоэмболии легочной артерии у мужчин и женщин
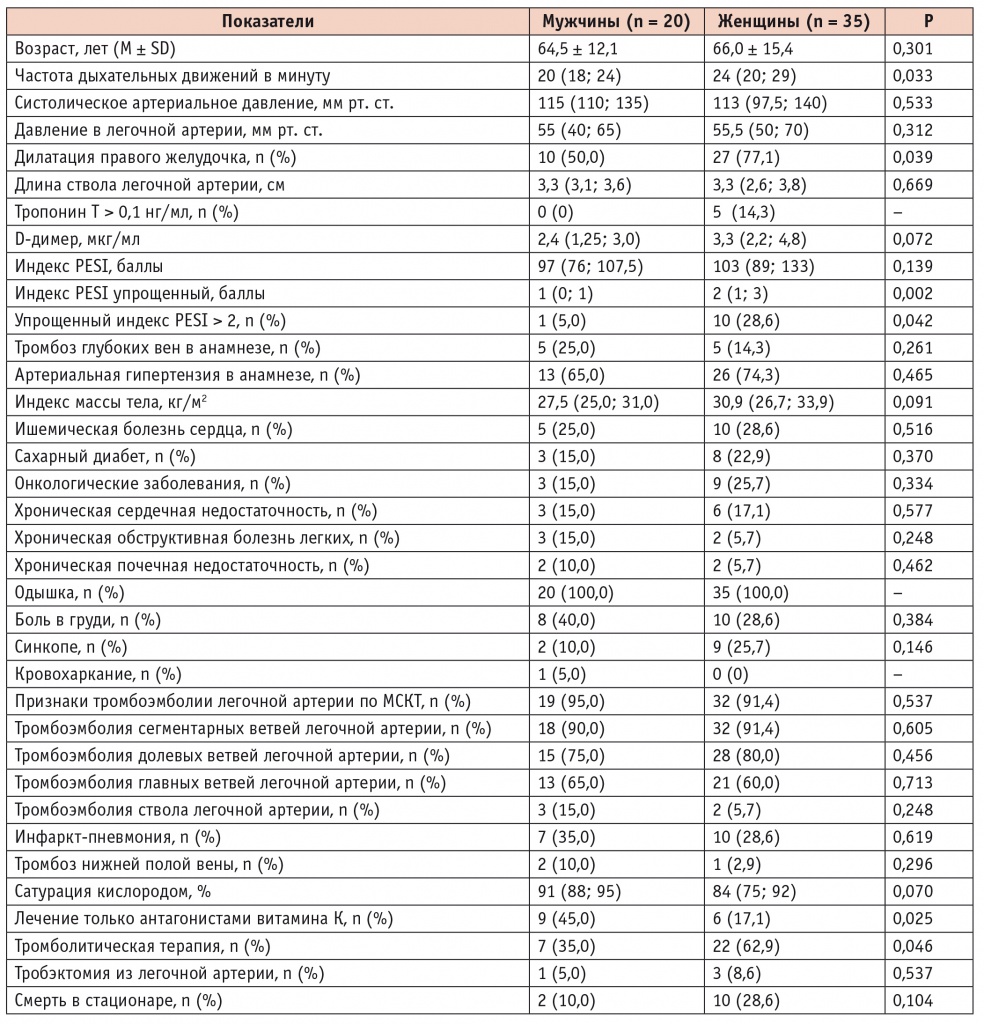
Значения упрощенного индекса PESI были статистически значимо выше у женщин (p = 0,002), при этом почти 30% женщин имели прогностически тяжелую ТЭЛА (PESI = 3–4, при сравнении с мужчинами р = 0,042). ТЛТ чаще проводилась у женщин, то время как консервативная терапия — у мужчин (в обоих случаях р < 0,05). Смертельный исход чаще имел место у женщин (28,6% против 10% у мужчин, p = 0,104).
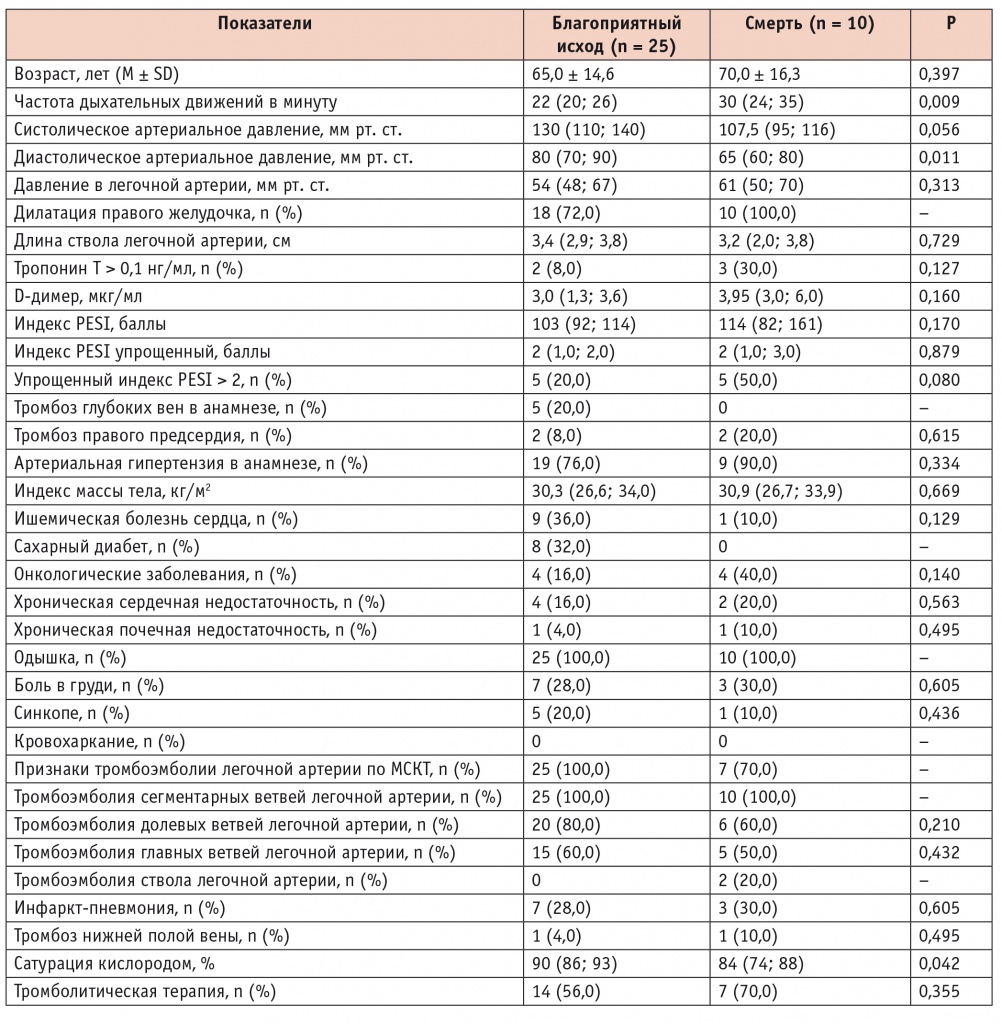
В связи с малым количеством смертельных исходов среди мужчин (2 случая) анализ предикторов смерти в данной группе пациентов провести не удалось. В то же время у женщин выявлены следующие факторы, предположительно влияющие на летальность (табл. 4): тахипноэ (р = 0,009), артериальная систолическая (р = 0,056) и диастолическая гипотензия (р = 0,011), низкая сатурация кислородом (р = 0,042). PESI > 2 был выявлен у 50% умерших женщин.
Таблица 4
Предикторы летального исхода тромбоэмболии легочной артерии у женщин
ОБСУЖДЕНИЕ
Среди пациентов терапевтического профиля наиболее часто ТЭЛА развивается при инсульте (56%), инфаркте миокарда (22%), острых терапевтических заболеваниях (16%), ново-
образованиях (15%), а также у лиц преклонного возраста (9%)[5, 12]. В нашем исследовании 21,8% больных ТЭЛА умерли, что составило 7,5% от всех летальных исходов в стационаре. Этот результат находится в диапазоне опубликованных ранее данных относительно летальности вследствие ТЭЛА[1, 4, 7]. Согласно эпидемиологической модели, более 317 000 смертей в шести странах Европейского союза (с общей популяцией 454,4 млн) были связаны с венозным тромбоэмболизмом (ВТЭ). Из них в 34% случаев манифестацией была внезапная фатальная ТЭЛА, в 59% случаев смерть наступила от ТЭЛА, которая не была диагностирована при жизни[19].
У обследованных нами больных ТЭЛА встречались одышка и слабость, что соответствует данным, приведенным в рекомендациях ESC по диагностике и лечению острой ТЭЛА (2014), где одышка отмечена в 50% случаев[19], и в российских публикациях[8, 10].
Анализ факторов риска показал, что развитие ТЭЛА чаще наблюдается у лиц женского пола в возрасте 40–60 лет с повышенной массой тела и сопутствующей АГ. В то же время в европейских рекомендациях в качестве мощных факторов риска, наряду с травмами и операциями, указываются декомпенсированная ХСН, инфаркт миокарда в течение 3 месяцев и ВТЭ в анамнезе[19]. Такой известный фактор риска, как венозный тромбоз, позволяет выделять больных высокого, умеренного и низкого риска развития ТЭЛА[24], однако в нашем исследовании частота выявления ТГВ нижних конечностей составила 18,2%. Не установлена и зависимость между наличием венозного тромбоза и летальным исходом у пациентов с ТЭЛА.
Кроме того, СД 2 типа, ХСН, ИБС и онкологические заболевания нами отмечались относительно нечасто: в 20,0%, 16,4%, 27,3% и 21,8% случаев соответственно. В европейских рекомендациях данные показатели идентифицированы как факторы среднего и низкого риска. Однако нельзя недооценивать наличие СД и онкологической патологии, являющихся важными предикторами рецидивирующего ВТЭ[3, 5, 14].
Лишь 20% пациентов с ТГВ (18,2%) и ТЭЛА (47,3%) в анамнезе принимали антикоагулянты на амбулаторном этапе с адекватным контролем МНО в случае приема варфарина.
Для диагностики ТЭЛА в последнее время часто определяют уровень D-димера в плазме крови. Высокая чувствительность метода (96–99%) позволяет исключить ТЭЛА при нормальном содержании D-димера (< 500 мкг/л)[26]. Но специфичность у него низкая (50%). В связи с тем, что повышенный уровень D-димера неспецифичен для ТЭЛА (он может быть обусловлен и другими причинами: сепсисом, инфарктом миокарда, злокачественными новообразованиями, воспалением, оперативными вмешательствами, некоторыми системными заболеваниями, беременностью и т. д.), положительная диагностическая ценность этого метода невысока (III, C) — при повышении уровня D-димера пациенту требуется дообследование для подтверждения наличия тромба в легочных сосудах.
Тем не менее данный тест позволяет на начальном этапе исключить ТЭЛА без дальнейшего обследования примерно у трети больных, поэтому определение содержания D-димера имеет большое значение для распределения пациентов с подозрением на тромбоэмболию.
У многих больных после перенесенной ТЭЛА уровень D-димера остается повышенным в течение нескольких месяцев, несмотря на проводимую антикоагулянтную терапию[12].
Г. Е. Ройтберг и А. В. Струтынский отмечают, что уровень смертности при нелеченой ТЭЛА достигает 30%, в то время как проведение адекватной антикоагулянтной терапии позволяет снизить эту цифру до 2–8%[11]. Вероятность рецидивов ТЭЛА у нелеченых больных составляет около 50%, половина из них имеет неблагоприятный прогноз. Примерно у трети пациентов, перенесших венозную тромбоэмболию, в течение 10 лет развиваются рецидивы заболевания. Полагают, что антикоагулянтная профилактика позволяет снизить риск симптомного ТГВ и ТЭЛА у нехирургических больных примерно на 60%[9, 20, 25].
Появление в последние несколько лет препаратов нового механизма действия расширило возможности маневра при лечении ВТЭ[13, 17, 22, 27]. В настоящее время в России зарегистрированы три новых оральных антикоагулянта (НОАК) — дабигатрана этексилат, ривароксабан и апиксабан.
В ходе настоящего исследования на этапе 2-й фазы антикоагулянтной терапии, продолжавшейся от 7 дней до 3 месяцев, пациентам был назначен АВК (варфарин). Выбор варфарина в качестве средства антикоагулянтной терапии обусловил ряд причин. Так, согласно рекомендациям Американской коллегии врачей — специалистов по заболеваниям грудной клетки (American College of Chest Physicians)[18] и рекомендациям ESC[19] по ведению больных с ВТЭ, при длительной и продленной терапии (3 месяца — неопределенный срок с периодической оценкой пользы/риска) назначают низкомолекулярный гепарин, АВК (МНО = 2,0–3,0), ривароксабан, дабигатрана этексилат.
Широко известны недостатки варфарина, к которым, в частности, относятся значительная вариабельность его эффекта за счет целого ряда факторов и риск возникновения кровотечений. Однако врачей, по-видимому, привлекает возможность достаточно четкого контроля как основного, так и побочного действия варфарина посредством измерения МНО.
Возникают определенные трудности при назначении отдельных НОАК пациентам с почечной недостаточностью. В этой ситуации рекомендуются более тщательное клиническое наблюдение, коррекция дозы дабиргатрана этексилата или выбор другого НОАК либо варфарина[23]. Назначение ривароксабана и апиксабана не рекомендуется пациентам с тяжелым нарушением функции почек (при клиренсе креатинина < 15 мл/мин).
Достаточно много вопросов при применении НОАК возникает и в отношении антидотов. Справедливости ради следует отметить, что в последние два года появились обнадеживающие сведения об антидотах к дабигатрана этексилату[15] и ривароксабану[21].
У пациентов с механическими протезами клапанов сердца препаратом выбора является варфарин, поскольку НОАК к настоящему времени не имеют достаточной доказательной базы для данной категории больных.
Положительный эффект дало хирургическое лечение ТЭЛА — оно способствовало благоприятному течению заболевания на стационарном этапе. Высокая летальность после проведенной ТЛТ была обусловлена ТЭЛА высокого риска с поражением ствола ЛА, а также повреждением миокарда, сопровождавшимся кардиогенным шоком. В нашем исследовании ТЛТ получали пациенты с высоким индексом PESI.
Несмотря на использование современных методов лечения, смертность от ТЭЛА в стационаре остается высокой[6, 12], в связи с чем в последнее время все больше внимания уделяют поиску факторов госпитальной летальности и вторичной профилактике ВТЭ. Так, в Международном кооперативном регистре по эмболии легочной артерии (International Cooperative Pulmonary Embolism Registry) в качестве неблагоприятных прогностических факторов идентифицированы возраст старше 70 лет, САД < 90 мм рт. ст., ЧДД > 20 в минуту, злокачественные новообразования, ХСН и ХОБЛ[19]. В регистре больных ТЭЛА г. Томска зафиксированы дополнительные факторы риска: вынужденная гиподинамия, хроническая венозная недостаточность и ожирение. Сравнительный анализ совокупности факторов риска и тяжести проявлений ТЭЛА позволил утверждать, что наличие трех факторов риска у пациента может привести к летальному исходу в стационаре[2].
В нашем исследовании прогностическими признаками летального исхода на госпитальном этапе являлись также артериальная гипотония, дисфункция ПЖ, повышенный уровень тропонина Т и поражение ствола ЛА по результатам МСКТ.
Наиболее значимыми неблагоприятными прогностическими факторами по-прежнему считают клинические признаки шока, дисфункцию ПЖ, признаки повреждения миокарда (кардиоспецифические ферменты, ЭКГ-признаки)[19]. При наличии всех трех факторов пациентов относят к группе высокого риска смерти в течение 30 суток после ТЭЛА, они должны быть подвергнуты тромболизису либо эмболэктомии.
Женщины с ожирением при сопутствующей АГ и сочетании трех и более факторов риска, описанных в рекомендациях по ведению больных ТЭЛА, требуют особого внимания и настороженности, особенно при их иммобилизации. Самое пристальное внимание следует уделять также первичной профилактике ВТЭ у лиц с факторами риска и вторичной профилактике у пациентов с перенесенной ТЭЛА посредством длительного применения пероральных антикоагулянтов.
ЗАКЛЮЧЕНИЕ
Неблагоприятный госпитальный исход у пациентов с тромбоэмболией легочной артерии (ТЭЛА) статистически значимо связан с артериальной гипотонией при поступлении, дилатацией правого желудочка, тромбозом ствола легочной артерии (ЛА) по результатам мультиспиральной компьютерной томографии и с повышенным уровнем тропонина Т. При наличии этих факторов больной должен быть отнесен к группе высокого риска летального исхода от ТЭЛА и требует строгого соблюдения современных рекомендаций по ведению пациентов с проведением тромболитической терапии либо тромбэктомии из ствола ЛА при отсутствии противопоказаний, а также адекватной антикоагулянтной терапии с соблюдением правил вторичной профилактики. Кроме того, больные женского пола, даже в отсутствие повышения кардиоспецифических маркеров и без поражения ствола ЛА, должны расцениваться как клинически тяжелые, у них необходимо активно проводить лечебные мероприятия в наиболее ранние сроки.








