Часть 1 настоящей статьи опубликована в журнале «Доктор.Ру» Неврология Психиатрия. 2020. Т. 19. № 9. С. 6–12. — Прим. ред.
Болезнь Паркинсона (БП) является одним из наиболее значимых заболеваний в клинической неврологии и представляет существенную медицинскую и социально-экономическую проблему в связи с высокой распространенностью во всем мире и значительной инвалидизацией пациентов[1, 2]. В соответствии с существующей классификацией среди паркинсонических синдромов выделяют: 1) первичный паркинсонизм, 2) атипичный паркинсонизм, 3) вторичный паркинсонизм и 4) паркинсонизм при наследственных заболеваниях ЦНС[3]. БП относится к первичному паркинсонизму и является вторым по распространенности нейродегенеративным заболеванием. В настоящее время диагностика БП базируется на разработанных клинических критериях, правильное использование которых во многом определяется квалификацией специалиста, поэтому отличить заболевание от других патологий может быть сложно, особенно на ранних стадиях[4].
Считается, что нейродегенеративные процессы при БП начинаются за несколько лет или даже десятилетий до появления двигательных симптомов[5]. В последние годы значительный интерес представляет разработка подходов к ранней диагностике заболевания как наиболее перспективной для реализации нейропротекторных стратегий и профилактической терапии у больных БП[6].
Дифференциальная диагностика паркинсонических синдромов считается одной из самых сложных в неврологии, частота ошибок в клиническом диагнозе может быть высокой даже в специализированных центрах[7]. До недавнего времени методы структурной нейровизуализации в рамках диагностики БП рассматривались как малоинформативные. Но, несмотря на ряд ограничений, МРТ за последние три десятилетия, несомненно, повысила точность дифференциальной диагностики БП, а достаточно высокие уровни чувствительности и специфичности транскраниальной сонографии (ТКС) доказаны с помощью методов функциональной нейровизуализации[7].
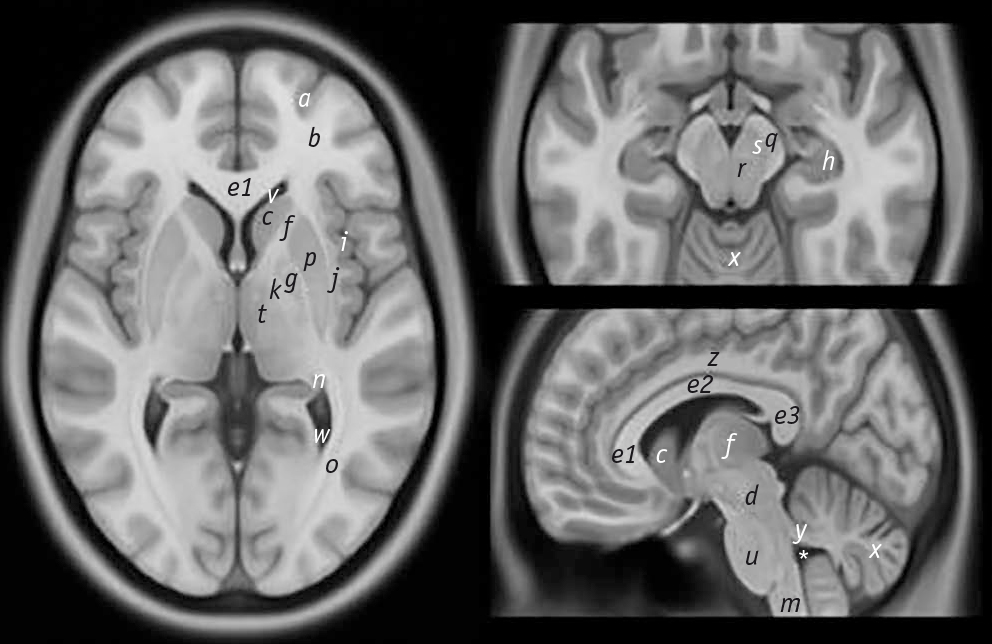
Технология высокопольной МРТ (3 Тл или более) характеризуется более высоким значением отношения сигнал/шум (англ. Signal-to-Noise Ratio, SNR), лучшей чувствительностью к более мелким повреждениям (рис. 1)[3, 8]. Кроме того, высокопольная МРТ позволяет лучше визуализировать серое и белое вещество головного мозга благодаря четким изображениям и плавным переходам между различными структурами, а также является более доступной методикой в сравнении с функциональными методами нейровизуализации[9].
Рис. 1. Анатомические расположения некоторых структур и областей головного мозга, важных при болезни Паркинсона и атипичных паркинсонических синдромах, выделены на стандартном усредненном T1-взвешенном шаблоне для нормальной популяции [3, 8].
Примечание: a — серое вещество головного мозга (лобная доля); b — белое вещество головного мозга (лобная доля); c — головка хвостатого ядра; d — средний мозг; e1 — колено мозолистого тела; e2 — тело мозолистого тела; e3 — валик мозолистого тела; f — передняя ножка внутренней капсулы; g — бледный шар; h — гиппокамп; i — островковая кора; j — клауструм; k — задняя ножка внутренней капсулы; m — продолговатый мозг; n — хвост хвостатого ядра; o — оптическая лучистость; p — путамен; q — передняя часть ножки мозга; r — красное ядро; s — черная субстанция; t — таламус; u — мост; v — передний рог бокового желудочка; w — задний рог бокового желудочка; x — мозжечок; y — верхняя мозжечковая ножка; z — поясная извилина; (*) — четвертый желудочек
Целью обзора является описание доступных методов структурной нейровизуализации БП.
МАГНИТНО-РЕЗОНАНСНАЯ ТОМОГРАФИЯ С ИЗОБРАЖЕНИЯМИ, ВЗВЕШЕННЫМИ ПО МАГНИТНОЙ ВОСПРИИМЧИВОСТИ
В настоящее время для диагностики БП предложен нейрорадиологический тест с использованием метода МРТ в SWI-режиме (англ. Susceptibility Weighted Imaging — изображения, взвешенные по магнитной восприимчивости). Это относительно новая импульсная последовательность МРТ, впервые описанная Е.М. Haacke и соавт. в 2004 г.[10]. В качестве контрастных агентов используются такие вещества, как деоксигемоглобин, железо и кальций.
Британские ученые из медицинской школы университета Ноттингема и Королевского медицинского центра при изучении мозга испытуемых использовали метод МРТ в SWI-режиме на аппаратах повышенной (7 Тл) мощности и разрешающей способности[11]. Им удалось обнаружить структурные изменения тканей головного мозга в средних отделах черной субстанции (лат. Substantia nigra), характерные для пациентов с БП. Оказалось, что у здоровых людей эта область напоминает хвост ласточки[11, 12], тогда как у больных БП разделение черной субстанции на две доли «ласточкиного хвоста» пропадает. Для проверки своего наблюдения ученые провели 114 сканирований головного мозга с высоким разрешением, в 94% случаев им удалось поставить точный диагноз. Дальнейшие исследования показали, что «ласточкин хвост» (и его отсутствие) можно разглядеть и на аппаратах мощностью 3 Тл (рис. 2, 3)[10].
Рис. 2. МРТ головного мозга (3 Тл, SWI-режим) здорового человека, аксиальный срез на уровне nigrosome-1 с увеличением среднего мозга (справа вверху) и схематическим изображением соответствующих анатомических структур (справа снизу)[10].
Примечание: 1 — красное ядро; 2 — покрышка среднего мозга; 3 — водопровод; 4 — околоводопроводное серое вещество; 5 — медиальная петля; 6 — нигросома-1; 7 — черное вещество; 8 — ножки мозга; 9 — сосцевидное тело; 10 — интерпедикулярная ямка; 11 — зрительная лучистость, 12 — третий желудочек; 13 — височная доля; 14 — мозжечок; 15 — лобная доля
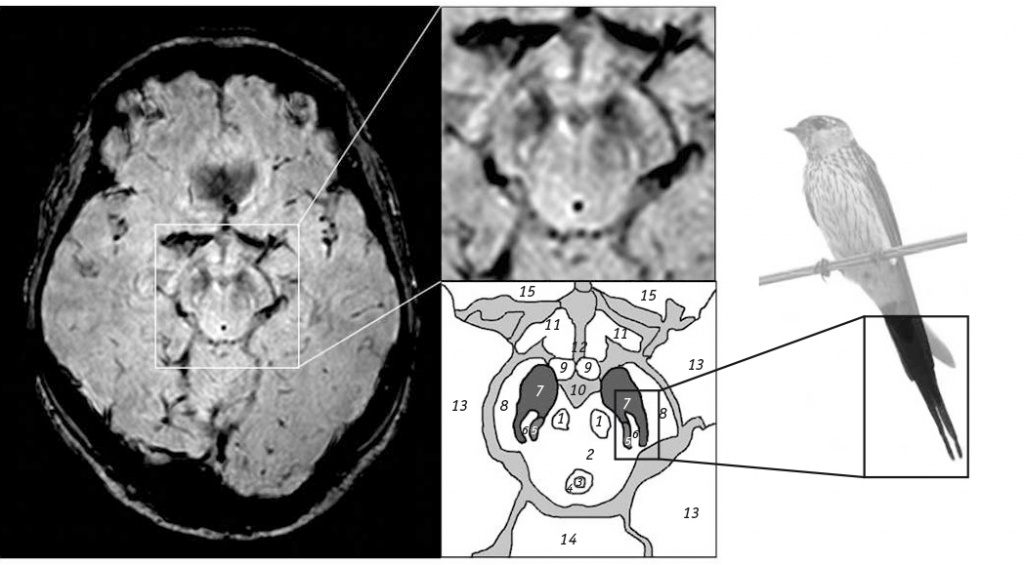
Рис. 3. Высокопольная МРТ головного мозга (SWI-режим): слева — пациентки с болезнью Паркинсона (женщина 60 лет, 53 балла по Объединенной шкале оценки болезни Паркинсона), nigrosome-1 отсутствует с обеих сторон; справа — здорового человека (женщина 61 года), nigrosome-1 присутствует с обеих сторон[10]
МАГНИТНО-РЕЗОНАНСНАЯ ТОМОГРАФИЯ С Т1-ВЗВЕШЕННЫМИ ИЗОБРАЖЕНИЯМИ
На сегодняшний день методы функциональной нейровизуализации, такие как однофотонная эмиссионная компьютерная томография (ОФЭКТ) с 123I-FP-CIT (123I-N-ω-fluoropropyl-2β-carbomethoxy-3β-(4-iodophenyl)tropane), представляют собой надежные способы раннего выявления БП и оценки прогрессирования заболевания. Их маркеры, однако, в основном свидетельствуют о проблеме в терминалях дофаминовых волокон, на что могут оказывать влияние компенсаторные механизмы — как эндогенные, так и возникающие в ответ на лечение. Депигментация черной субстанции связана прежде всего с утратой нейромеланина. Это вещество содержится в клетках черной субстанции среднего мозга — области, которая служит источником нейромедиатора дофамина. Утрата нейромеланина приводит к изменениям сигнала на Т1-взвешенных изображениях высокопольной МРТ (3 Тл). Недавние исследования показали, что снижение уровня нейромеланина в черной субстанции и голубоватом пятне является диагностическим критерием БП[13].
В исследование S. Reimão и соавт. (2015) были включены пациенты с впервые диагностированной БП, не получавшие лечения, с длительностью заболевания от 2 до 5 лет[14]. Была сформирована также контрольная группа, сопоставимая по полу и возрасту. Для визуализации нейромеланина использовалась высокопольная МРТ (3 Тл) в режиме Т1. Основными исследуемыми переменными являлись площадь и длина повышенного сигнала в области черной субстанции и отношение нейромеланин / средний мозг, определявшиеся с помощью метода полуавтоматической оценки. Отмечено, что в группе пациентов с БП эти показатели статистически значимо ниже по сравнению с контрольной группой. МРТ в режиме Т1 позволяла отличать больных БП от здоровых лиц с высокой чувствительностью и специфичностью. Полученные данные совпадают с более ранними результатами, свидетельствующими о стабильности содержания нейромеланина в процессе заболевания (рис. 4)[14–16].
Рис. 4. МРТ головного мозга (3 Тл, Т1-режим), аксиальный срез на уровне среднего мозга: слева — изображение черной субстанции (А) и голубоватого пятна (С) у здоровой женщины 66 лет; справа — изображение черной субстанции (B) и голубоватого пятна (D) у пациента с БП 70 лет[16]
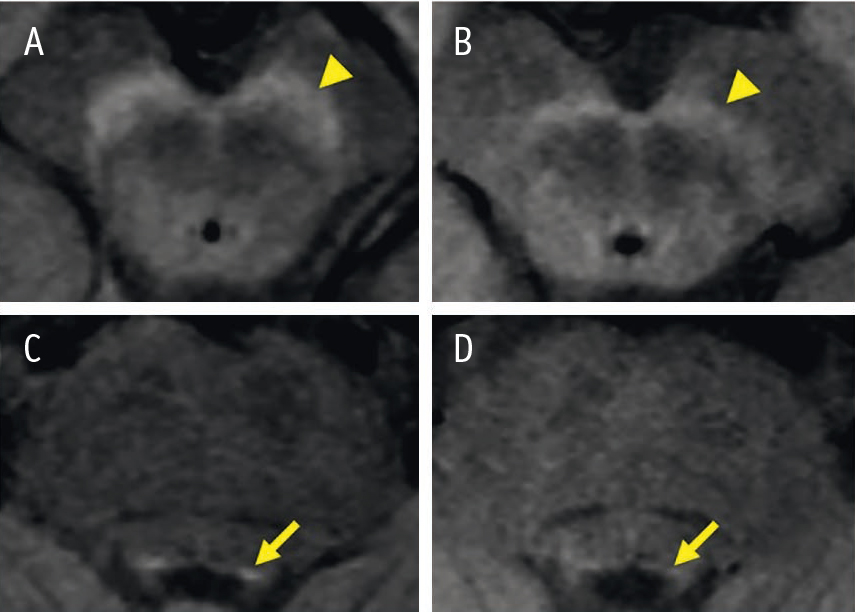
Кроме того, S. Reimão и соавт. (2015) показали, что данный метод может быть использован для дифференциальной диагностики ранней стадии БП (с преобладанием тремора в клинической картине) и эссенциального тремора: чувствительность и специфичность метода при этом составили 66,7% и 93,3% соответственно[14].
Ряд паркинсонических синдромов из группы нейродегенеративных заболеваний «паркинсонизм-плюс» на ранних этапах часто ошибочно диагностируются как БП. С. Guevara и соавт. (2016) занимались изучением вопроса ранней дифференциальной диагностики БП и прогрессирующего надъядерного паралича (ПНП) с использованием SIENAX-МРТ (англ. Structural Imaging Evaluation with Normalization of Atrophy — оценка структурного изображения с использованием стандартизации)[17].
SIENAX — это алгоритм, основанный на результатах проведенной МРТ, который позволяет количественно определить потерю объема мозговой ткани путем нормализации объема мозга к объему черепа. SIENAX извлекает изображения мозга из данных МРТ пациента, и затем для расчета общего объема ткани головного мозга, в том числе отдельной оценки общих объемов серого и белого вещества, выполняется сегментация с оценкой частичных объемов. В исследование были включены 21 пациент с БП, 18 пациентов с ПНП и 14 здоровых испытуемых. Установлено, что пациенты с ПНП имеют значительно меньший объем мозга, чем больные БП, а также лица контрольной группы, и уменьшение объема мозга у пациентов с ПНП происходит в основном за счет сокращения массы серого вещества. Обнаружена статистически значимая корреляция между выявляемыми изменениями и клиническим статусом у пациентов с ПНП[17].
К числу характерных изменений, обнаруживаемых с помощью методов структурной нейровизуализации, относится также церебральная атрофия в виде расширения корковых борозд и желудочковой системы мозга. Выраженность атрофии нарастает с увеличением тяжести и продолжительности заболевания. Атрофические изменения более выражены при акинетико-ригидной форме БП. При сочетании БП и деменции наиболее выраженные атрофические изменения показаны в затылочных и височных долях[18, 19].
Применение метода диффузионно-взвешенной трактографии при БП позволяет определить морфологические изменения белого вещества. Количественным показателем целости миелиновой оболочки является фракционная анизотропия. При БП отмечается снижение фракционной анизотропии в переднем бедре внутренней капсулы, белом веществе лобных долей, мозолистом теле, мосту. У пациентов с деменцией выраженность указанных изменений выше, чем у пациентов без деменции[20].
ТРАНСКРАНИАЛЬНАЯ СОНОГРАФИЯ
В последние годы в качестве неинвазивного скринингового метода структурной нейровизуализации при БП предложена ТКС.
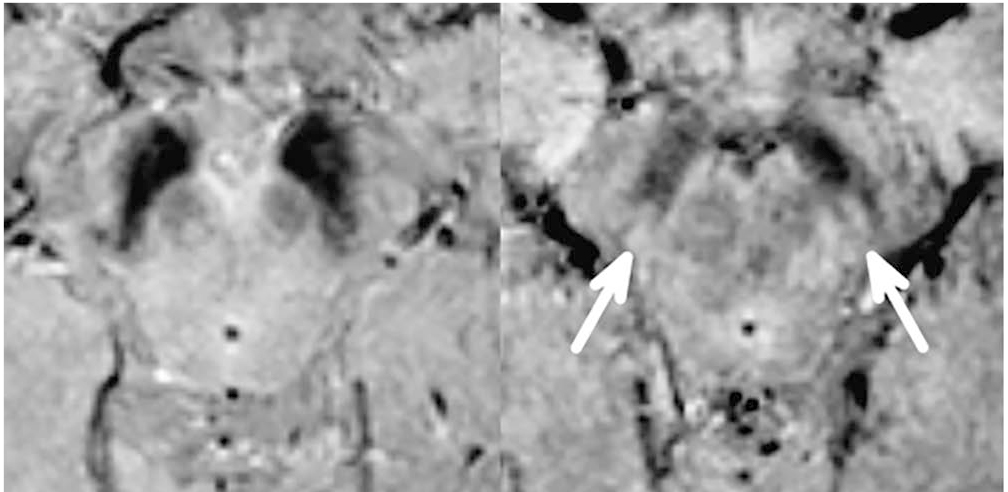
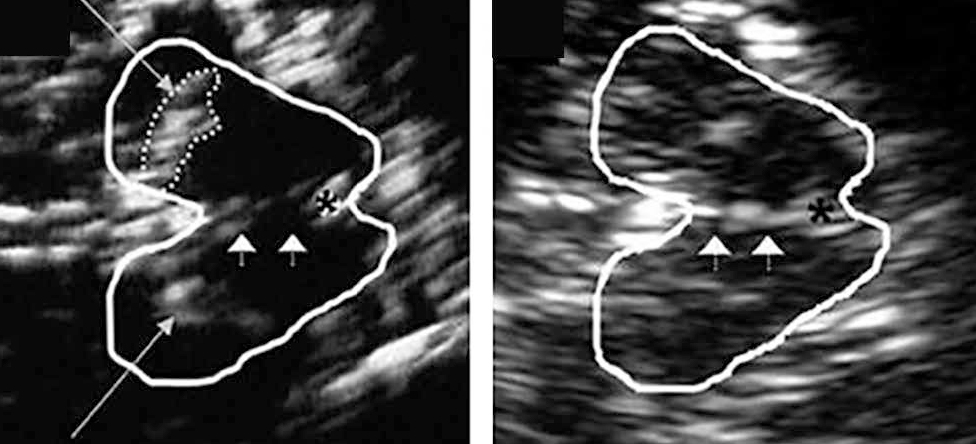
Существует достаточно большое количество исследований, посвященных применению ТКС в диагностике БП. При БП обычно наблюдается повышенная эхогенность черной субстанции, которую можно визуализировать на мезенцефальной плоскости как увеличенную, более светлую (т. е. слабоэхогенную) область в пределах более темного мезенцефала (рис. 5)[21, 22]. Гиперэхогенность черной субстанции наблюдается у пациентов с БП как при моногенной форме заболевания (мутации в генах LRRK2 и GBA), так и при идиопатической форме. Хотя точная этиология гиперэхогенности черной субстанции находится в стадии изучения, вероятно, эта гиперэхогенность связана с накоплением свободного (несвязанного) железа[3, 22, 23].
Рис. 5. Транскраниальное сонографическое изображение среднего мозга в форме бабочки в мезенцефальной плоскости: слева — увеличенная область эхогенности в анатомическом месте черной субстанции (длинные стрелки) и прерывистая эхогенная линия рафэ (короткие стрелки) при болезни Паркинсона; справа — нормальная эхогенность среднего мозга[3, 22].
Примечание: (*) — водопровод
По данным D. Li и соавт. (2016), чувствительность и специфичность ТКС черной субстанции в диагностике БП составляют 64,7% и 60% соответственно (в качестве контроля использовалась ОФЭКТ), в то время как положительная и отрицательная прогностическая ценность — 91,67% и 20% соответственно[21]. Диагностическая ценность ТКС у симптомных пациентов с БП показана также в исследовании X. Li и соавт. (2013). По данным этих авторов, ТКС имеет высокую прогностическую ценность при БП. При этом положительный результат ТКС доказывает наличие БП без необходимости дополнительного проведения позитронно-эмиссионной томографии (ПЭТ), однако отрицательный результат ТКС не исключает возможности БП[24].
Диагностическая точность ТКС на раннем этапе развития БП остается спорной. В исследовании, проведенном P. Liu и соавт. (2014), в которое входили 53 пациента с ранней стадией БП (в качестве контроля использовалась ПЭТ), чувствительность и специфичность ТКС оценены в 68,75% и 40% соответственно. В 31,25% случаев получен ложноотрицательный результат. Авторы пришли к выводу, что ТКС не может быть рекомендована к применению на ранней стадии БП[25]. Схожие данные получены в исследовании A.E. Bouwmans и соавт. (2013)[26].
P. Bártová и соавт. (2014) также исследовали диагностическую ценность ТКС на ранней стадии БП, но результаты сопоставляли с данными ОФЭКТ. Положительные результаты ТКС и ОФЭКТ достоверно коррелировали с диагнозом БП (ТКС: κ = 0,52, 95%-й ДИ: 0,27–0,76; ОФЭКТ: κ = 0,69, 95%-й ДИ: 0,49–0,90)[27].
В исследовании S. Hellwig и соавт. (2014) показана роль ТКС в дифференциальной диагностике паркинсонизма. В исследование входили 36 пациентов с клиникой атипичного паркинсонизма. Результаты ТКС сопоставлялись с данными ПЭТ, а также с клиническим диагнозом (период наблюдения — 9 месяцев). Чувствительность и специфичность ТКС в диагностике атипичного паркинсонизма составили 82% и 85% соответственно. Диагностическая точность ПЭТ и ТКС статистически значимо не различалась (90% и 83% соответственно; p = 0,69). Таким образом, ПЭТ и TКС показали сопоставимую точность в дифференциальной диагностике паркинсонизма[28].
Важно отметить, что у 10% здоровых людей, а также 16% пациентов с эссенциальным тремором может обнаруживаться гиперэхогенность черной субстанции при ТКС[29].
Преимуществами метода ТКС являются неинвазивность, широкая доступность в клинической практике, короткое время и относительно невысокая стоимость исследования, возможность проведения неограниченного количества исследований без риска для здоровья пациента. Кроме того, ТКС не зависит от двигательной активности обследуемых, что особенно важно для больных с экстрапирамидными расстройствами и гиперкинетической активностью. В связи с этим ТКС представляется перспективным инструментальным методом для скрининга и рутинной диагностики БП[1].
ЗАКЛЮЧЕНИЕ
В век новых технологий требуется появление доступных и достоверных методов диагностики болезни Паркинсона (БП), что особенно актуально для ранней доклинической стадии заболевания, а также у лиц с высоким риском развития БП.
Наряду с инструментальными методами диагностики активно разрабатываются лабораторные маркеры БП, но их выбор значительно усложняется ввиду генетической и, как следствие, биохимической гетерогенности заболевания. Методы функциональной нейровизуализации достоверны в диагностике и немоторной стадии БП, но их недостатками по-прежнему являются низкая доступность, высокая стоимость, необходимость введения фармпрепаратов, лучевая нагрузка, что не позволяет широко их использовать.
В представленном обзоре приведены современные возможности структурной нейровизуализации в диагностике БП. Ее методы уступают функциональным методам в определении доклинических форм, но могут быть эффективными у пациентов с ранней и развернутой стадией БП, когда требуется подтвердить или дифференцировать диагноз.
Поступила: 20.04.2021
Принята к публикации: 05.05.2021








