ВВЕДЕНИЕ
Боль в нижней части спины (БНС), по данным Международной ассоциации по изучению боли (англ. International Association for the Study of Pain), является распространенной глобальной проблемой. В 2017 году ее распространенность среди мирового населения оценивалась примерно в 7,5%, что составляет около 577 миллионов человек. С 1990 года БНС является ведущей причиной лет, прожитых с нетрудоспособностью (англ. Years Lived with Disability), в мире1.
Существенное значение имеет также негативный экономический эффект БНС: по результатам европейского исследования 2021 года, в котором приняли участие 16 стран, прямые и косвенные затраты на ее лечение составляют 3–10% валового внутреннего продукта европейских государств (6–19 тысяч евро в год на пациента)[1]. БНС вызывает снижение трудоспособности и общего качества жизни, повышает риск психологических и других сопутствующих заболеваний.
Данная категория пациентов чаще всего встречается на амбулаторном приеме у невролога и терапевта. По итогам опроса, проведенного в поликлиниках Москвы, 24,9% пациентов обратились за медицинской помощью в связи с БНС, а 52,9% испытывали БНС в течение последнего года2.
Подход к реабилитации пациентов с БНС определяется сроком заболевания, причинами и основными патогенетическими механизмами боли[2]3. При сроке заболевания менее 6 недель (острая БНС) и своевременном назначении курса реабилитации, включающего лечебную физкультуру, медикаментозные и физические методы, прогноз для пациента благоприятный4. Однако при хронической БНС эффективность и переносимость фармакологических препаратов ограниченны[1]5. Поэтому в реабилитации таких пациентов особое место приобретает неинвазивная стимуляция мозга с целью изменения нейрональной активности и создания анальгетического эффекта. В комплексной реабилитации лиц с хронической БНС используются также регулярные занятия лечебной физкультурой, физиотерапия, бальнеологические процедуры, рефлексотерапия[2]6. В отечественные клинические рекомендации по ведению пациентов с болью в спине методы неинвазивной нейростимуляции не включены[2]. Между тем авторы десятков зарубежных исследований рекомендуют их как эффективные способы снижения болевого синдрома[3–6].
«Золотым стандартом» нейростимуляции на протяжении многих лет является транскраниальная электростимуляция постоянным током (ТЭпТ). Однако в последние годы для коррекции болевого синдрома активно применяется ритмическая транскраниальная магнитная стимуляция (рТМС), зарекомендовавшая себя эффективным и безопасным методом при соблюдении определенных требований к интенсивности, частоте, длительности и числу процедур. Метод рТМС используется самостоятельно и в комплексном лечении (реабилитации) пациентов с хронической БНС. Максимальный анальгезирующий эффект наблюдался при применении высокочастотной рТМС в области моторной коры (M1)[7–10].
Целью обзора является освещение российского и зарубежного опыта применения неинвазивной нейромодуляции с целью обезболивания у пациентов с хронической болью в нижней части спины, описание различных методов нейромодуляции, а также других реабилитационных технологий, которые могут применяться в сочетании с ней у данных пациентов. Коротко представлены параметры и программы для оптимального проявления анальгезирующего эффекта нейромодуляции.
Оценивая эффективность лечения БНС, большинство зарубежных исследователей исходили из динамики интенсивности боли (визуальная аналоговая шкала, ВАШ), функциональных нарушений (опросники Роланда — Морриса и Освестри) и качества жизни (шкала SP-12). Такими же критериями при оценке эффективности лечения БНС руководствуются российские клиницисты7.
В данной работе обобщен опыт российских, европейских, американских, азиатских и австралийских ученых за последние 10 лет. В исследование вошли системные обзоры, метаанализы, отдельные исследования, представленные в базах данных PubMed, Cochrane и eLIBRARY.
БОЛЬ В НИЖНЕЙ ЧАСТИ СПИНЫ: ОПРЕДЕЛЕНИЕ И КЛАССИФИКАЦИЯ
В российских клинических рекомендациях «Боль в спине» (2021) БНС определяется как боль, мышечное напряжение и/или скованность, локализованные в области спины между XII парой ребер и нижними ягодичными складками с иррадиацией или без иррадиации в нижние конечности[2].
Это определение также соответствует международному термину, принятому ВОЗ. Синдром БНС (доброкачественная скелетно-мышечная боль в спине) не является нозологической единицей. Структура болевых синдромов в спине: 80–85% — неспецифические боли в спине; 10–15% — радикулопатии; 1–5% — специфические боли в спине, обусловленные серьезной патологией[2]. Вследствие высокой распространенности и невозможности у большей части пациентов установить конкретную анатомическую причину боли синдрому БНС в МКБ-10 придан статус «Боль внизу спины» (M54.5).
По длительности выделяют: острую БНС, которая продолжается до 6 недель (в последней версии отечественных клинических рекомендаций длительность острой боли ограничена 4 неделями); подострую БНС, продолжающуюся от 6 до 12 недель (согласно российским клиническим рекомендациям, 5–12 недель), и хроническую БНС сроком более 12 недель, то есть сверх нормального периода заживления поврежденных тканей[2, 11]. Наиболее благоприятный прогноз с частотой выздоровления от 39% до 90% в течение 6 недель имеет острая БНС[11].
Основные цели терапии БНС: 1) максимально быстрое и полное купирование болевого синдрома; 2) предотвращение хронизации и рецидивирования боли; 3) восстановление работоспособности пациента.
НЕЙРОПАТИЧЕСКАЯ БОЛЬ
Нейропатическая боль — это боль, вызванная поражением центральной или периферической нервной системы[12]. Она встречается с частотой от 3% до 18% и оказывает существенное негативное влияние на качество жизни пациента. В 60% случаев такая боль остается толерантной к медикаментозному лечению[13].
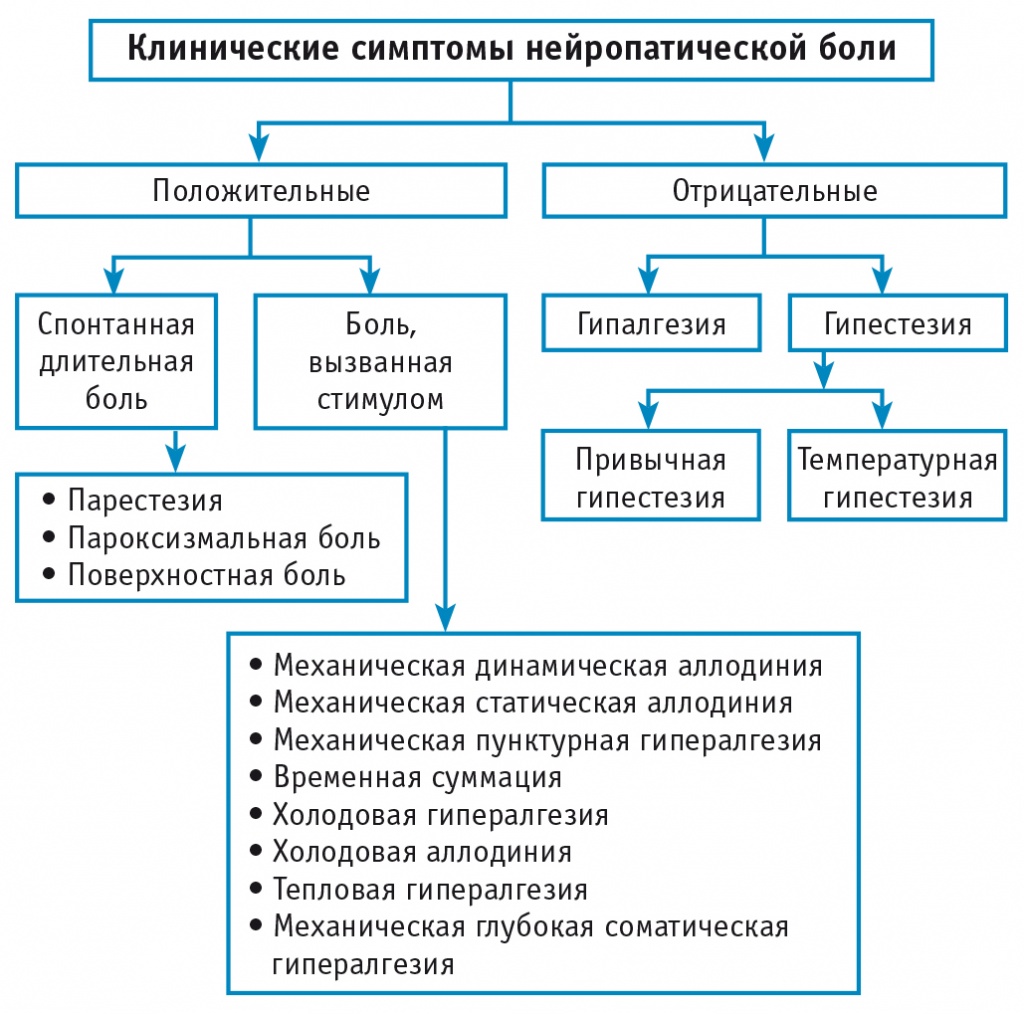
Клинические симптомы нейропатической боли по P. Shinu и соавт. представлены на рисунке 1[14].
Рис. 1. Положительные и отрицательные симптомы нейропатической боли[14]
Предполагается, что в развитии нейропатической боли играют роль:
1) периферическая сенсибилизация — повышение чувствительности ноцицепторов к нервному импульсу;
2) центральная сенсибилизация — пролонгированное высвобождение нейромедиаторов и связывание их с рецептором N-метил-D-аспартата (NMDA), что вызывает повышение уровня внутриклеточного кальция;
3) деафферентация — способность нервной системы генерировать аберрантные ноцицептивные импульсы, которые мозг интерпретирует как боль[15, 16].
Реабилитационные стратегии, направленные на реорганизацию соматосенсорной коры после повреждения, могут быть ценными альтернативными терапевтическими подходами к лечению нейропатической боли[15, 16].
При хронизации БНС к первоначальной ноцицептивной скелетно-мышечной боли присоединяется нейропатический компонент, существенно усложняющий процесс реабилитации и требующий применения других методов лечения, в частности методов центральной и периферической нейростимуляции.
МЕХАНИЗМЫ ДЕЙСТВИЯ И ОСНОВНЫЕ МЕТОДЫ ЦЕНТРАЛЬНОЙ НЕЙРОСТИМУЛЯЦИИ В ЛЕЧЕНИИ НЕЙРОПАТИЧЕСКОЙ БОЛИ
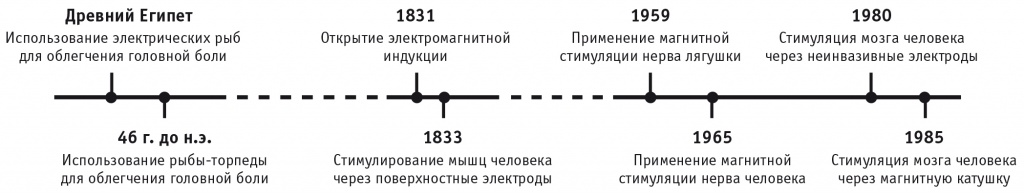
Стандартные методы лечения нейропатической боли в основном фармакологические, применяются, в частности, антидепрессанты, противоэпилептические препараты, местные анестетики и опиоиды. Эффективность фармакологических методов составляет 40%[13, 14, 16]. Немедикаментозное лечение включает психологические подходы, физиотерапию, интервенционную терапию и хирургические процедуры. В последние годы вырос интерес клиницистов и исследователей к неинвазивным методам нейростимуляции. Воздействие на мозг природным электричеством с обезболивающей целью известно с древних времен (рис. 2)[16].
Рис. 2. История развития нейростимуляции для лечения боли[16]
Неинвазивная нейростимуляция представляется специалистам наиболее перспективной ввиду ее эффективности и относительной безопасности. Среди методов центральной нейростимуляции в лечении хронической нейропатической боли используются в основном рТМС, ТЭпТ, транскраниальная электростимуляция переменным током, краниальная электротерапия, транскраниальная стимуляция случайным шумом и неинвазивная корковая электростимуляция с пониженным импедансом[14, 17, 18]. При этом ведущими методами являются рТМС и ТЭпТ.
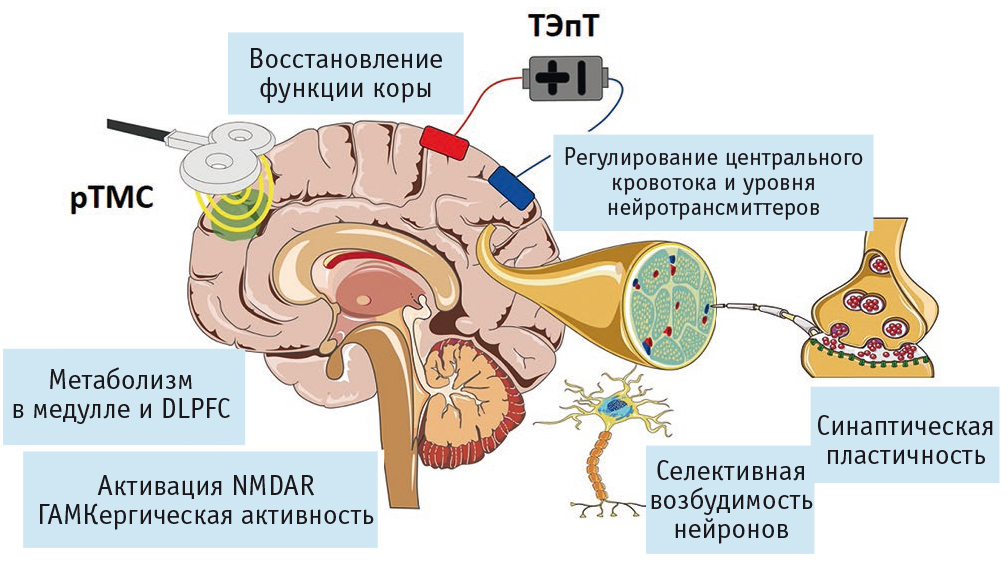
Болеутоляющий механизм рТМС и ТЭпТ заключается в изменении возбудимости коры и синаптической пластичности, регулировании выработки нейротрансмиттеров и влиянии на структурные и функциональные связи областей мозга, связанных с обработкой и регуляцией боли (рис. 3)[13].
Рис. 3. Общие механизмы нейростимуляции при хронической нейропатической боли[13].
Примечание. Здесь и на рис. 4, 5: ГАМК — гамма-аминомасляная кислота; DLPFC — дорсолатеральная префронтальная кора; NMDAR — рецепторы N-метил-D-аспартата
ТРАНСКРАНИАЛЬНАЯ ЭЛЕКТРОСТИМУЛЯЦИЯ ПОСТОЯННЫМ ТОКОМ
ТЭпТ — наиболее старый метод, впервые упомянутый исследователями более 200 лет назад. Более 25 лет назад он получил второе рождение. ТЭпТ является «золотым стандартом» нейростимуляции — безопасным неинвазивным методом воздействия на кору мозга через наложенные на волосистую часть головы электроды, соединенные с источником постоянного тока. Источник питания поддерживает напряжение в 9 В. Для уменьшения сопротивления электроды покрывают губками, пропитанными физиологическим раствором или гелем. Размеры используемых электродов для поддержания постоянной плотности тока и фокуса воздействия составляют 25–35 см2, плотность тока — от 0,029 до 0,08 мА/см2. Анодный электрод несет положительный, а катод — отрицательный заряд[19].
Параметры обезболивающей ТЭпТ. Дизайн протокола ТЭпТ требует установления трех параметров: силы тока, продолжительности процедуры и количества процедур.
ТЭпТ включает анодную и катодную стимуляцию. Когда положительно заряженный электрод (анод) помещается на поверхность головы, часть тока проникает в мозг и поляризует нейроны вблизи электрода, тем самым создавая возбуждение нейронов. Наоборот, отрицательно заряженный электрод (катод) снижает возбудимость коры и вызывает гиперполяризацию нейронов. В ряде современных исследований ТЭпТ достигала обезболивающего эффекта при силе тока 1–2 мА[4–7]. Большинство авторов рекомендуют процедуры продолжительностью от 20 до 30 минут. По наблюдениям большинства исследователей, обезболивающий эффект достигается при выполнении 5–10 процедур[4, 7].
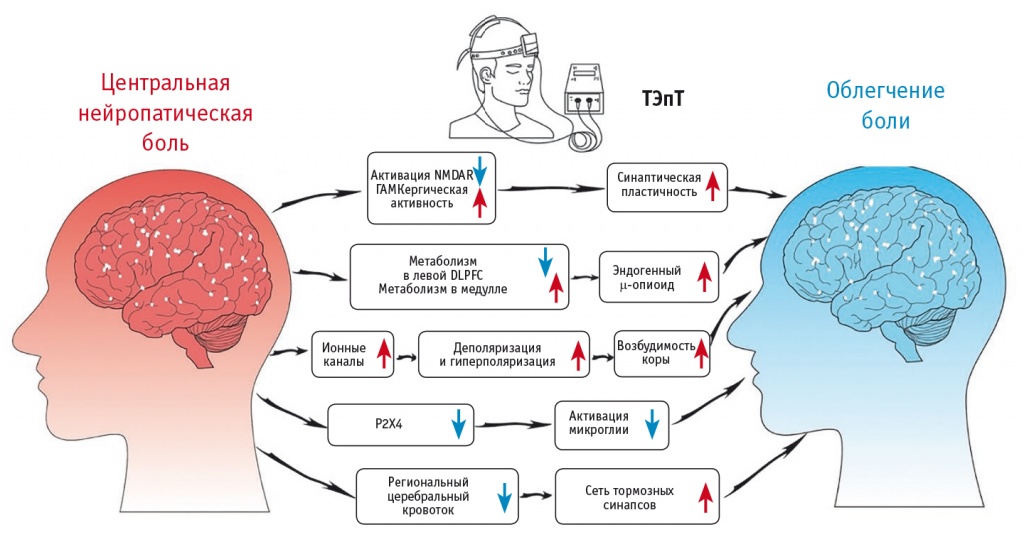
Есть предположение, что в основе обезболивающего действия ТЭпТ лежит модификация возбудимости нейронов в нейронных цепях, связанных с передачей сигналов боли, путем торможения либо прерывания этих таламических сигналов боли и других гиперактивных сетей локализации боли (рис. 4)[13].
Рис. 4. Нейрофизиологические механизмы транскраниальной электростимуляции постоянным током[13].
Примечание. P2X4 — пуринорецептор 4
ТРАНСКРАНИАЛЬНАЯ МАГНИТНАЯ СТИМУЛЯЦИЯ
В основе рТМС лежит принцип электромагнитной индукции, впервые открытый Майклом Фарадеем: изменяющееся магнитное поле порождает сопутствующее электрическое поле, которое индуцирует электрические токи в близлежащих проводящих структурах. В 1985 году A. Barker и соавт. предложили использовать магнитное поле для транскраниальной стимуляции. Метод оказался эффективным и заменил транскраниальную электростимуляцию, которая была болезненной и некомфортной для пациента. В большинстве случаев глубина воздействия при магнитной стимуляции ограничивается поверхностным слоем серого вещества головного мозга, однако есть свидетельства более глубокого (7–8 см) проникновения при рТМС, а следовательно, возможно ее влияние и на подкорковые структуры, такие как базальные ганглии и таламус[20].
Выбор места стимуляции на сегодняшний день осуществляется одним из трех нижеперечисленных способов. Большинство специалистов используют метод на основе вызванного моторного ответа. В систематическом обзоре K.-L. Zhang и соавт. в 19 из 30 исследований был использован именно он[16]. Оптимальное место стимуляции определяется по мышечному сокращению, обнаруженному визуально или с использованием ЭМГ. Порогом моторного ответа является минимальная интенсивность стимула, необходимая для того, чтобы вызвать хотя бы одно видимое мышечное сокращение[16, 21].
Метод на основе системы ЭЭГ 10/20. Согласно стандартной системе размещения электродов для проведения ЭЭГ 10/20, расстояние между электродами составляет 10% или 20% от индивидуально измеренных размеров головы[16].
Метод нейронавигации. Наиболее точное определение гиперактивных (или гиперметаболических) участков коры предполагает проведение трехмерной Т1-взвешенной МРТ, позитронно-эмиссионной томографии или функциональной МРТ[16]. Метод нейронавигации обеспечивает максимальную точность места стимуляции и потенциально повышает эффективность терапии.
Параметры обезболивающей рТМС. Эффективность рТМС в основном определяется четырьмя параметрами: частотой, интенсивностью, количеством импульсов за одну процедуру и общим количеством процедур. Кроме того, катушка в форме восьмерки обеспечивает сфокусированную, более глубокую стимуляцию — большинство авторов рекомендуют для обезболивающей рТМС именно ее[22 23].
Авторы отмечают эффективность анальгетического эффекта в диапазоне частот 5–20 Гц (K. Gatzinsky и соавт.) либо 10–20 Гц (A.F. Baptista и соавт.)[4, 9]. Интенсивность стимуляции определяется в интервале 80–120% от исходного значения порога моторного ответа[4–6]. Чаще всего используют 1500–3000 импульсов за процедуру, констатирован хороший обезболивающий эффект в данном диапазоне[4–6]. Для достижения более стойкого эффекта большинство авторов рекомендуют проведение 5–10 процедур рТМС[5, 6].
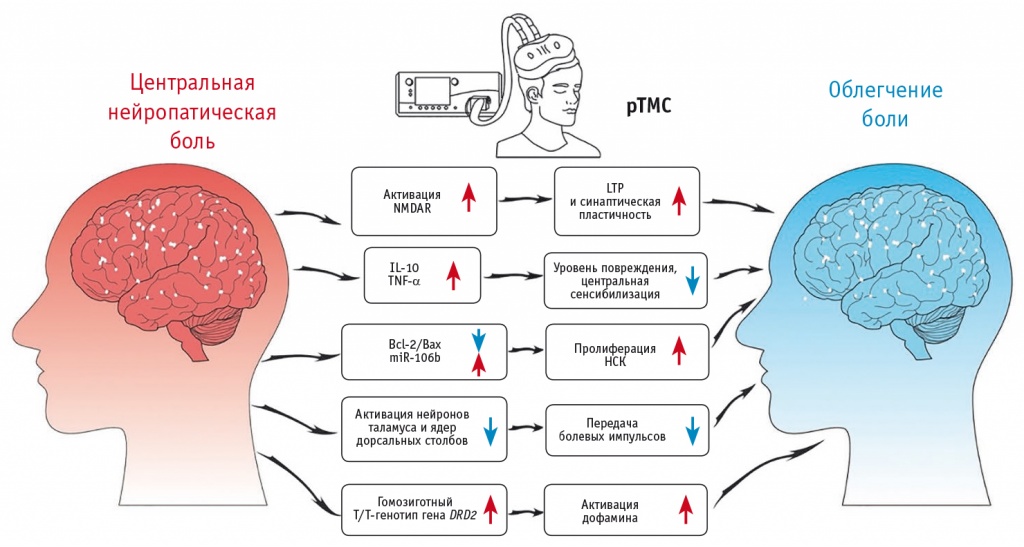
Имеются убедительные доказательства (уровень доказательности — А) высокого контроля над болью при использовании высокочастотной рТМС в области моторной коры (М1), контралатеральной локализации боли[24, 25]. Механизм обезболивающего действия рТМС во многом схож с механизмом транскраниальной электростимуляции (рис. 5)[13].
Рис. 5. Нейрофизиологические механизмы ритмической транскраниальной магнитной стимуляции[13].
Примечание. НСК — нейральные стволовые клетки; Bax — Bcl-2-ассоциированный протеин X; Bcl-2 — B-клеточная лимфома 2; DRD2 — дофаминовый рецептор D2; IL — интерлейкин; LTP (англ. long-term potentiation) — длительная потенциация; TNF — фактор некроза опухоли
В 2018 году N.E. O’Connell и соавт. обновили версию оригинального системного обзора 2014 года, посвященного эффективности методов неинвазивной нейростимуляции в лечении хронической боли, добавив 36 новых исследований. Авторами представленных в обзоре работ были обследованы различные группы пациентов с хронической болью, в том числе пациенты, имеющие патологии с дегенеративными изменениями тканей (например при артритах, повреждениях периферических нервов и ЦНС), а также ряд хронических болевых синдромов, таких как фибромиалгия и комплексный регионарный болевой синдром. По данным этого обзора, нейромодуляция является эффективным методом купирования болевого синдрома при большинстве нозологий, вызывающих хронический болевой синдром, включая БНС; среди методов нейростимуляции рТМС характеризуется наиболее выраженным анальгезирующим действием[6]. Для достижения обезболивающего эффекта при нейропатической боли преимущество следует отдавать высокочастотной рТМС, оптимальной областью воздействия является моторная кора (М1) на стороне, контралатеральной локализации боли (уровень доказательности — А)[6].
МЕТОДИКИ, ПРИМЕНЯЕМЫЕ ДЛЯ ЛЕЧЕНИЯ НОЦИЦЕПТИВНОЙ БОЛИ. СОЧЕТАННЫЕ МЕТОДИКИ С ИСПОЛЬЗОВАНИЕМ ЦЕНТРАЛЬНОЙ НЕЙРОСТИМУЛЯЦИИ
Для уменьшения хронической боли в пояснице, помимо нейростимуляции, можно использовать такие немедикаментозные подходы, как физические упражнения, физиотерапия, мануальная терапия, массаж, когнитивно-поведенческая терапия, рефлексотерапия. Сочетание нейростимуляции с другими видами неинвазивного лечения может усиливать обезболивающий эффект.
Лечебная физкультура является немедикаментозным методом, наиболее часто используемым при БНС, в соответствии с рекомендациями по клинической практике[2, 26]. В широком спектре возможностей лечебной физкультуры выделены упражнения на двигательный контроль (УДК, англ. Motor Control Exercises) вследствие их влияния на снижение болевого симптома[23].
По результатам рандомизированного контролируемого исследования, опубликованного P. Patricio и соавт. в 2021 году, была доказана эффективность сочетания рТМС с УДК и изолированного применения рТМС для снижения болевого синдрома, повышения трудоспособности, снижения боязни движения, улучшения качества жизни и общей субъективной оценки изменений в сравнении с контрольными группами пациентов (с применением имитации рТМС и комбинации имитации рТМС с УДК)[23].
Виртуальная реальность (ВР) представляет собой обогащенную среду с множественной сенсорной обратной связью (слуховой, визуальной, тактильной). Реабилитация в ВР задействует несколько корковых и подкорковых нейронных цепей, которые потенцируют обучение и восстановление пациента[27]. Метод может иметь некоторые преимущества перед традиционными занятиями: он позволяет моделировать реалистичную среду и ситуации из реальной жизни; комплекс упражнений может быть адаптирован для достижения конкретных реабилитационных целей; пациенты дольше сохраняют мотивацию к занятиям в виртуальной среде.
F. Alemanno и соавт. использовали ВР-технологию для реабилитации пациентов с БНС. Результаты клинического исследования показали значительное снижение интенсивности болевых ощущений по шкале оценки боли (p < 0,05), а также улучшение когнитивных функций (р < 0,05), параметров функциональных шкал (р < 0,05) и настроения (р = 0,04); отмечено повышение эффективности реабилитационного курса по сравнению с результатами в контрольной группе (где применялся стандартный комплекс лечебной физкультуры). Данные вошли в системный обзор R. Cassani и соавт.[27].
Ритмическая периферическая магнитная стимуляция (рПМС) — метод, при котором магнитная катушка располагается в зоне максимальных болевых ощущений в поясничной области.
В пилотном исследовании обезболивающего эффекта рПМС у пациентов с острой БНС, проведенном Y.-H. Lim и соавт. в Корее в 2018 году, уровень боли в группе рПМС снизился в среднем на 12,42 ± 8,71 пункта, в то время как в контрольной группе (с применением стандартного комплекса лечебной физкультуры) — на 1,00 ± 4,67 пункта. Важным эффектом рПМС, выявленным в этом исследовании, стало также раннее функциональное восстановление. Авторы выдвинули предположение, что снижение болевого синдрома влияет на скорость функционального восстановления. Анализ коэффициента корреляции показал достоверную положительную корреляцию ВАШ с ODI (корейская версия индекса инвалидности Освестри) и RMDQ (корейская версия опросника Роланда — Морриса)[11].
Парная сочетанная стимуляция (ПСС) — сочетание транскраниальной магнитной стимуляции со стимуляцией периферических нервов (СПН) — представляется перспективным инструментом для уменьшения болевого синдрома и двигательных нарушений. ПСС с СПН частотой 50 Гц повышает двигательную активность у пациентов с хроническим повреждением спинного мозга и вызывает устойчивую генерацию вызванного моторного потенциала у здоровых субъектов. ПСС с СПН частотой 100 Гц является эффективным методом, применимым в клинической практике[28].
Магнитотерапия широко используется для лечения острой и хронической боли при заболеваниях опорно-двигательного аппарата. Магнитные поля, применяемые в терапии боли, имеют частоту ниже 100 Гц и плотность магнитного потока в диапазоне от 0,1 до 30 мТл[29]. В последнее десятилетие выросло число случаев применения в терапии боли магнитных полей крайне низкой частоты и низкой интенсивности. Они синхронизируются по частоте с биологическими системами. Этот механизм взаимодействия между магнитными полями сверхнизких частот, магнитным полем Земли и живыми организмами был назван Р.Л. Либоффом (R.L. Liboff) циклотронным резонансом[30].
Клинические наблюдения, проведенные М. Woldańska-Okońska и соавт., обнаружили влияние магнитных полей низкой частоты и магнитной стимуляции на повышение уровня серотонина в сыворотке крови, что также может усиливать обезболивающий эффект при БНС[31]. Большинство авторов не ограничиваются одним методом и используют комплексный подход в реабилитации пациентов с хронической БНС.
ЗАКЛЮЧЕНИЕ
Первоочередной задачей в лечении хронической боли в нижней части спины (БНС) является купирование болевого синдрома. В связи с относительно низкой (40%) эффективностью и ограниченной переносимостью медикаментозной терапии у пациентов с БНС возрастает роль немедикаментозных методов анальгезии, к которым относится неинвазивная нейростимуляция. Последняя представлена рядом методов, наиболее популярными и эффективными из которых являются транскраниальная электростимуляция постоянным током (ТЭпТ) и ритмическая транскраниальная магнитная стимуляция (рТМС).
ТЭпТ — более ранний и хорошо изученный метод, но он связан с дискомфортом у пациента во время воздействия.
Метод рТМС зарекомендовал себя как эффективный и безопасный способ борьбы с ноцицептивной болью, а также с нейропатической болью, которая часто бывает компонентом хронических заболеваний, таких как БНС. Основной зоной воздействия при рТМС являются участки моторной коры (М1). Метод лучше переносится пациентами и обладает более высокой эффективностью в отношении купирования боли.
Болевой синдром является серьезным ограничением для проведения комплексных реабилитационных мероприятий, куда входят кинезиотерапия, массаж и т. д. Результаты восстановления функции во многом зависят от сроков начала лечения БНС: в острой стадии (в первые 4–6 недель) прогноз выздоровления пациента достигает 90%. Это должно определять для специалиста сроки начала реабилитации, в связи с чем мы предлагаем включать обезболивающую нейромодуляцию в комплексную терапию БНС начиная с острой стадии заболевания.
Поступила: 02.11.2022
Принята к публикации: 05.05.2023
________
1 International Association for the Study of Pain. Lower back pain has been the leading cause of years lived with disability since 1990 and remains a significant global public health concern. 2021 July 21. URL: https://www.iasp-pain.org/resources/fact-sheets/the-global-burden-of-low-back-pain/ (дата обращения — 20.06.2023).
2 Российское межрегиональное общество по изучению боли (РОИБ). Диагностика и лечение скелетно-мышечных (неспецифических) болей в нижней части спины: Клинические рекомендации. 2021. URL: https://painrussia.ru/study-of-pain/ (дата обращения — 20.06.2023).
3 Там же.
4 Там же.
5 Там же.
6 Там же.
7 Там же.








