Болевой синдром наиболее часто встречается на ранних стадиях диабетической полинейропатии (ДПН) и имеет нейропатический характер[1, 2].
Патофизиология нейропатической боли включает каскад ионных, биохимических и структурных модификаций периферической и центральной нервных систем, ответственных за сенсорное восприятие[3]. Одним из компонентов развития нейропатической боли является феномен деафферентации, обусловленный прорастанием тонких чувствительных С-волокон в наружные пластины заднего рога спинного мозга, последующим возбуждением глутаматергических NMDA-рецепторов с растормаживанием нейронов соматосенсорных путей и нарушением центральных антиноцицептивных влияний[4, 5]. При прогрессировании полинейропатии демиелинизация нервного волокна способна инициировать рост атипично направленных отростков и создание патологических эфаптических связей между соседними волокнами различной сенсорной модальности, что клинически обусловливает развитие аллодинии и парестезий при нейропатической боли[6]. Таким образом, важную роль в развитии центральной сенситизациии при нейропатической боли играют нейропластические процессы.
Основными регуляторами нейропластичности являются факторы роста, наиболее изученным из которых считается мозговой нейротрофический фактор (англ. brain-derived neurotrophic factor, BDNF). Помимо нейропротекторного и репаративного действия, экспериментально доказана его роль в развитии гиперальгезирующего эффекта[7]. Согласно распространенной точке зрения, мозговой нейротрофин может принимать участие в модуляции нейропатической боли вследствие активации глутаматергических NMDA-рецепторов заднего рога, исходя из чего исследование его содержания в динамике является перспективным направлением в изучении управления нейропатической болью при ДПН с помощью нейротрофической терапии[8–10].
При лечении нейропатической боли у больных ДПН эффективны несколько классов обезболивающих средств, однако монотерапия позволяет достичь адекватного обезболивания только у 40–60% пациентов[11, 12]. Сниженный эндоневральный кровоток в случае экспериментальной ДПН может быть скорректирован несколькими препаратами, модифицирующими течение заболевания[13]. Препарат актовегин является одним из наиболее известных лекарственных средств с доказанной эффективностью в коррекции клинических проявлений ДПН[14, 15].
Актовегин представляет собой депротеинизированный гемодериват, получаемый из крови телят методом ультрафильтрации. Он содержит низкомолекулярные соединения массой до 5000 Да. Актовегин проявляет антиоксидантные свойства, улучшает клеточный энергетический метаболизм, а также оказывает инсулиноподобное действие, стимулируя транспорт и окисление глюкозы[16]. Механизмы, благодаря которым актовегин проявляет эффект в отношении болевых нейропатических симптомов, на настоящий момент окончательно не выяснены.
Цель исследования: изучение влияния препарата актовегин на динамику болевого статуса, выраженности полинейропатии по электронейрофизиологическим показателям и концентрации мозгового нейротрофического фактора в сыворотке крови у пациентов с диабетической полинейропатией.
МАТЕРИАЛЫ И МЕТОДЫ
На кафедре неврологии Пермского государственного медицинского университета (заведующая кафедрой — проф. Ю.В. Каракулова) в течение 2017–2018 гг. проводилось простое открытое сравнительное рандомизированное исследование по оценке эффективности применения нейрометаболического препарата актовегин.
В основную группу входили 36 пациентов с ДПН: 21 женщина (58,33%) и 15 мужчин (41,67%). Средний возраст больных составлял 55,2 ± 9,54 года, средняя длительность ДПН — 6,8 ± 2,45 года. Группа контроля состояла из 11 практически здоровых лиц того же возраста с аналогичным распределением по полу.
Критериями включения в исследование были подтвержденный диагноз ДПН, подписание добровольного информированного согласия на участие в исследовании, отсутствие противопоказаний к применению препарата актовегин. К критериям исключения относились возраст менее 18 лет, недееспособность, беременность, сопутствующая неврологическая патология, онкологические и острые инфекционные заболевания.
Методом конвертов пациентов с ДПН рандомизировали на две подгруппы по 18 человек в каждой. Все больные получали базисную сахароснижающую терапию, витаминотерапию (тиоктовая кислота — 600 ЕД в/в капельно № 10, тиамин — 1 мл в/м № 10, витамин В12 — 1 мл в/м № 10), занятия лечебной физкультурой. Больным первой подгруппы наряду с базисной терапией проводили курс лечения нейрометаболическим препаратом актовегин в дозе 10 мл внутривенно медленно в течение 10 дней. Согласно дизайну исследования все пациенты были обследованы дважды — до и после курсового лечения.
Компенсацию углеводного обмена определяли по уровню гликированного гемоглобина. Клиническое обследование включало в себя оценку жалоб, анамнеза, а также болевого статуса с помощью Визуальной аналоговой шкалы (ВАШ) и шкалы PainDetect. Неврологическое обследование проводилось с применением шкал общего симптоматического счета (англ. Total Symptom Score, TSS), нейропатического симптоматического счета (англ. Neuropathy Symptom Score, NSS), нейропатического дисфункционального счета (англ. Neuropathy Disability Score, NDS) и предусматривало количественную оценку неврологических изменений с анализом нарушений болевой, тактильной, вибрационной чувствительности, изменения сухожильных рефлексов. Электронейромиография (ЭНМГ) нижних конечностей выполнялась по методике изучения нервной проводимости для малоберцового и икроножного нервов на приборе Viking Quest (Nicolet Biomedical, США). Оценивались амплитуда сенсорного S-ответа икроножного нерва, амплитуда, латентность М-ответа и скорость распространения возбуждения (СРВ) малоберцового нерва.
Количественное изучение BDNF в сыворотке крови пациентов проводили методом твердофазного иммуноферментного анализа с использованием стандартных наборов тест-систем (Cloud-Clone Corp., США).
Статистическая обработка данных выполнена с помощью пакета программ Statistica v. 10. Так как не все группы имели нормальное распределение данных, параметрические методы исследования не применялись. Для сравнения независимых выборок непараметрических данных использовали критерий Манна — Уитни, для сравнения показателей до и после лечения — критерий Вилкоксона. Взаимосвязь различных факторов выявляли с помощью коэффициента корреляции по Спирмену. Критический уровень значимости при проверке статистических гипотез принимали равным 0,05.
Протокол исследования одобрен локальным этическим комитетом Пермского государственного медицинского университета им. акад. Е.А. Вагнера Минздрава России.
РЕЗУЛЬТАТЫ
По полученным данным, углеводный обмен был декомпенсирован у 26 пациентов (72,2%). Средний уровень гликемии составил 10,54 ± 3,52 ммоль/л, уровень гликированного гемоглобина — 11,18 ± 4,58%.
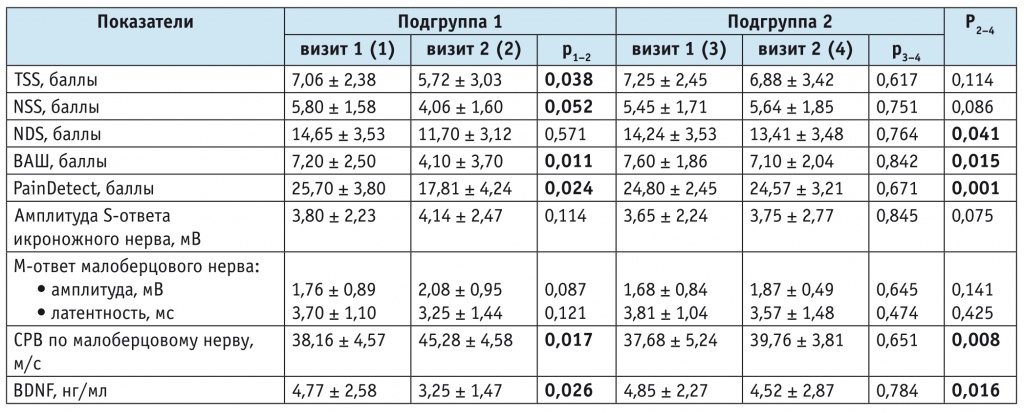
При первом обследовании у пациентов обеих подгрупп был выявлен выраженный нейропатический болевой синдром. Интенсивность болевого синдрома по ВАШ и по шкале PainDetec в первой подгруппе не имела статистически значимых отличий от показателей второй подгруппы (р = 0,875 и р = 0,714 соответственно) (табл.).
Таблица
Сравнительный анализ показателей клинического, электронейрофизиологического, лабораторного обследования пациентов с диабетической полинейропатией до и после лечения
Примечания.
1. Данные представлены в форме среднего значения и стандартного отклонения.
2. ВАШ — Визуальная аналоговая шкала; СРВ — скорость распространения возбуждения; BDNF — мозговой нейротрофический фактор; NDS — Шкала нейропатического дисфункционального счета; NSS — Шкала нейропатического симптоматического счета; TSS — Шкала общего симптоматического счета.
Общая оценка субъективных симптомов нейропатии до лечения у пациентов первой подгруппы по шкале ТSS составила 7,06 балла, по шкале NSS — 5,80 балла, у пациентов второй подгруппы получены сходные значения (р = 0,845 и p = 0,728 соответственно). Объективная оценка неврологического статуса по шкале NDS свидетельствовала о наличии выраженной степени нейропатии в обеих подгруппах (р = 0,814) (см. табл.).
При корреляционном анализе выявлена прямая зависимость интенсивности болевого синдрома по шкале PainDetect от уровня гликированного гемоглобина (R = 0,289, р = 0,007).
В ходе проведенной до лечения ЭНМГ установлены признаки аксонально-демиелинизирующего поражения нервных волокон различной степени тяжести у всех больных. Значения амплитуды и латентности M-ответа малоберцового нерва, СРВ по малоберцовому нерву и амплитуды S-ответа икроножного нерва, полученные в первой подгруппе, не имели статистически значимых отличий от показателей пациентов второй подгруппы (во всех случаях р > 0,05) (см. табл.).
При выполнении корреляционного анализа отмечена прямая зависимость между длительностью ДПН и выраженностью полинейропатии, оцененной с помощью шкалы NDS (R = 0,538, p < 0,05). Определена обратная корреляция между длительностью ДПН и степенью аксонального поражения по данным ЭНМГ (R = –0,6001, p < 0,05). Уровень гликированного гемоглобина также был обратно пропорционален амплитуде М-ответа малоберцового нерва (R = –0,327, p < 0,05) и S-ответа икроножного нерва (R = –0,510, p < 0,05).
Уровень BDNF в сыворотке крови у больных первой подгруппы статистически значимо превысил соответствующий показатель группы здоровых лиц (4,77 ± 2,58 нг/мл против 1,02 ± 0,65 нг/мл; р = 0,001). Среднее содержание BDNF в сыворотке крови у больных второй подгруппы также было статистически значимо больше, чем в группе здоровых лиц (р = 0,001), и не отличалось от такового в первой подгруппе (р = 0,814) (см. табл.).
При проведении корреляционного анализа выявлены прямые зависимости количественного содержания BDNF в сыворотке крови от степени компенсации углеводного обмена (R = 0,351, p < 0,05), интенсивности боли по шкалам ВАШ (R = 0,326, p < 0,05) и PаinDetect (R = 0,381, p < 0,05).
Как показано в таблице, по завершении курсового лечения препаратом актовегин у пациентов первой подгруппы отмечено статистически значимое снижение степени нейропатии по шкалам NSS, TSS, интенсивности нейропатической боли по шкалам ВАШ и PainDetect, а также количественного содержания BDNF в сыворотке крови. При анализе ЭНМГ-показателей выявлено статистически значимое увеличение СРВ по малоберцовому нерву. У пациентов второй подгруппы статистически значимых клинико-нейрофизиологических улучшений, а также изменения содержания BDNF в сыворотке крови во время второго визита не обнаружено.
ОБСУЖДЕНИЕ
При комплексном клинико-инструментальном обследовании пациентов с ДПН до лечения выявлена выраженная нейропатия, которая коррелировала с длительностью заболевания, степенью компенсации углеводного обмена и клинически проявлялась нейропатическим болевым синдромом. Обнаружено, что интенсивность нейропатической боли имеет положительную корреляцию с количественным содержанием BDNF в сыворотке крови. Таким образом, усиление экспрессии BDNF в сыворотке крови может выступать маркером нейропатического компонента боли у пациентов с ДПН.
Применение препарата актовегин у больных ДПН приводит к снижению интенсивности нейропатической боли, оптимизации неврологического статуса и улучшению нервной проводимости по результатам ЭНМГ. Механизмы анальгетического действия актовегина заслуживают дальнейшего изучения. Действие препарата направлено на улучшение микроциркуляции, энергообеспечения и метаболизма нервной ткани, повышение резервов антиоксидантной защиты клетки. Воздействуя на основные звенья патогенеза ДПН, препарат статистически значимо снижает экспрессию BDNF, подавляя механизмы центральной сенсибилизации и модулируя процессы нейропластичности.
ЗАКЛЮЧЕНИЕ
Многокомпонентный механизм действия препарата актовегин позволяет считать его патогенетически обоснованным звеном нейротрофической терапии в лечении болевой формы диабетической полинейропатии.








