Противоэпилептическая терапия требует длительного и регулярного приема противоэпилептических препаратов (ПЭП). Обеспечение ее безопасности является актуальной проблемой современной медицины, поскольку нежелательные побочные реакции (НПР) могут оказаться весомее любых положительных эффектов терапии, связанных с редукцией припадков[1]. НПР могут снижать качество жизни, вызывать серьезные социальные (распад семьи и др.) и медицинские (депрессию, нервную анорексию и др.) проблемы и приводить к росту финансовых затрат, связанному с неэффективностью лечения, развитием осложнений и необходимостью назначения других лекарственных препаратов или методов терапии как для лечения основного заболевания, так и для коррекции НПР. На метаболизм ПЭП может влиять полиморфизм генов CYP2C9, CYP2C19, CYP3А4, кодирующих изоферменты цитохрома Р450 печени[2], но персонализированный подход к профилактике НПР у пациентов, страдающих эпилепсией, с учетом индивидуальных фармакогенетических особенностей внедрен лишь в отдельных регионах РФ[3, 4].
Вальпроевая кислота (ВК) и ее производные более полувека широко используются в качестве ПЭП в связи с широтой терапевтического действия, отсутствием индуцирующего влияния на активность ферментов печени, возможностью применения у детей и взрослых. Среди ограничений к применению ВК особого внимания требуют женщины детородного возраста в связи с риском развития тератогенного эффекта[5, 6].
Информация о реальной частоте ПЭП-индуцированных НПР важна для оценки соотношения «польза — риск» и принятия решений о тактике дальнейшего применения ПЭП в клинической практике. Исследования по изучению роли однонуклеотидных полиморфизмов (ОНП) генов, кодирующих изоферменты CYP450 печени, которые участвуют в метаболизме ВК, показали, что основным является изофермент CYP2C9. Частота встречаемости медленных метаболизаторов по CYP2C9 вариабельна и зависит от этнической принадлежности пациентов[7–10].
С учетом многонационального состава населения РФ большое значение имеет изучение региональных особенностей встречаемости ОНП генов, ответственных за метаболизм ПЭП, и их влияния на частоту развития НПР. Эти данные необходимы для разработки персонализированных терапевтических стратегий, учитывающих индивидуальные особенности пациента, и оптимизации фармакотерапии эпилепсии.
Цель исследования: оптимизация фармакотерапии эпилепсии на основе персонализированного подхода к оценке риска развития нежелательных побочных реакций препаратов вальпроевой кислоты.
МАТЕРИАЛЫ И МЕТОДЫ
Для достижения цели были изучены:
1) база данных министерства здравоохранения Красноярского края по лекарственным препаратам, отпущенным за счет средств федерального бюджета больным эпилепсией — жителям Красноярского края, за 2011–2014 гг.;
2) база данных государственного предприятия Красноярского края «Губернские аптеки» за 2011 и 2015 гг., содержащая сведения о количестве упаковок и стоимости ПЭП, отпущенных за личные средства пациентов;
3) база данных неврологического центра эпилептологии, нейрогенетики и исследования мозга университетской клиники (НЦ УК) Красноярского государственного медицинского университета им. проф. В.Ф. Войно-Ясенецкого за 2010–2016 гг., содержащая сведения о 1169 амбулаторных картах больных эпилепсией.
Кроме того, проанализированы результаты исследования ОНП CYP2C9*1, CYP2C9*2, CYP2C9*3 гена CYP2C9, кодирующего изофермент 2С9 цитохрома Р450 печени, у пациентов с эпилепсией.
Показатели потребления оценивали по международным непатентованным наименованиям (МНН) тех ПЭП, которые имели АТС-код и показатель DDD, определенный ВОЗ[11].
Количество отпущенных средних суточных доз DDD (DDDs) рассчитывали по формуле:
где: NDDD — общее количество препарата, отпущенного за анализируемый период (в граммах);
DDD — установленная суточная доза препарата (в граммах).
Для определения показателя «количество DDD/1000 льготополучателей в день» применяли формулу:
Анализ потребления лекарственных препаратов на основе их доли в общем числе установленных суточных доз проводили с использованием методики DU-90% (англ. Drug Utilization 90%). Частотный анализ выполнен как расчет отношения количества пациентов, получивших определенный ПЭП, к общему количеству пациентов (в процентах).
По каждой амбулаторной карте пациентов, наблюдающихся в НЦ УК с диагнозом «эпилепсия» и имеющих зарегистрированные НПР, вызванные приемом ПЭП, анализировались:
1) демографические сведения: пол, возраст, местожительство;
2) МНН, торговое наименование и суточная доза ПЭП, прием которого вызвал развитие НПР;
3) наименование НПР и система органов, к которой относятся проявления НПР;
4) степень достоверности причинно-следственной связи между препаратом и НПР по шкале Наранжо[12];
5) тактика врача после выявления НПР (снижение дозы или отмена ПЭП, вызвавшего развитие НПР, назначение дополнительной лекарственной терапии);
6) результат терапевтического лекарственного мониторинга (ТЛМ) ВК в плазме крови;
7) результат молекулярно-генетического тестирования носительства полиморфизмов CYP2C9*2 и CYP2C9*3.
Тип НПР определялся по классификации ВОЗ[13]: тип A — предсказуемые реакции, связанные с фармакологической активностью лекарственного средства; тип B — лекарственная непереносимость, идиосинкразия, аллергические и псевдоаллергические реакции; тип C — НПР, возникающие при длительном приеме лекарственного средства, такие как толерантность, синдром отмены, лекарственная зависимость; тип D — отсроченные эффекты, такие как канцерогенные, мутагенные, тератогенные реакции, эмбриотоксическое действие.
ТЛМ ВК в крови проводился на базе центральной научно-исследовательской лаборатории (ЦНИЛ) КрасГМУ им. проф. В.Ф. Войно-Ясенецкого, в лаборатории НИИ медицинских проблем Севера (Красноярск). Концентрацию ВК в плазме крови определяли методом высокоэффективной жидкостной хроматографии. Величина референсного значения этого показателя составляла 50–100 мкг/мл.
Молекулярно-генетические исследования выполнены на базе межкафедральной лаборатории медицинской генетики кафедры медицинской генетики и клинической нейрофизиологии ИПО и ЦНИЛ КрасГМУ им. проф. В.Ф. Войно-Ясенецкого. Методом ПЦР в режиме реального времени исследовали следующие ОНП гена CYP2C9 на хромосоме 10q24.1–24.3: распространенный полиморфизм (дикий тип) CYP2C9*1; минорные ОНП (мутантного типа) CYP2C9*2 (R144C, c.430С>Т), CYP2C9*3 (I359L, c.1075А>С). После этого в зависимости от генотипа уточняли тип метаболизма ВК: CYP2C9*1/*1 — экстенсивный метаболизатор; CYP2C9*1/*2, CYP2C9*1/*3 — медленный метаболизатор; CYP2C9*2/*2, CYP2C9*3/*3 и CYP2C9*2/*3 — сверхмедленный метаболизатор. Тип метаболизма определяет скорость биотрансформации ВК в печени: у экстенсивных метаболизаторов этот показатель находится в пределах нормы; у медленных метаболизаторов он снижен на 25–30%, а у сверхмедленных метаболизаторов — на 50% и более.
При проведении клинико-экономического анализа использовали отраслевой стандарт «Клинико-экономические исследования. Общие положения» (ОСТ 91500.14.0001-2002), метод моделирования «древо решений». В качестве альтернатив выступали традиционный и персонализированный подходы к ведению пациентов с эпилепсией. Доли экстенсивных, медленных и сверхмедленных метаболизаторов соответствовали данным, полученным в собственном исследовании по определению частоты носительства CYP2C9*2 и CYP2C9*3 у больных, страдающих эпилепсией, проживающих на территории Красноярского края[14].
Ожидаемая стоимость лечения (затраты) в год в каждой группе была рассчитана по формуле:
С1 × 365 + С2 × Ч1 + С3 × Ч2 + Ф + С4 × Ч3,
где: С1 — стоимость средней суточной дозы вальпроатов;
С2 — стоимость курса лекарственных препаратов для купирования НПР ПЭП;
Ч1 — доля больных с развитием НПР ПЭП;
С3 — тариф на проведение ТЛМ;
Ч2 — количество процедур ТЛМ за год;
Ф — стоимость фармакогенетического исследования;
С4 — тариф на посещение врача-невролога;
Ч3 — количество посещений врача-невролога в год.
Анализ прямых немедицинских затрат не проводился, так как все включенные в исследование пациенты с документированным диагнозом эпилепсии находились под наблюдением в НЦ УК; прямые немедицинские затраты (транспортирование пациента в ЛПУ, спецодежда, питание и др.) считали одинаковыми для обеих групп. Непрямые затраты в данном исследовании не изучались.
Статистическая обработка данных выполнена с помощью программы Statistica v. 6.1 (StatSoft, США). Для сравнения и оценки выявленных различий использовался непараметрический критерий хи-квадрат Пирсона (χ2) с процедурой попарного сравнения (Мараскуило). Различия расценивали как статистически значимые при p < 0,05. Расчет отношения шансов (ОШ) проведен по формуле:
ОШ = (a/c)/(b/d) = a × d/b × c.
ОШ > 1 свидетельствовало о прямой связи фактора с вероятностью наступления исхода, ОШ < 1 — об обратной связи.
РЕЗУЛЬТАТЫ
Анализ потребления противоэпилептических препаратов в Красноярском крае
Потребление ПЭП в исследуемый период находилось в среднем на уровне 662 DDDs/1000 льготополучателей в день. В 2011 г. этот показатель составлял 675,52 DDDs/1000 льготополучателей в день, в 2012 г. он повысился до 710,27, а в 2013 и 2014 гг. снизился и составил 623,43 и 638,59 DDDs/1000 льготополучателей в день соответственно, т. е. 92% и 94% от уровня потребления 2011 г.
Группу DU-90% в 2011 и в 2012 гг. представляли препараты ВК, бензобарбитала и карбамазепина (КМЗ), а с 2013 г. в число наиболее потребляемых ПЭП вошел также топирамат. Уровень потребления ВК в 2011–2014 гг. был самым высоким и превышал 40% от суммарного потребления ПЭП (рис. 1).
Рис. 1. Структура потребления противоэпилептических препаратов в Красноярском крае (2011–2014 гг.), %
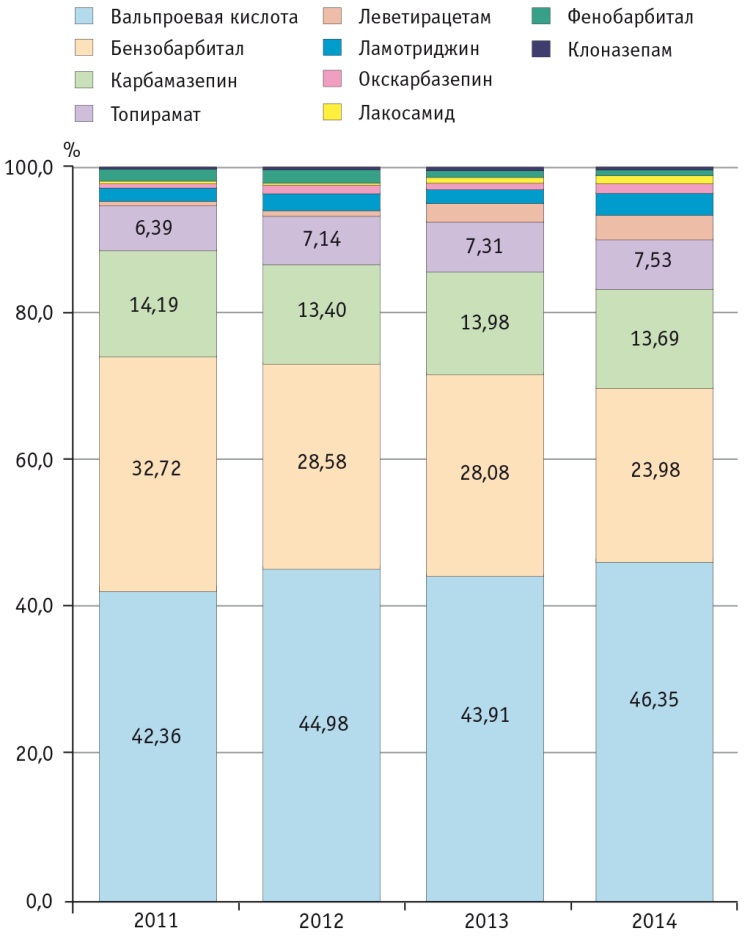
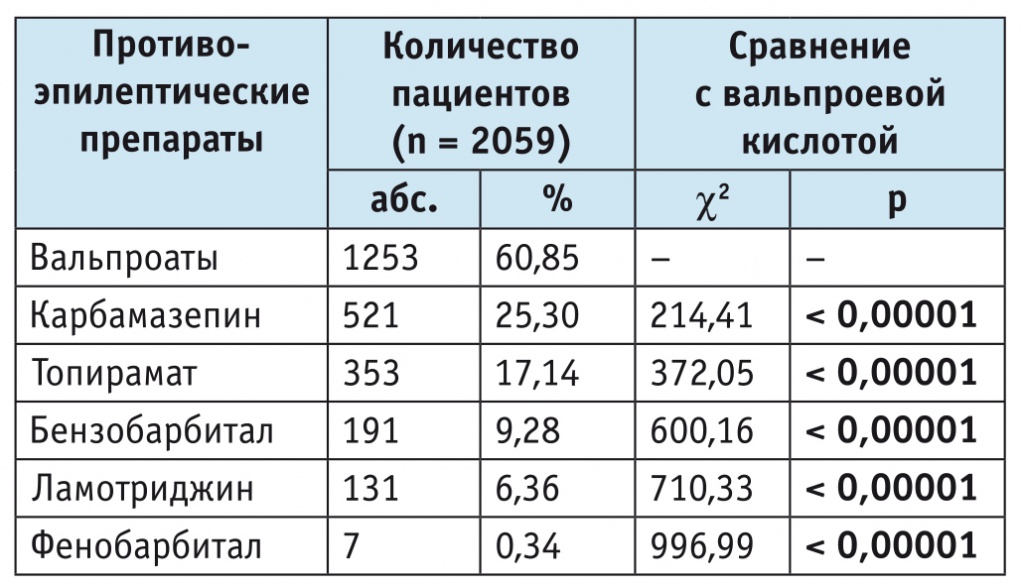
Частота назначения препаратов ВК в Красноярском крае была статистически значимо (р < 0,05) выше этого показателя по другим ПЭП и составляла 60,85% (табл. 1).
Таблица 1
Частота назначения противоэпилептических препаратов в Красноярском крае
В стоимостном выражении в 2011 г. наибольшие продажи отмечались по препаратам ВК (35,13%), КМЗ (22,05%) и фенобарбитала (13,55%), а в 2015 г. доминировали продажи препаратов прегабалина (40,56%), ВК (21,59%) и КМЗ (8,34%). В натуральном выражении в 2011 г. наибольшие продажи отмечались в отношении КМЗ (32,13%), бензобарбитала (28,20%) и фенобарбитала (17,89%), а в 2015 г. — КМЗ (31,24%), прегабалина (20,86%) и ВК (14,73%).
Таким образом, ВК являлся как лидером потребления, так и лидером продаж ПЭП на территории Красноярского края в анализируемые годы, поэтому поиск технологий применения ВК, обеспечивающих повышение эффективности и безопасности лечения эпилепсии, представляет собой актуальную задачу реальной клинической практики.
Частота и структура вальпроатиндуцированных нежелательных побочных реакций
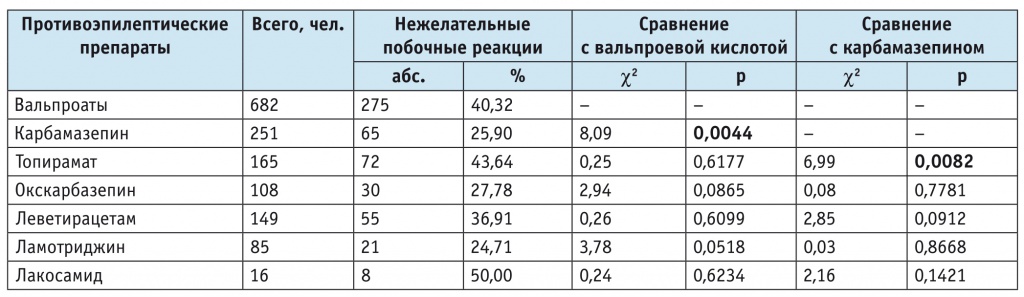
В зависимости от ПЭП частота развития НПР варьировала от 24,71% до 50,00% (табл. 2). Сравнение частоты развития НПР препаратов ВК и других ПЭП не выявило статистически значимых различий, за исключением более редкой регистрации НПР при применении КМЗ, чем при использовании ВК (25,90% против 40,32%; р < 0,05). При сравнении частоты развития НПР препаратов КМЗ и других ПЭП статистически значимого преимущества последних в части безопасности их применения не обнаружено, а частота топираматиндуцированных НПР была статистически значимо выше (43,64% против 25,90%; р < 0,05).
Таблица 2
Частота регистрации нежелательных побочных реакций противоэпилептических препаратов
Из ВК-индуцированных НПР 98,55% (n = 271) относились к типу A, 1,09% (n = 3) — к типу B. В одном случае (0,36%) была зарегистрирована НПР типа D — врожденный порок развития у ребенка, рожденного матерью, принимавшей ВК во время беременности. Причинно-следственная связь между приемом ВК и развитием НПР оценивалась как «вероятная» (208/275; 75,64%), «возможная» (52/275; 18,91%), «определенная» (15/275; 5,45%). Наибольшая частота развития выявлена для НПР со стороны желудочно-кишечного тракта — 15,25%: обнаружены гастро-/гепатопатия (68/682; 9,97%), диспепсия (15/682; 2,20%), повышение аппетита (21/682; 3,08%). НПР со стороны ЦНС отмечены у 15,10% пациентов, их структуру составили: энцефалопатия (36/682; 5,28%), аггравация приступов (35/682; 5,13%), когнитивные нарушения (22/682; 3,23%), сонливость (10/682; 1,47%), тремор кистей рук (51/682; 7,48%), НПР со стороны психоэмоциональной сферы — раздражительность, агрессия (12/682; 1,76%) и эмоциональные расстройства, депрессия (9/682; 1,32%).
Сравнительный анализ безопасности лечения препаратами вальпроевой кислоты, назначенными на основе персонализированного подхода и по стандартной схеме.
Проведен анализ безопасности лечения в случайной выборке из 263 пациентов, страдающих эпилепсией и получающих ВК в виде монотерапии или в составе комбинированного медикаментозного лечения в дозе не более 1250 мг/сут. Пациенты были распределены на основную и контрольную группы без статистически значимых межгрупповых различий (р > 0,05). Контрольную группу составили 96 пациентов, которым препараты ВК назначались по стандартной схеме — без проведения ТЛМ и фармакогенетического тестирования; все они имели ВК-индуцированные НПР, коррекция дозы ВК выполнялась эмпирически. В основную группу вошли 167 пациентов. Участникам этой группы были проведены определение носительства ОНП CYP2C9*2 и CYP2C9*3, ТЛМ ВК, оценка НПР. В зависимости от наличия или отсутствия НПР основную группу разделили на две подгруппы: в первой подгруппе (n = 99; 59,3%) были выявлены НПР на фоне приема ВК; во второй (n = 68; 40,7%) НПР не регистрировались. В обеих подгруппах в случае развития НПР, обнаружения токсических концентраций ВК в крови проводили снижение дозы ВК, скорость ее титрования зависела от выявленных ОНП гена CYP2C9.
Установлено, что среди 99 пациентов основной группы с ВК-индуцированными НПР (подгруппа 1) медленные метаболизаторы встречаются статистически значимо чаще, чем экстенсивные (62,63% и 37,37% соответственно; р < 0,05), и количество пациентов с токсическими концентрациями ВК в крови выше количества пациентов с концентрациями ВК в рамках терапевтического коридора (64,65% и 35,35%; р < 0,05). У больных без НПР (подгруппа 2) токсические концентрации ВК в крови регистрировались статистически значимо реже, чем у пациентов с НПР (23,53% и 64,65% соответственно; р < 0,05). Частота встречаемости медленных метаболизаторов во второй подгруппе составила 32,35% против 62,63% в первой подгруппе (р < 0,05). Расчет ОШ продемонстрировал, что как наличие токсической концентрации ВК в крови пациента, так и отнесение пациента к группе медленных метаболизаторов по носительству СYР2С9*2 и/или СYР2С9*3 имеет прямую ассоциативную связь с вероятностью развития НПР: ОШ = 5,94 и 4,27 соответственно.
Частота проведения ТЛМ зависела от типа метаболизма: в группе экстенсивных метаболизаторов (CYP2C9*1/*1) ТЛМ ВК проводился 2 раза в год, в группе медленных метаболизаторов (CYP2C9*1/*2 или CYP2C9*1/*3) — 4 раза в год, в группе сверхмедленных метаболизаторов (CYP2C9*2/*2, CYP2C9*3/*3, CYP2C9*2/*3) — 6 раз в год. На основании полученных результатов выполняли коррекцию суточной дозы ВК: сокращение при развитии токсических концентраций, снижение темпа наращивания у медленных метаболизаторов. Подбор доз ВК на основании данных ТЛМ привел к тому, что у экстенсивных метаболизаторов средняя доза ВК составила 1250 ± 105 мг/сут., у медленных метаболизаторов — 900 ± 84 мг/сут., у сверхмедленных метаболизаторов — 600 ± 55 мг/сут. В контрольной группе все пациенты получали ВК в среднем в дозе 1250 ± 124 мг/сут.
Оценка частоты регистрации НПР у пациентов основной группы (персонализированный подбор дозы) показала, что доля пациентов с НПР сократилась с 59,28% (99/167) до 10,78% (18/167). Это статистически значимо ниже (χ2 = 16,78; р < 0,05), чем в контрольной группе, где при эмпирической тактике дозирования ВК доля пациентов с НПР снизилась со 100% (96/96) до 37,50% (36/96).
Полученные данные о более высокой безопасности тактики ведения пациентов с эпилепсией, основанной на результатах фармакогенетического тестирования и ТЛМ, явились основанием для разработки в НЦ УК алгоритма персонализированного назначения препаратов ВК.
Фармакоэкономическая оценка алгоритма назначения препаратов вальпроевой кислоты на основе персонализированного подхода в сравнении с традиционным ведением.
Фармакоэкономическая оценка тактики ведения пациентов с учетом данных фармакогенетического тестирования выполнена методом построения модели «древо решений» (рис. 2). Расходы, связанные с оказанием медицинской помощи, учитывавшиеся при расчете прямых медицинских затрат, представлены в таблице 3. Затраты на приобретение ВК для проведения лечения в течение одного года и стоимость дополнительной терапии, назначенной в связи с развитием НПР на фоне основной противоэпилептической терапии, оценивали на основании данных интернет-ресурса «Фарминдекс.рф»[15]. Тарифы на одно посещение врача-невролога, на определение концентрации ВК в плазме крови и носительства ОНП CYP2C9*2 и CYP2C9*3 были взяты из прайса ЦНИЛ КрасГМУ им. проф. В.Ф. Войно-Ясенецкого на 2017 г. Как отмечено ранее, прямые немедицинские затраты не анализировались и считались одинаковыми для обеих групп.
Рис. 3. Древо решений для фармакоэкономической оценки персонализированного и традиционного ведения пациентов с эпилепсией в Красноярском крае.
Примечание. НПР — нежелательные побочные реакции
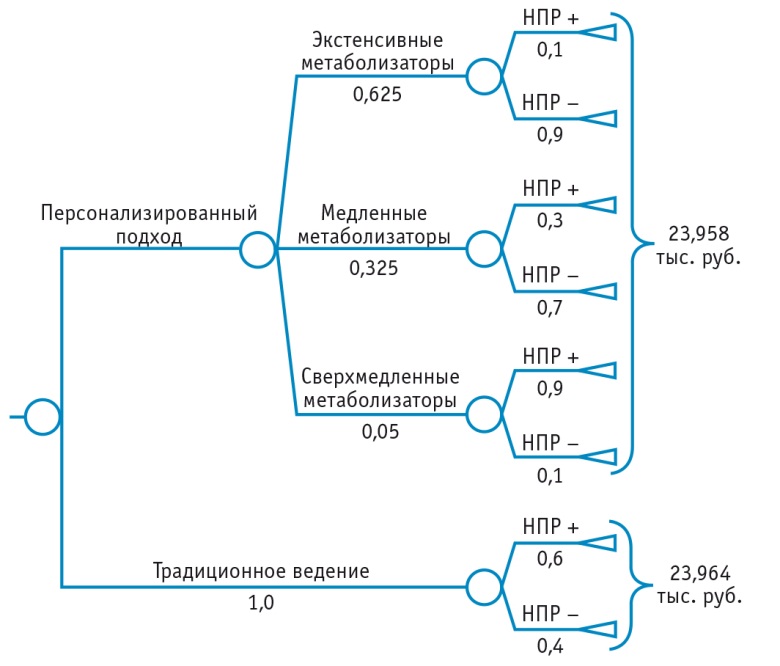
Таблица 3
Прямые медицинские затраты при персонализированном и традиционном ведении больных эпилепсией
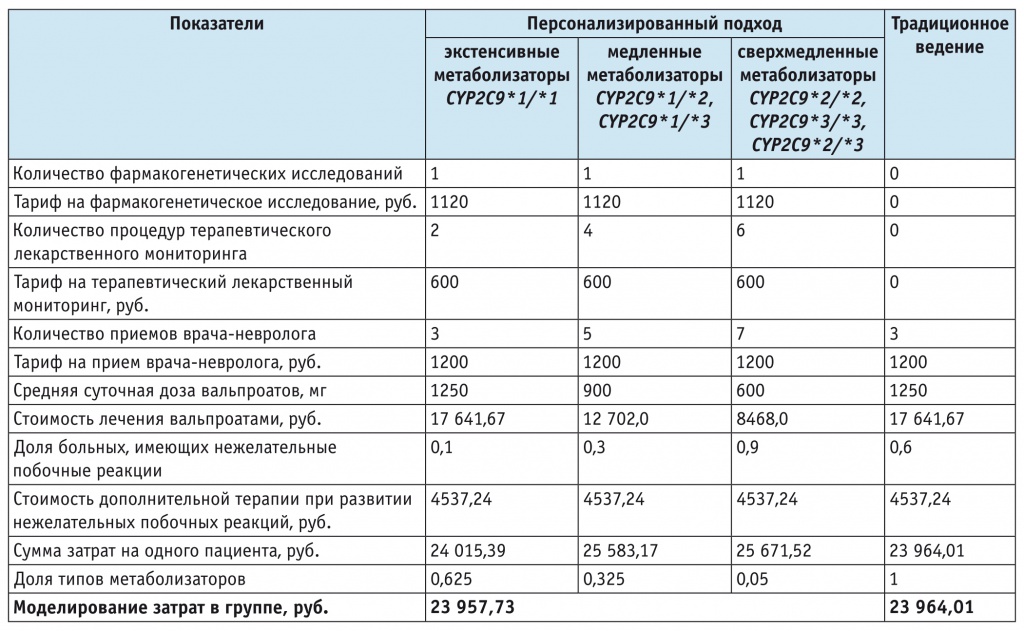
Обнаружено, что уровень прямых медицинских затрат в случае персонализированного подхода не выше аналогичного показателя при традиционном ведении и даже несколько ниже его (см. табл. 3): прямые затраты в основной группе составили 99,97% от таковых в группе контроля. Персонализированный подход к назначению ВК статистически значимо (p < 0,05) снижает риск развития НПР со стороны различных органов и систем у всех пациентов, в том числе у больных с неблагоприятным фармакогенетическим профилем (медленных метаболизаторов), что показано в предыдущем разделе. А это, в свою очередь, является важным фактором повышения безопасности фармакотерапии эпилепсии.
Таким образом, в настоящем исследовании впервые проведена клинико-экономическая оценка персонализированного и традиционного подхода к лечению эпилепсии у больных, проживающих на территории Красноярского края. При помощи методов математического моделирования рассчитана суммарная стоимость прямых медицинских затрат при традиционном ведении больных и при персонализированном ведении с учетом таких показателей, как фармакогенетический профиль пациента по результатам определения носительства полиморфных аллельных вариантов CYP2C9*2 и CYP2C9*3 и частота развития НПР. В результате анализа выявлено, что внедрение персонализированного подхода к терапии эпилепсии фармакоэкономически обоснованно, так как не приводит к увеличению прямых затрат.
ЗАКЛЮЧЕНИЕ
За последнее десятилетие на рынках России и мира появились новые противоэпилептические препараты (ПЭП), позиционируемые производителями как более эффективные и безопасные по сравнению со «старыми» препаратами. «Точечный» механизм действия этих ПЭП действительно предполагает отсутствие нежелательных побочных реакций (НПР) со стороны различных органов и систем, которые характерны для «старых» ПЭП. Но вопрос об их безопасности остается открытым и требует дальнейшего изучения, так как реальную частоту проявления ряда НПР можно оценить только на фоне длительного применения в клинической практике[13]. Проведенный нами анализ частоты развития НПР свидетельствует о сравнимом профиле безопасности препаратов вальпроевой кислоты (ВК) и более новых ПЭП.
При изучении потребления ПЭП в Красноярском крае подтверждено наиболее широкое применение препаратов ВК. Терапия ВК более управляема, так как в настоящее время в широкой клинической практике возможно проведение терапевтического лекарственного мониторинга. При этом доказана зависимость уровня ВК в крови и частоты развития НПР от носительства однонуклеотидных полиморфизмов гена CYP2C9. Сравнительный анализ безопасности лечения препаратами ВК, назначенными на основе стандартной схемы и персонализированного подхода, показал преимущества последнего.
Наше исследование дополняет ранее выполненные работы и позволяет модифицировать тактику фармакотерапии эпилепсии препаратами ВК для существенного повышения безопасности противоэпилептической терапии в рамках деятельности как специализированного противоэпилептического центра, так и многопрофильных стационаров и поликлиник.








