ВВЕДЕНИЕ
Дифференциальная диагностика детских заболеваний, клиническая картина которых включает судорожный синдром, является одной из наиболее актуальных проблем педиатрии[1].
Согласно современным представлениям, судорожный синдром определяется как неспецифическая реакция нервной системы на различные эндогенные или экзогенные факторы, проявляющаяся повторяющимися внезапными непроизвольными сокращениями скелетных мышц или их эквивалентами (вздрагиваниями, подергиваниями, непроизвольными движениями, тремором и т. д.) и часто сопровождающаяся нарушениями сознания[2].
Судорожный синдром может быть проявлением различных состояний, среди которых выделяют эпилепсию и заболевания, не имеющие эпилептической природы. Такое деление непроизвольно повышает настороженность врача в отношении эпилепсии. Однако необходимо помнить, что это не единственная причина судорожных приступов. Их могут вызывать состояния различной этиологии и патогенеза, что требует реализации разных подходов в рамках диагностического поиска, а также в лечении. В связи с этим необходимо более детальное рассмотрение судорожного синдрома, не связанного с эпилепсией[1, 2].
КЛИНИЧЕСКОЕ НАБЛЮДЕНИЕ
Пациент в возрасте 16 лет 25 апреля 2016 года поступил на обследование в психоневрологическое отделение Университетской детской клинической больницы Сеченовского Университета.
Анамнез. Согласно медицинской документации, мальчик был рожден в асфиксии (5/6 баллов по шкале Апгар), с большой массой тела (4000 г). У невролога по месту жительства он наблюдался с 13 лет с диагнозом минимальной мозговой дисфункции в связи с особенностями формирования эмоционально-волевой сферы и замедленными темпами познавательной деятельности. При проведении компьютерной томографии (КТ) в 13 лет отмечались умеренно выраженные изменения больших полушарий головного мозга, расцененные как постгипоксические.
Судорожный приступ впервые развился у юноши в возрасте 16 лет во время урока физкультуры в техникуме: остро возникли слабость, дистоническая установка правой руки, нарушение сознания с падением, тонико-клоническими судорогами длительностью около минуты, а также ретроградной амнезией.
Пациент был срочно госпитализирован с гликемией 4,2 ммоль/л. При выполнении КТ выявлено полифокальное поражение вещества головного мозга.
С целью уточнения диагноза проведена магнитно-резонансная томография (МРТ), описаны очаговые изменения в проекции подкорковых ядер.
По результатам электроэнцефалографии (ЭЭГ), определена мультифокальная эпилептиформная активность в центральной и затылочной областях слева и теменной области справа с диффузным распространением.
Таким образом, на основании результатов обследования диагностирована эпилепсия, и назначена противоэпилептическая терапия — леветирацетам в стартовой дозе 1000 мг 2 раза в сутки.
Ввиду сочетания гипопигментации на груди по типу «брызг» с неврологическими изменениями заподозрены гипомеланоз Ито и синдром Блоха — Сульцбергера, однако в ходе консультации генетика они сочтены маловероятными.
До описанного приступа пациента неоднократно осматривал эндокринолог, он отмечал клинически незначимое пограничное повышение содержания тиреотропного гормона (ТТГ).
При обследовании по поводу приступа юноше рекомендовано повторное обращение к эндокринологу, так как выявленные на МРТ изменения головного мозга могли быть следствием нарушений кальций-фосфорного обмена (синдрома Фара).
После выписки из неврологического стационара проведено лабораторное исследование — выявлено изменение показателей кальций-фосфорного обмена: уровень кальция общего — 1,61 ммоль/л (референсный диапазон (РД) — 2,08–2,65 ммоль/л), фосфора — 2,90 ммоль/л (РД — 0,81–1,45 ммоль/л), а также повышение уровня паратгормона (ПТГ) до 200 пг/мг (РД — 12–97 пг/мг), но к эндокринологу пациент не обратился.
Через 3 месяца от момента приступа больной поступил на обследование в психоневрологическое отделение Университетской детской клинической больницы Сеченовского Университета. В связи с аномальными показателями кальций-фосфорного обмена пациента также осмотрел эндокринолог.
Физикальная диагностика
Соматический статус. При осмотре обращали на себя внимание грубые черты лица. Рост (167 см) и масса тела (62 кг) соответствовали нормальным значениям. Кожные покровы бледные, обычной температуры и влажности, отмечены элементы гипопигментации на груди. Какие-либо клинически значимые особенности при осмотре органов дыхания, кровообращения, пищеварения и мочевыделения не выявлены.
Психоневрологический статус. Пациент был в ясном сознании, правильно ориентирован в месте и во времени. Темп психомоторной деятельности замедлен, сложилось впечатление некоторого эмоционального обеднения. Интеллект сохранен. Речь замедленная с носовым оттенком. Глотание не нарушено. Вызывались рефлексы орального автоматизма. Отмечался легкий альтернирующий сходящийся страбизм. Мышечный тонус ближе к физиологическому, однако замечено недоразгибание бедренных, локтевых и коленных суставов по типу позовой установки, что формирует специфическую осанку по типу «тройного сгибания». Сухожильные рефлексы высокие, с легким акцентом справа, клоноид стоп, гиперкинезы кистей рук в позе Ромберга, адиадохокинез справа, дисметрия при выполнении координаторных проб справа.
Эндокринологический статус. Щитовидная железа визуально и пальпаторно не увеличена, плотноватой консистенции, объемные образования не пальпировались, клинически — эутиреоз, частота сердечных сокращений — 75 в минуту. Нарушения функции надпочечников не выявлены: гипертрихоза и гиперпигментации не было, артериальное давление — 125/70 мм рт. ст. Половые органы сформированы по мужскому типу правильно. Половое развитие по Таннеру 4, тестикулы в мошонке, по 25 мл (соответствовало возрастной норме и стадии полового созревания).
При осмотре обнаружен положительный симптом Хвостека (непроизвольное подергивание лицевых мышц при постукивании по ходу лицевого нерва).
Предварительный диагноз
Клинические проявления (судороги в анамнезе, симптом Хвостека и гиперкинезы при осмотре) и обнаруженные перед госпитализацией нарушения кальций-фосфорного обмена (выраженные гипокальциемия и гиперфосфатемия) позволили предположить, что причиной судорог могла стать гипокальциемия. Из-за ранее отмеченного повышения уровня ПТГ при низком содержании кальция и высоком уровне фосфора в крови было заподозрено нарушение чувствительности к ПТГ — псевдогипопаратиреоз.
С учетом данных ЭЭГ (эпилептических изменений) и МРТ (поражения вещества головного мозга — синдрома Фара) выдвинуто предположение, что эпилепсия носит вторичный характер.
Динамика и исход
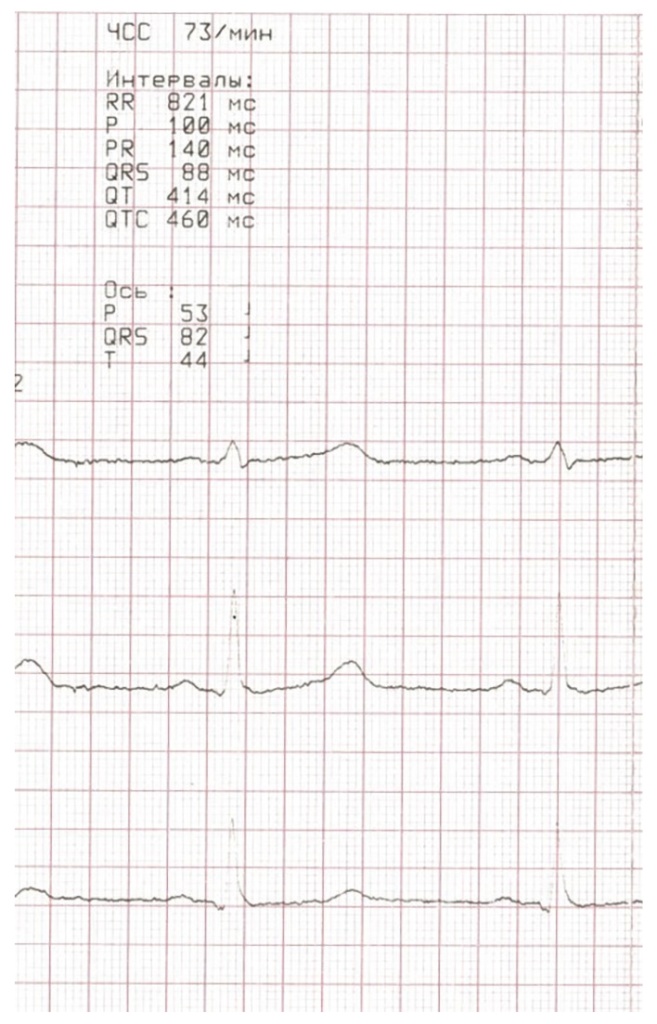
Результаты обследования. При биохимическом и гормональном исследовании найдены выраженная гипокальциемия, гиперфосфатемия, повышение уровня ПТГ, снижение содержания 25-ОН (витамина D) при нормальных уровнях общего белка, альбумина, креатинина. Нарушения секреции тропных гормонов гипофиза и гормонов щитовидной железы отсутствовали (табл. 1).
Таблица 1. Результаты лабораторного обследования пациента до установления диагноза
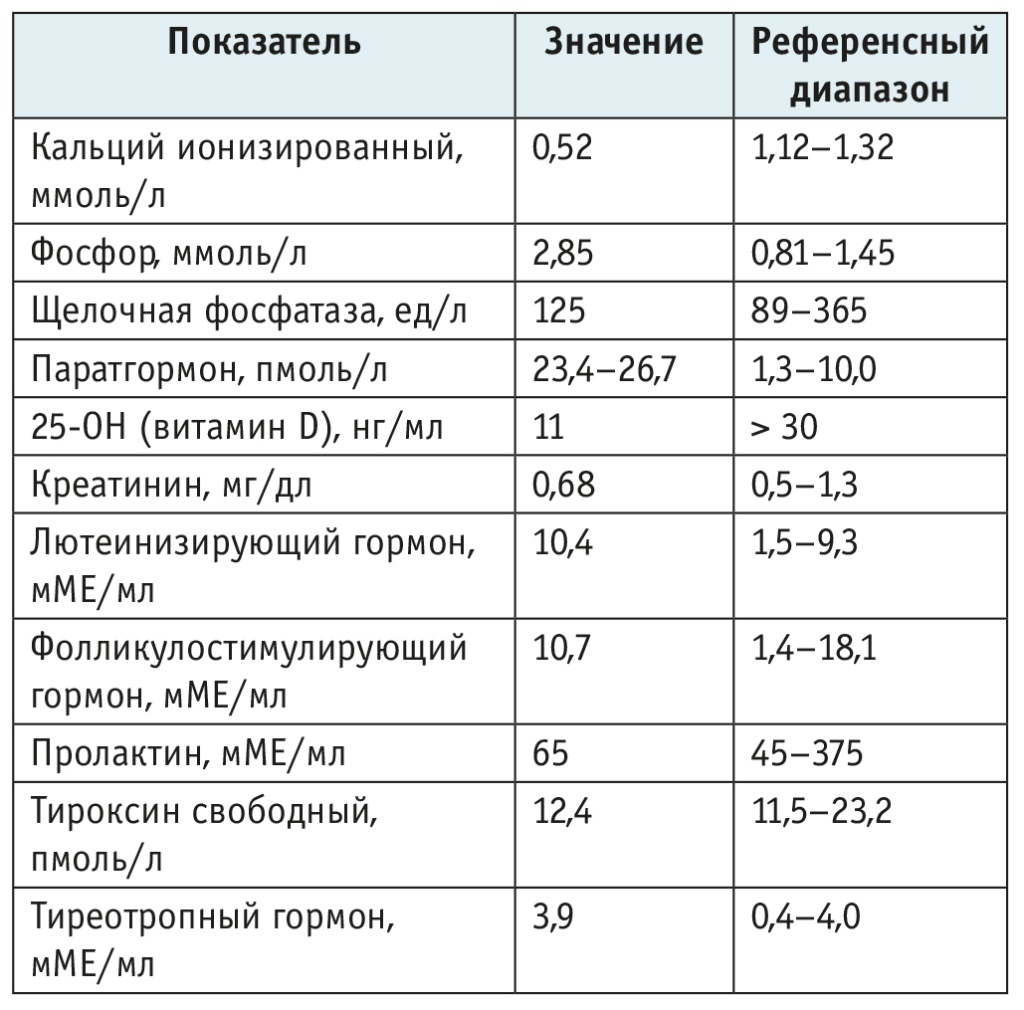
При электрокардиографии (ЭКГ) обращало на себя внимание значительное удлинение электрической систолы желудочков (интервала QT), типичное для гипокальциемии (рис. 1).
Рис. 1. Электрокардиограмма (ЭКГ) пациента до установления диагноза. Описание ЭКГ: синусовый ритм; вертикальное положение электрической оси сердца; значительно удлинена электрическая систола желудочков (QT — 414 мс); частота сердечных сокращений — 72–81 уд/мин. Здесь и далее иллюстрации авторов
При проведении рентгенографии органов грудной клетки, ультразвукового исследования (УЗИ) органов брюшной полости и осмотре окулиста признаки эктопической кальцификации не обнаружены.
Клинический диагноз: Псевдогипопаратиреоз типа 1Б, гипокальциемия, гиперфосфатемия. Синдром Фара. Симптоматическая фокальная эпилепсия.
Лечение. После выявления выраженной гипокальциемии пациент переведен в детское эндокринологическое отделение, где под контролем уровней электролитов 2 дня проводилась инфузионная терапия глюконатом кальция, была начата терапия альфакальцидолом в дозе 0,5 мг в сутки с постепенным увеличением дозы до 2 мг в сутки (табл. 2).
Таблица 2. Результаты лабораторного обследования пациента на фоне проводимой терапии и дозы альфакальцидола
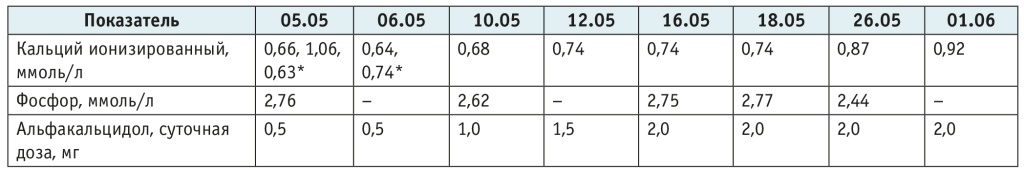
* Колебания уровня кальция в течение суток на фоне введения глюконата кальция.
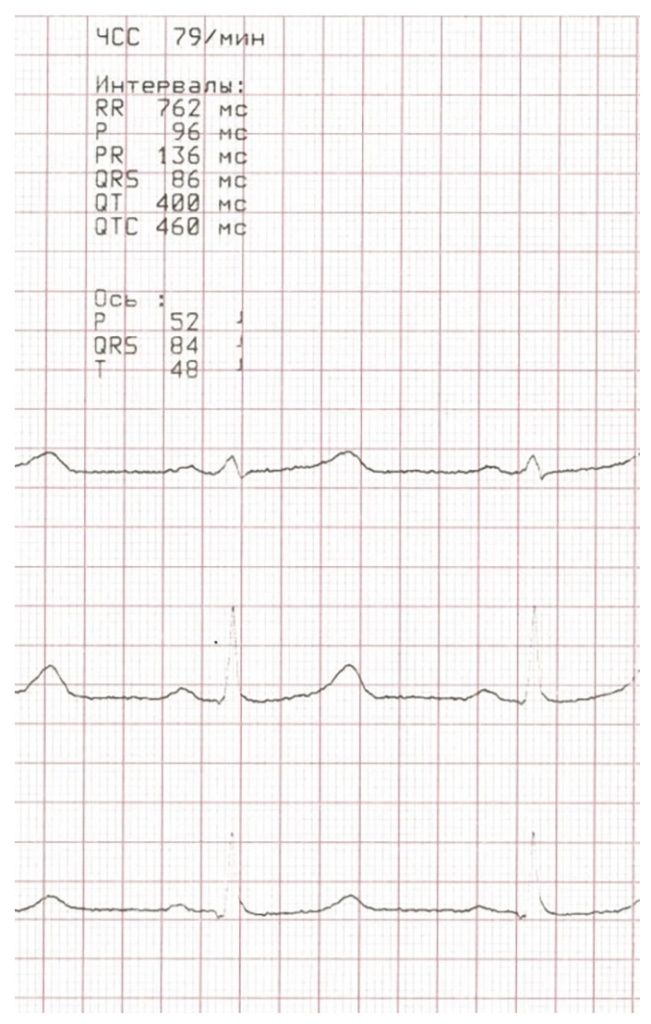
При повторном проведении ЭКГ через 5 дней после начала терапии отмечена нормализация интервала QT (рис. 2).
Рис. 2. Электрокардиограмма (ЭКГ) пациента через 5 дней после начала терапии. Описание ЭКГ: синусовый ритм; вертикальное положение электрической оси сердца; частота сердечных сокращений — 79 уд/мин. Несмотря на сохранявшуюся гипокальциемию на фоне постепенного увеличения дозы альфакальцидола (0,68 ммоль/л), на этой ЭКГ наблюдалась нормализация интервала QT (400 мс)
Исход. Пациент выписан из отделения в июне 2016 г., через 25 дней от начала терапии, суточная доза альфакальцидола — 2 мг (табл. 3). В амбулаторных условиях он ежемесячно контролировал уровни ионизированного кальция и фосфора. В течение 2016 г. дозу альфакальцидола продолжали увеличивать до 2,5 мг. Затем, после достижения целевых значений кальция и фосфора отмечено постепенное снижение потребности в препарате — в течение 2017 г. дозу снизили до 0,5 мг. В 2018–2020 гг. на фоне приема 0,5 мг альфакальцидола показатели кальций-фосфорного обмена соответствовали целевым значениям (рекомендовано поддержание уровня кальция крови на нижней границе нормы или чуть ниже для профилактики нефрокальциноза, а уровня неорганического фосфора — в пределах возрастной нормы для профилактики отложения кальций-фосфатных комплексов в мягких тканях[3])1. В начале 2021 г. в связи с тенденцией к гипокальциемии и гиперфосфатемии доза была увеличена до 0,75 мг, а с начала 2022 г. — до 1 мг (см. табл. 3).
Таблица 3. Результаты лабораторного обследования пациента на фоне амбулаторно проводимой терапии и дозы альфакальцидола
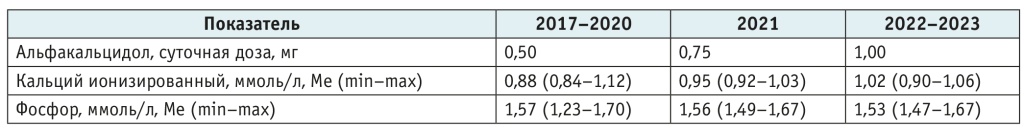
В течение всего периода наблюдения 1–2 раза в год проводилось исследование показателей гормонов щитовидной железы. Уровень свободного тироксина всегда оставался в пределах нормальных значений, уровень ТТГ колебался от 3,9 до 7,0 мМЕ/мл. УЗИ щитовидной железы — без значимой патологии. При осмотре окулиста и проведении УЗИ почек эктопические кальцинаты не выявлялись.
Пациент продолжает наблюдаться у эпилептолога. Приступы не повторялись, эпилептиформная активность при проведении ЭЭГ не регистрировалось, доза леветирацетама была постепенно снижена до 1000 мг в сутки. Однако при попытке уменьшить дозу до 500 мг возобновились ночные эпизоды оральных автоматизмов, отмечены изменения на ЭЭГ, в связи с чем возвращена доза 1000 мг в сутки.
ОБСУЖДЕНИЕ
Причинами развития судорог у детей могут быть различные заболевания, в связи с чем судорожный синдром нельзя рассматривать как маркер какой-либо конкретной болезни. Именно поэтому в современной классификации судорожные состояния у детей разделены на группы в зависимости от причины их появления[1].
Выделяют эпилептические и неэпилептические судорожные состояния. Неэпилептические судорожные пароксизмальные состояния включают судороги, обусловленные неспецифической реакцией головного мозга на различные повреждающие факторы, т. е. острые симптоматические приступы (фебрильные, интоксикационные, гипоксические, аффективно-респираторные пароксизмы, обменные и метаболические, при вегетативных нарушениях, кардиальные синкопе и т. д.), а также симптоматические судороги при заболеваниях головного мозга (опухолях, абсцессах, кровоизлияниях, ишемических инсультах, аневризмах сосудов головного мозга и пр.)[1].
Фебрильные судороги регистрируют у детей наиболее часто. Критериями данного вида судорог являются зависимость от возраста (от 5–6 месяцев до 5–6 лет), связь с лихорадкой, отсутствие на момент появления судорог инфекционного процесса в центральной нервной системе больного, каких-либо иных возможных причин развития судорог, а также аналогичных приступов, не ассоциированных с лихорадкой[4, 5].
Аффективно-респираторные приступы также относятся к наиболее распространенным в детском возрасте. Их причиной в настоящее время считается нарушение регуляции со стороны вегетативной нервной системы. Приступы «синего» типа провоцируются отрицательными эмоциями, начинаются с проявления ребенком своего недовольства продолжительным криком, на высоте возбуждения возникает апноэ, иногда — клонические или тонико-клонические судороги, после приступа — явления слабости, сонливости.
Приступы «белого» типа являются следствием рефлекторной асистолии, наиболее часто провоцируются болевым воздействием, начинаются с бледности кожных покровов с последующей потерей сознания, могут отмечаться тонические или тонико-клонические судороги, после приступа ребенок часто засыпает, а после пробуждения демонстрирует нормальную жизненную активность. Возрастной пик манифестации наблюдается в возрасте от 6 до 12–18 месяцев, хотя в литературе описаны отдельные случаи появления аффективно-респираторных приступов у детей 6–7 лет[1, 2, 6].
Клиническая картина и возраст пациента на момент манифестации заболевания позволили исключить наиболее распространенные у детей причины судорожного синдрома — фебрильные и аффективно-респираторные приступы. Для уточнения метаболических причин развившегося состояния потребовались лабораторные исследования.
Метаболические судороги могут манифестировать в любом возрасте, в том числе в детстве. Наиболее типичными метаболическими причинами судорог являются гипогликемия и гипокальциемия. Именно поэтому определение уровней кальция и глюкозы в крови должно быть рекомендовано всем пациентам с впервые возникшим судорожным синдромом[1, 2, 7–9].
Повторные гипогликемические состояния могут приводить к поражению головного мозга, а персистирующая гипо- и гиперкальциемия — к отложению солей кальция, что, в свою очередь, может служить причиной развития симптоматической эпилепсии, как описано в нашем случае, и требовать самостоятельной противосудорожной терапии[1, 7–9].
Гипогликемические судороги чаще возникают у детей младшего возраста. Идиопатическая кетотическая гипогликемия может наблюдаться у детей на фоне снижения частоты их кормления и, как правило, самостоятельно проходит к 8–9 годам жизни ребенка. Факторы, провоцирующие развитие гипогликемического синдрома, — инфекционные заболевания, сопровождающиеся гипертермией, ночное голодание, а также выраженные физические нагрузки[8].
Причинами гипогликемии у детей также могут быть различные врожденные состояния — врожденный гиперинсулинизм, гипопитуитаризм, ферментопатии, для которых типична манифестация в младшем возрасте[7, 8].
Следует отметить, что в описываемом случае у пациента при поступлении в стационар определили концентрацию глюкозы в плазме крови (она составила 4,2 ммоль/л), что позволило исключить гипогликемию. Исследование концентрации кальция в крови при поступлении в стационар не проводилось, что стало причиной позднего выявления гипокальциемии.
Гипокальциемические судороги обусловлены снижением концентрации ионов кальция в крови. В неонатальном периоде гипокальциемия может объясняться физиологическими причинами (например, физиологической послеродовой гипокальциемией раннего неонатального периода).
Гипопаратиреоз является наиболее частой патологической причиной гипокальциемии. Врожденный гипопаратиреоз может быть изолированным или входить в наследственные синдромы, такие как синдромы Ди Джорджи, Кенни — Каффи, Киари, Бараката и др. В более старшем возрасте гипопаратиреоз может развиться после удаления паращитовидных желез или в рамках симптомокомплекса редких наследственных заболеваний — например, аутоиммунного полигландулярного синдрома 1-го типа, гемосидероза, митохондриальной миопатии, синдрома Коновалова — Вильсона и др.
Другими причинами гипокальциемии могут служить периферическая резистентность к ПТГ (псевдогипопаратиреоз), синдром распада опухоли, рабдомиолиз, острый панкреатит, заменное переливание крови, алкалоз, прием отдельных медикаментов (фуросемида, кальцитонина), избыточное введение фосфатов[8, 9].
Для гипопаратиреоза характерны так называемые тетанические судороги. Они могут быть генерализованными или односторонними, а также способны охватывать лишь отдельные мышечные группы (преимущественно мышцы-сгибатели конечностей, чаще верхних). Приступы тетании начинаются с парестезии, фибриллярных подергиваний мышц, переходящих затем в тонические судороги, которые иногда сопровождаются миалгиями. Во время приступа наблюдаются характерные изменения: «сардоническая улыбка», «рыбий рот», «рука акушера», «конская стопа». Наиболее опасными являются, разумеется, судороги дыхательных мышц (в том числе диафрагмы), следствием которых может стать асфиксия. Вследствие спазмов мышц желудочно-кишечного тракта возникают нарушения глотания, рвота. Сознание на протяжении приступа, как правило, сохранено[3, 8, 9]2.
Диагноз гипопаратиреоза основывается на данных анамнеза (судорожные приступы с зафиксированной гипокальциемией; наличие заболеваний, в рамках которых может развиться гипопаратиреоз (например, предшествующие операции на щитовидной и паращитовидных железах, аутоиммунный полиэндокринный синдром 1-го типа и др.), клинической картине (положительные симптомы Хвостека и Труссо, характерные для гипокальциемии), удлинении интервала QT на ЭКГ и на результатах лабораторных исследований (гипокальциемия, низкий уровень ПТГ)[3, 8, 9]3.
При подобной клинической картине в сочетании с гипокальциемией, но повышенным уровнем ПТГ следует заподозрить резистентность к ПТГ — псевдогипопаратиреоз[3, 8, 9]4.
В описываемом клиническом случае диагноз псевдогипопаратиреоза был установлен на основании выявленных при биохимическом и гормональном исследовании выраженной гипокальциемии, гиперфосфатемии, повышении уровня ПТГ. Пациент имел классические клинические проявления гипокальциемии — положительный симптом Хвостека, удлинение интервала QT.
Псевдогипопаратиреоз представляет собой гетерогенную группу врожденных заболеваний с клинико-лабораторными признаками недостаточности паращитовидных желез (гипокальциемией, гиперфосфатемией, повышенной судорожной готовностью) на фоне увеличенного или нормального уровня ПТГ и нечувствительности периферических тканей к его действию. В ряде случаев псевдогипопаратиреоз может ассоциироваться со специфическим фенотипом и с различной степенью нечувствительности к другим пептидным гормонам. Выделяют псевдогипопаратиреоз типа 1 (нечувствительность органов-мишеней к ПТГ, зависимая от аденилатциклазы) и типа 2 (нечувствительность органов-мишеней к ПТГ, независимая от аденилатциклазы). Наиболее хорошо изучен псевдогипопаратиреоз типов 1А и 1В.
Псевдогипопаратиреоз типа 1А обусловлен инактивирующими мутациями в гене GNAS материнского аллеля, что приводит к нарушению передачи сигнала от рецептора ПТГ к ядру эффекторной клетки. Ключевую роль в развитии указанного нарушения играет α-субъединица G-белка (Gαs), связанная с рецептором ПТГ. В ряде тканей недостаточная активность Gαs не может обеспечить нормальную функцию рецептора ПТГ. Это приводит к формированию типичного фенотипа пациента, получившего название остеодистрофии Олбрайта. Она включает в себя брахидактилию в виде укорочения III, IV, V пястных костей и I дистальных фаланг, брахицефалию, гипоплазию зубов, низкорослость (ввиду дефицита Gαs в соматотропоцитах гипофиза и, как следствие, резистентности к соматолиберину), лунообразное лицо с уплощенной переносицей, крыловидные складки на шее, гиперпигментацию, ожирение, иногда умственную отсталость, проявляющуюся с ранних лет жизни. Отмечается также тенденция к формированию в мягких тканях множественных очагов подкожного обызвествления или оссификации[3, 8, 9]5.
Особого внимания заслуживает феномен так называемой мультигормональной резистентности, который может обнаруживаться у пациентов с псевдогипопаратиреозом типа 1А. Поскольку Gαs является посредником в передаче сигнала не только от ПТГ, но и от других гормонов, при угнетении его функции следует ожидать клинических проявлений соответствующей гормональной недостаточности. Так, например, при нарушении работы рецепторов гонадотропинов закономерно возникновение картины гипергонадотропного гипогонадизма, а при появлении резистентности к ТТГ — гипотиреоза[10, 11].
Диагностика псевдогипопаратиреоза типа 1А основана на выявлении характерного сочетания признаков остеодистрофии Олбрайта с резистентностью к ПТГ[3]6.
Псевдогипопаратиреоз типа 1В обусловлен полной потерей активности Gαs в клетках проксимальных почечных канальцев, следствием чего становится их резистентность к действию ПТГ. Эта форма заболевания характеризуется наличием типичных лабораторных признаков гипопаратиреоза (гипокальциемией, гиперфосфатемией, повышенной концентрацией ПТГ в сыворотке крови) при отсутствии фенотипических проявлений остеодистрофии Олбрайта. Интересно также отметить, что у нашего пациента обращала на себя внимание большая масса тела при рождении, что, согласно отечественным наблюдениям, характерно именно для этого варианта псевдогипопаратиреоза[10, 11].
Другие варианты псевдогипопаратиреоза менее изучены. Псевдогипопаратиреоз типа 1С имеет те же клинические и биохимические проявления, что и типа 1А, но Gαs утрачивает свою способность активировать циклический аденозинмонофосфат (цАМФ) только лишь рецептор-опосредованным путем; напрямую же — рецептор-независимым путем — активация цАМФ не утрачивается. Псевдогипопаратиреоз типа 2 имеет клинические проявления, схожие с 1В, но дефект локализуется ниже места образования цАМФ, возможно, на уровне протеинкиназы А или ее субстрата[10].
В описанном клиническом случае с учетом позднего начала заболевания (16 лет), отсутствия признаков остеодистрофии Олбрайта и иных характерных фенотипических черт наиболее вероятным диагнозом является псевдогипопаратиреоз типа 1B. Поздняя диагностика этого нарушения кальций-фосфорного обмена привела к формированию синдрома Фара, что стало причиной эпилепсии. Таким образом, судорожный синдром у данного пациента обусловлен сразу двумя причинами — гипокальциемией, которая была доказана лабораторно, и эпилепсией, что подтверждено ЭЭГ.
Лечение нашего больного должно включать как противоэпилептические лекарства, так и препараты для компенсации нарушений кальций-фосфорного обмена. При псевдогипопаратиреозе применяются активные формы витамина D, не требующие 1α-гидроксилирования в почках (альфакальцидол и кальцитриол). Применение этих препаратов не зависит от активности 1α-гидроксилазы, регулируемой ПТГ. Альфакальцидол превращается в 1,25(ОН)2D за одну метаболическую стадию с помощью печеночного фермента 25-гидроксилазы.
Назначать данный препарат рекомендуется при уровне ионизированного кальция в крови ниже 1 ммоль/л, начиная с минимальных доз, постепенно увеличивая их под контролем уровней кальция и фосфора. С целью профилактики нефрокальциноза и образования кальций-фосфатных комплексов в мягких тканях рекомендуется поддерживать уровень кальция на нижней границе РД, а фосфора — в рамках РД. После достижения целевых значений терапия продолжается в подобранной дозе, а содержание кальция и фосфора в плазме крови рекомендуется контролировать через каждые 3–5 недель[3]7.
В нашем случае у пациента в течение первого года лечения отмечалась высокая потребность в альфакальцидоле, затем было достигнуто насыщение, и дозу препарата снизили. Необходимо отметить, что, несмотря на целевые значения ионизированного кальция, даже при увеличении дозы альфакальцидола в течение всего периода терапии сохранялась тенденция к гиперфосфатемии (см. табл. 3).
Пациенту с псевдогипопаратиреозом требуется наблюдение нескольких специалистов, полный перечень которых определяется в зависимости от имеющихся симптомов и наличия осложнений. Так, помимо эндокринолога, наблюдение за пациентом с псевдогипопаратиреозом могут осуществлять офтальмолог (для регулярного обследования органов зрения) и нефролог (в случае выявления нефрокальциноза)[8, 9].
ЗАКЛЮЧЕНИЕ
Эффективность лечения судорожных состояний напрямую зависит от правильно установленного диагноза, в связи с чем крайне важно умение врача грамотно ориентироваться в дифференциальной диагностике состояний, одним из проявлений которых может являться судорожный синдром.
С учетом перечня наиболее часто встречающихся причин судорожных состояний у детей можно разработать рациональную схему диагностического поиска, в которой на каждом этапе будут подтверждаться или исключаться те или иные предположения. На I этапе диагностического поиска следует выявить условия возникновения судорог, зависимость от внешних или внутренних факторов, выяснить их продолжительность и частоту. Особое внимание должно уделяться расспросам об образе жизни пациента, характере его питания, а также семейному анамнезу.
На II этапе диагностического поиска предполагается выявление фенотипических особенностей, которые могут укладываться в конкретные синдромы, указывающие на вероятную причину возникновения судорожных состояний. Наконец, на III этапе диагностического поиска следует обратить особое внимание на показатели биохимического анализа крови (в частности, на концентрации глюкозы, кальция, фосфатов, креатинина), при необходимости определить уровни интересующих врача в данной ситуации гормонов. Разумеется, не стоит пренебрегать использованием и инструментальных методов диагностики, доступных в настоящее время.
Таким образом, рационально выстроенный системный подход к дифференциальной диагностике судорожного синдрома позволит успешно выявить его причину и назначить правильное лечение.
Поступила: 15.08.2023
Принята к публикации: 30.10.2023
________
1 Гипопаратиреоз. Клинические рекомендации. Дети. URL: https://rae-org.ru/system/files/documents/pdf/klinreki_gipoparatireoz_final.pdf (дата обращения — 11.03.2024).
2 Гипопаратиреоз. Клинические рекомендации. Дети...
3 Там же.
4 Там же.
5 Гипопаратиреоз. Клинические рекомендации. Дети...
6 Там же.
7 Там же.








