Приобретенные пороки сердца — одна из основных причин смерти от сердечно-сосудистых заболеваний у лиц моложе 40 лет[1]. Консервативное лечение приобретенной патологии клапанов сердца направлено в основном на уменьшение тяжести клинических симптомов, однако на определенном этапе такое лечение становится неэффективным. Своевременное обращение к кардиохирургу позволяет вернуть к привычному образу жизни и трудовой деятельности до 80% пациентов с патологией клапанного аппарата сердца, а также на десятки лет продлить их жизнь. На отдаленных сроках течения приобретенных пороков сердца хирургическое лечение является безальтернативным способом продления жизни и повышения ее качества[2].
Операции по поводу приобретенных пороков клапанного аппарата сердца являются четвертыми по частоте в кардиохирургии после операций реваскуляризации миокарда, хирургического лечения по поводу патологии проводящей системы сердца и врожденных пороков сердца. Совершенствование системы оказания медицинской помощи при сердечно-сосудистых заболеваниях в Российской Федерации позволило в течение 2000–2014 гг. увеличить количество операций на клапанах сердца в 2,9 раза — с 4465 до 12 987[3]. Основными методами хирургической коррекции патологии клапанного аппарата сердца являются:
- протезирование клапана сердца механическим протезом;
- протезирование клапана сердца биологическим протезом;
- пластика клапана сердца (реконструктивные операции).
Согласно рекомендациям Американской коллегии кардиологов/Американской ассоциации по проблемам сердца (англ. American College of Cardiology/American Heart Association, ACC/AHA) 2014 г., имплантация механических протезов показана пациентам моложе 60 лет, а биологических протезов — пациентам в возрасте 60 лет и старше при отсутствии дополнительных факторов риска тромбоэмболии. Механические протезы у лиц моложе 60 лет обеспечивают низкую вероятность повторных операций на клапанах сердца, а биологические протезы у пациентов в возрасте 60 лет и старше — низкую потребность в постоянной
антикоагулянтной терапии, что увеличивает продолжительность жизни[1]. Операции пластики клапанов сердца являются более щадящими и имеют ряд преимуществ перед операциями протезирования клапанов, однако при невозможности выполнить реконструктивное вмешательство пациентам имплантируют протез клапана сердца[4].
Большинство операций на клапанах сердца выполняют открытым способом (через срединный разрез грудной клетки) с использованием аппарата искусственного кровообращения[5]. Применение искусственного кровообращения позволяет упростить выполнение ряда хирургических манипуляций, обеспечивает временное замещение функций сердца и легких, поддержку системной и церебральной гемодинамики и в итоге делает возможным относительно безопасное увеличение продолжительности хирургической операции[6]. В то же время изменения гемодинамики при операциях в условиях искусственного кровообращения являются дополнительным патогенетическим фактором послеоперационной мозговой дисфункции[7].
Несмотря на динамичное развитие кардиохирургии, совершенствование анестезиологического и перфузиологического обеспечения операций на сердце, интра- и послеоперационные изменения ЦНС остаются актуальной проблемой, приводят к повышению летальности, увеличению длительности нахождения в стационаре, снижению качества жизни пациентов, затруднению их социальной адаптации и, как следствие, к росту экономических затрат на лечение[8, 9]. По данным H.L.Jr. Edmonds и соавт. (2018), ежегодно во всем мире из одного миллиона пациентов, которым выполняются кардиохирургические операции, половина испытывает психоневрологические нарушения, которые в 25% случаев имеют стойкий характер. В США прямые расходы, связанные с психоневрологическими осложнениями при хирургических операциях реваскуляризации миокарда, оцениваются в 2 млрд долларов в год[10]. При операциях на клапанах сердца церебральные нарушения в раннем послеоперационном периоде увеличивают летальность в 10–15 раз[11].
Послеоперационная мозговая дисфункция — это изменение структурного и функционального состояния головного мозга преимущественно сосудистого генеза, возникающее в хирургической практике в интраоперационном или раннем послеоперационном периоде, проявляющееся в виде преходящих или стойких нарушений функций нервной системы[12]. В отечественной и зарубежной литературе данные об эпидемиологии и клинической значимости послеоперационной мозговой дисфункции в значительной степени зависят от используемых критериев диагностики.
Согласно классификации, предложенной P.J. Shaw (1993), осложнения со стороны ЦНС при операциях на сердце включают[13]:
- фатальное повреждение мозга;
- нефатальную диффузную энцефалопатию (депрессию уровня сознания, изменение поведения, интеллектуальную дисфункцию);
- эпилептические приступы, офтальмологические осложнения, инсульт;
- повреждения спинного мозга.
В.Г. Постнов и соавт. (2007) предложили классификацию церебральных осложнений после кардиохирургических операций, основанную на сроках развития неврологических нарушений[14]:
- нервно-психические осложнения в раннем (от 12 до 72 часов) послеоперационном периоде (острые фокальные нарушения мозгового кровообращения по ишемическому типу и по геморрагическому типу, острые психопродуктивные расстройства);
- осложнения в госпитальном (подостром, свыше 72 часов) послеоперационном периоде (отсроченные постгипоксические энцефалопатии, метаболические энцефалопатии).
С целью разработки чувствительных и приближенных к клинической практике критериев и способов диагностики изменений нервной системы при хирургических операциях на сердце и сосудах был создан Международный неврологический академический исследовательский консорциум (англ. Neurologic Academic Research Consortium, NeuroARC), участники которого в 2017 г. разработали консенсус из трех типов неврологических изменений[15]:
- первый тип: симптомное повреждение (ишемический инсульт, внутримозговое и/или субарахноидальное кровоизлияние, гипоксическое повреждение), сопровождающееся признаками инфаркта по данным МРТ в диффузионно-взвешенном режиме;
- второй тип: асимптомное повреждение (инфаркт мозга, кровоизлияние в ЦНС), сопровождающееся признаками инфаркта по данным МРТ в диффузионно-взвешенном режиме;
- третий тип: симптомное повреждение (транзиторная ишемическая атака, делирий), не сопровождающееся признаками инфаркта по данным МРТ в диффузионно-взвешенном режиме.
В предложенной классификации отсроченные когнитивные нарушения, составляющие бо́льшую часть неврологических изменений, не выделены в качестве отдельного типа, однако для скрининговой оценки когнитивных функций консорциумом NeuroARC рекомендуется шкала MoCA (англ. Montreal Cognitive Assessment)[15], которая широко применяется в диагностике когнитивных нарушений сосудистого генеза[16].
В клинической и хирургической практике наибольшей чувствительностью для диагностики ишемического инсульта обладает мультимодальная МРТ[17]. Однако после операций на клапанах сердца выполнение МРТ ограничено, что связано с наличием металлических скоб в теле пациента, в ряде случаев — с необходимостью установки временного кардиостимулятора, а также с наличием механического или биологического протеза клапана, поэтому основным методом нейровизуализации является КТ.
В течение 2010–2013 гг. в Военно-медицинской академии им. С.М. Кирова и Санкт-Петербургском государственном педиатрическом медицинском университете были проведены взаимодополняющие исследования (экспериментальные и клиническое)[12, 18, 19], позволившие определить патогенетические варианты послеоперационной мозговой дисфункции, а также обосновать соответствующие им клинические типы:
- периоперационный мозговой инсульт;
- симптоматический делирий раннего послеоперационного периода;
- отсроченные когнитивные нарушения.
Периоперационный мозговой инсульт и симптоматический делирий раннего послеоперационного периода являются следствиями острого повреждения нейронов и нейроглии, а отсроченные когнитивные нарушения развиваются при отсроченном повреждении нервных клеток. С учетом общности патогенеза и значительного влияния на исход лечения периоперационный мозговой инсульт и симптоматический делирий раннего послеоперационного периода могут быть объединены в понятие «острые клинические типы послеоперационной мозговой дисфункции» (рис.).
Рис. Патогенетические варианты и клинические типы послеоперационной мозговой дисфункции при кардиохирургических операциях в условиях искусственного кровообращения [цит. по: 12]
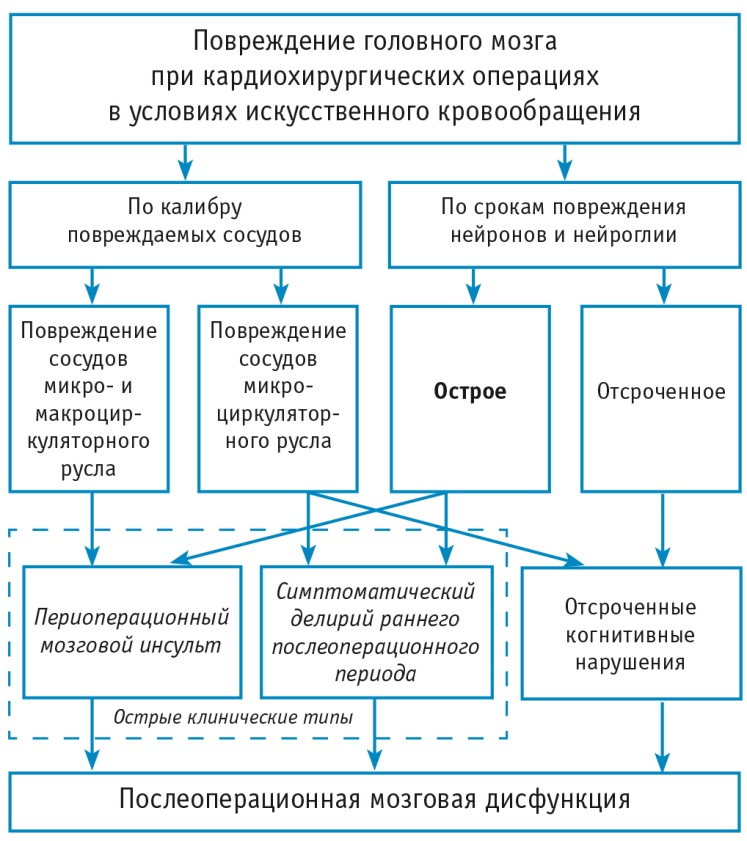
Частота клинических типов послеоперационной мозговой дисфункции в кардиохирургии различается: периоперационный мозговой инсульт диагностируют после 1–9% операций; симптоматический делирий раннего послеоперационного периода — 7–52%; отсроченные когнитивные нарушения — 10–80%[9, 20–24]. По данным Е.Г. Смертиной и соавт. (2016), острые клинические типы послеоперационной мозговой дисфункции в кардиохирургии чаще развиваются при оперативных вмешательствах по поводу патологии клапанов сердца[25].
Цель исследования: изучить частоту и структуру послеоперационной мозговой дисфункции при хирургических операциях по поводу приобретенных пороков клапанов сердца.
МАТЕРИАЛЫ И МЕТОДЫ
Обследовано 115 пациентов (70 мужчин и 45 женщин) в возрасте 64 лет [56; 72] (Me [Q25; Q75]), которым была выполнена плановая операция протезирования или пластики по поводу приобретенной патологии клапанов сердца в условиях искусственного кровообращения. Пациенты находились на стационарном обследовании и лечении в 1-й клинике (хирургии усовершенствования врачей) Военно-медицинской академии им. С.М. Кирова (г. Санкт-Петербург) в 2014–2018 гг.
Критерий включения в исследование — планируемая хирургическая операция по поводу приобретенной патологии клапанов сердца в условиях искусственного кровообращения.
Критерии невключения:
1) анамнестические сведения о ранее диагностированных опухолях головного мозга, рассеянном склерозе либо ином демиелинизирующем заболевании ЦНС, эпилепсии, деменции; о ЧМТ либо нейрохирургических вмешательствах в течение предшествовавших трех лет; об ишемическом или геморрагическом инсульте в течение предшествовавших трех месяцев;
2) беременность;
3) период лактации;
4) неспособность пациента к нейропсихологическому обследованию (ввиду нарушения сознания, речевых нарушений);
5) клинически выраженная тревога;
6) клинически выраженная депрессия.
Все операции были выполнены в условиях полного и параллельного искусственного кровообращения, нормотермии, общей комбинированной многокомпонентной анестезии с ИВЛ.
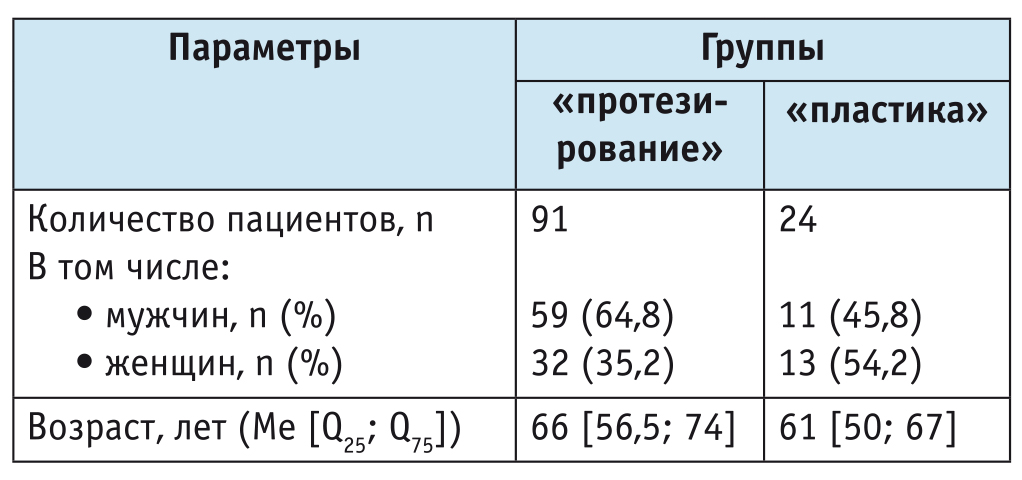
В зависимости от вида операции пациенты были разделены на две группы — «протезирование» (n = 91) и «пластика» (n = 24). Статистически значимых различий по полу и возрасту между группами не выявлено (p > 0,05) (табл. 1).
Таблица 1
Характеристика исследуемых групп
Все пациенты в предоперационном периоде получали стандартное медикаментозное лечение по поводу приобретенной патологии клапанов сердца (антиагреганты или антикоагулянты, антигипертензивные средства, при необходимости — антиангинальные, антиаритмические и антибактериальные препараты), симптоматическое лечение.
Для диагностики послеоперационной мозговой дисфункции всем пациентам выполняли комплексное периоперационное обследование:
- оценку неврологического статуса по шкале NIHSS (англ. National Institutes of Health Stroke Scale) за 2–3 суток до и через 3 суток после операции (при выявлении клинических признаков периоперационного мозгового инсульта проводили КТ головы);
- оценку спутанности сознания методом CAM (англ. Confusion Assessment Method) в раннем послеоперационном периоде;
- нейропсихологическое тестирование по шкале MoCA и батарее лобной дисфункции (англ. Frontal Assessment Battery, FAB), оценку по шкале HADS (англ. Hospital Anxiety and Depression Scale) за 2–3 суток до и через 7–10 суток после операции.
В качестве критерия диагностики отсроченных когнитивных нарушений использовали снижение результатов обследования по шкале MoCA или FAB в послеоперационном периоде на 2 балла и более по сравнению с предоперационным периодом, что соответствует общепринятому критерию в виде ухудшения когнитивных функций в послеоперационном периоде на 10% по сравнению с предоперационным периодом[26].
В ходе статистического анализа полученных данных применяли описание количественных признаков с использованием медианы (Me), нижнего и верхнего квартилей ([Q25; Q75]); оценку статистической значимости различий количественных показателей в независимых выборках с использованием U-теста Манна — Уитни; проверку гипотезы о происхождении групп, сформированных по качественному признаку, из одной и той же популяции на основе построения таблиц сопряженности наблюдаемых и ожидаемых частот и использования критерия хи-квадрат (χ2) Пирсона (метод максимального правдоподобия), в случаях его неустойчивости применяли двусторонний точный критерий Фишера.
РЕЗУЛЬТАТЫ
Исследуемые группы были однородны по данным неврологического и нейропсихологического обследования пациентов в предоперационном периоде, а также по условиям выполнения хирургических операций. Когнитивные нарушения (< 26 баллов по шкале MoCA, < 16 баллов по FAB) до операции диагностированы у 96 (83,5%) пациентов, в том числе у 78 человек (85,7%) в группе «протезирование» и у 18 (75,0%) — в группе «пластика» (р > 0,05). Средняя продолжительность операций в группах «протезирование» и «пластика» равнялась 230 [200; 287,5] и 210 [180; 242,5] минутам соответственно (р > 0,05); средняя продолжительность искусственного кровообращения составила 98 [84,5; 119] минут в группе «протезирование» и 96,5 [76,5; 115] минуты в группе «пластика» (р > 0,05).
Послеоперационная мозговая дисфункция диагностирована в 47 (40,9%) случаях, при этом в группе «протезирование» она наблюдалась у 42 (46,2%) человек, что статистически значимо чаще, чем в группе «пластика» (5 (20,8%) пациентов) (отношение шансов = 3,23; 95%-й доверительный интервал [1,15–10,43]; p = 0,039) (табл. 2).
Таблица 2
Частота и структура послеоперационной мозговой дисфункции при хирургических операциях по поводу приобретенных пороков сердца, n (%)
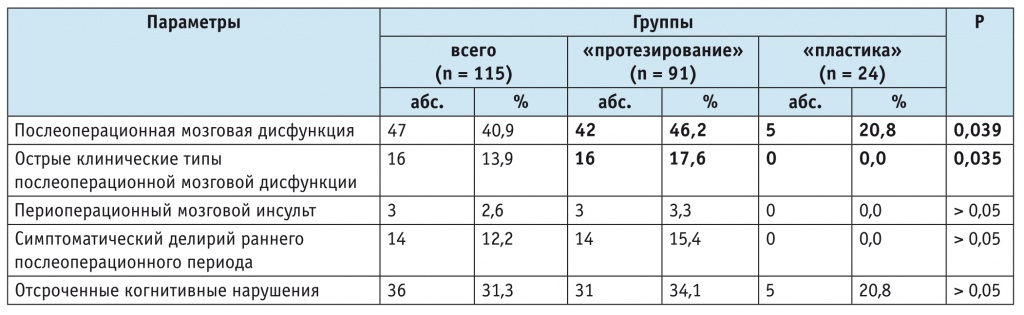
Частота периоперационного мозгового инсульта, симптоматического делирия раннего послеоперационного периода и отсроченных когнитивных нарушений в общей группе пациентов (см. табл. 2) соответствовала частоте развития послеоперационной мозговой дисфункции и ее клинических типов по данным литературы[9, 20–24].
Острые клинические типы послеоперационной мозговой дисфункции диагностированы только в группе «протезирование». Периоперационный мозговой инсульт в данной группе отмечен в 3 (3,3%) случаях, симптоматический делирий раннего послеоперационного периода — в 14 (15,4%) случаях; при этом у одного пациента развились и периоперационный мозговой инсульт, и симптоматический делирий раннего послеоперационного периода. В целом острые клинические типы послеоперационной мозговой дисфункции наблюдались у 16 (17,6%) пациентов, перенесших протезирование по поводу приобретенной патологии клапанов сердца, — сравнение с группой «пластика», где острые клинические типы послеоперационной мозговой дисфункции отсутствовали, статистически значимо (p = 0,035). Отсроченные когнитивные нарушения выявлены у каждого третьего пациента в группе «протезирование» и у каждого пятого — в группе «пластика» (р > 0,05) (см. табл. 2).
ОБСУЖДЕНИЕ
В неврологической и хирургической практике послеоперационная мозговая дисфункция диагностируется сравнительно редко, к чему имеется ряд предпосылок:
– отсутствие единого стандарта диагностики изменений нервной системы в послеоперационном периоде;
– междисциплинарный характер проблемы послеоперационной мозговой дисфункции и необходимость обследования пациентов в периоперационном периоде врачами мультидисциплинарной бригады;
– возможность малого неврологического дефицита при периоперационном мозговом инсульте;
– ограничение использования МРТ головного мозга в диагностике периоперационного мозгового инсульта, а также низкая чувствительность КТ головы в диагностике ишемического мозгового инсульта в острейшем периоде;
– низкая частота нейропсихологического тестирования в предоперационном периоде в рамках диагностики отсроченных когнитивных нарушений.
В проведенном исследовании частота периоперационного мозгового инсульта составила 2,6%. Основным механизмом его развития при кардиохирургических операциях является кардиоцеребральная эмболия[27, 28], что свидетельствует о важности своевременной диагностики и коррекции нарушений сердечного ритма в раннем послеоперационном периоде. Необходимо отметить также, что периоперационный мозговой инсульт относится к внутригоспитальным инсультам, сопряженным с определенными трудностями диагностики и особенностями лечения[29, 30]. В хирургической практике сроки его дебюта ограничены интраоперационным и ранним послеоперационным периодами. Поэтому для периоперационного мозгового инсульта стандартную тактику профилактики следует дополнять предупреждением и коррекцией интраоперационных нарушений церебральной гемодинамики, а также интенсивной фармакологической церебропротекцией[31].
Симптоматический делирий раннего послеоперационного периода развивался в 4,7 раза чаще, чем периоперационный мозговой инсульт. В одном из трех случаев периоперационного мозгового инсульта имелось сочетание обоих острых клинических типов послеоперационной мозговой дисфункции. В неврологической практике синдром спутанности сознания также часто сопровождает острый период мозгового ишемического инсульта[32].
В отличие от симптоматического делирия раннего послеоперационного периода, отсроченные когнитивные нарушения развиваются при сохраненном сознании в течение первой недели после кардиохирургического лечения или позже, манифестируя в виде стойкого нарушения когнитивных функций. Своеобразный парадокс отсроченных когнитивных нарушений (послеоперационной когнитивной дисфункции) заключается в том, что этот самый частый и наиболее широко обсуждаемый в отечественной и зарубежной литературе клинический тип послеоперационной мозговой дисфункции остается наименее диагностируемым в реальной клинической практике. Частота отсроченных когнитивных нарушений составила 31,3% и не различалась в зависимости от вида хирургической операции.
По сравнению с реконструктивной операцией, протезирование клапанов сопровождалось более чем трехкратным увеличением отношения шансов развития послеоперационной мозговой дисфункции. Кроме того, оба острых клинических типа послеоперационной мозговой дисфункции были диагностированы при операциях протезирования клапанов сердца и отсутствовали при операциях пластики клапанов сердца. С учетом патогенетических вариантов послеоперационной мозговой дисфункции отсутствие периоперационного мозгового инсульта и симптоматического делирия раннего послеоперационного периода у пациентов группы «пластика» может свидетельствовать о минимальной выраженности или отсутствии острых изменений нейронов и нейроглии, связанных с повреждением макро- и микроциркуляторного русла.
Более высокая частота послеоперационной мозговой дисфункции и наличие ее острых клинических типов исключительно в группе «протезирование» могут быть связаны с рядом факторов, предрасполагающих к кардиоцеребральной эмболии и отсутствующих при операциях пластики клапанов сердца:
– имплантация инородного тела приводит к изменению гидродинамических характеристик тока крови;
– по сравнению с естественным клапаном сердца, его протез занимает дополнительное пространство и уменьшает эффективную площадь клапанного отверстия, что может приводить к относительной обструкции и влиять на сократительную функцию левого желудочка и структуру корня аорты;
– при операциях протезирования клапанов сердца увеличивается потребность в интенсивной антикоагулянтной терапии, однако возможности ее применения в первые часы после хирургической операции ограничены ввиду высокого риска кровотечения.
ЗАКЛЮЧЕНИЕ
С учетом различий, выявленных в частоте и структуре послеоперационной мозговой дисфункции, при выборе типа хирургической коррекции приобретенной патологии клапанов сердца при прочих равных условиях предпочтение следует отдавать операциям пластики клапанов сердца. Наиболее вероятной причиной отсутствия острых клинических типов послеоперационной мозговой дисфункции при операциях пластики клапанов сердца представляется сохранность кровотока на уровне макроциркуляторного русла, что соответствует данным о низкой частоте кардиоцеребральной эмболии при данном виде операций по поводу приобретенной патологии клапанного аппарата сердца.








