ВВЕДЕНИЕ
В настоящее время отмечается неуклонный рост числа детей с гетерогенными когнитивными нарушениями, особенно с задержками психоречевого развития (ЗПРР) аутистического спектра. Многочисленные публикации, посвященные этой теме, не дают исчерпывающие ответы на актуальные вопросы по этиологии и коррекции данных состояний. Поиск механизмов развития ЗПРР и методов их лечения является важнейшей задачей современной педиатрии.
Задержки психического и речевого развития характеризуются обратимым недостаточным уровнем развития когнитивных функций — речи, памяти, внимания, мышления и восприятия. ЗПРР начинаются в раннем детском возрасте без периода нормального развития и имеют разный прогноз: от стабильного дефицита до прогрессивного улучшения по мере роста и развития ребенка[1].
ЗПРР не обладают нозологической самостоятельностью и представляют собой полиморфную гетерогенную группу патологий, входящих в структуру более 100 заболеваний. В последние годы отмечается прогрессивный рост распространенности ЗПРР различного генеза[2].
Задержки развития, по данным ВОЗ, часто не имеют определенной этиологии и встречаются у 10% населения любой страны, из которых большинство составляют дети младше 5 лет; у 5% таких пациентов есть установленная инвалидность. Частота тяжелых задержек нервно-психического развития в Российской Федерации достигает 7 на 1000 населения[3].
В последнее время также отмечается увеличение в популяции количества детей с аутизмом и расстройствами аутистического спектра (РАС)[3]. Современные эпидемиологические данные оценивают распространенность аутизма в 1–2 на 1000 детского населения и РАС — около 6 на 1000[4].
У детей с РАС, характеризующихся рядом поведенческих аномалий и социальных дефицитов, в том числе ЗПРР, высока частота сопутствующих заболеваний ЖКТ, в частности хронических запоров и диареи[5]. Все чаще публикуются данные о корреляции между РАС и желудочно-кишечными проблемами и о возможной корреляции с потреблением глютена и казеина.
Сейчас активно используют дополнительные и альтернативные методы лечения детей с аутизмом, в т. ч. диету, исключающую глютен и/или казеин. Однако доказательства эффективности этих диет сомнительны, что требует дальнейшего их изучения[6].
Современные данные отечественных и зарубежных исследований свидетельствуют о том, что у детей с РАС и симптомами со стороны ЖКТ наблюдается высокая распространенность интраэпителиальной лимфоцитарной инфильтрации двенадцатиперстной кишки, которая, по-видимому, связана с механизмом, отличным от аутоиммунного ответа на потребление глютена. Изменение гистологии двенадцатиперстной кишки, а не статус HLA-DQ2/DQ8, связан с клиническим ответом на аглютеновую диету[7].
В ряде исследований[8, 9] демонстрируются низкая активность пищеварительных ферментов, нарушенная целостность кишечного барьера и присутствие антител, специфичных к пищевым белкам, в периферическом кровообращении у пациентов с РАС. Эти данные подтверждают гипотезу о том, что попадание пищевых пептидов из просвета кишечника в сосудистое русло связано с аберрантным иммунным ответом. Кроме того, у детей с РАС зафиксированы высокие концентрации метаболитов, возникающих в результате поглощения микробами белковых субстратов.
Комбинация специфических белков, влияющих негативно на пищеварение, целостность кишечного барьера, состав и функция микробиоты на фоне РАС формируют фенотипический паттерн. Потенциальным следствием этого паттерна является то, что «хрупкая» кишка некоторых детей с РАС подвержена риску возникновения патологических симптомов со стороны ЖКТ, которые могут быть нивелированы при определенных диетических изменениях[7].
Большинство исследований, оценивающих эффективность безглютеновой и казеиновой (БГБК) диеты при лечении аутизма, имеют серьезные недостатки[9]. Доказательства терапевтической ценности этих диет ограничены и слабы.
Цель исследования: изучить соматические особенности и влияние элиминационой диеты (БГБК) на соматический и психоневрологический статус детей с ЗПРР.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проводилось в период с 2018 по 2021 г. на базе Университетской детской клинической больницы ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет) (главный врач — д. м. н., профессор С.И. Валиева) и кафедры детских болезней Клинического института детского здоровья им. Н.Ф. Филатова ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет) (заведующая кафедрой — д. м. н., профессор Н.А. Геппе). Дети были обследованы и наблюдались в отделении психоневрологии Университетской детской клинической больницы ФГАОУ ВО Первый МГМУ им. И.М. Сеченова (заведующая отделением — И.Ю. Ожегова) и лечебно-диагностическом отделении Университетской детской клинической больницы ФГАОУ ВО Первый МГМУ им. И.М. Сеченова (заведующая отделением — С.Н. Жучкова).
Под наблюдением находились 105 детей с ЗПРР различного генеза: 34 (32%) девочки и 71 (68%) мальчик в возрасте от 1,5 года до 6 лет 7 месяцев (средний возраст — 3,9 ± 1,4 года). Наблюдаемые дети были разделены на две группы (рандомно, но при условии согласия родителей на соблюдение БГБК диеты): 53 ребенка (первая группа) получали диетотерапию с исключением продуктов, содержащих глютен и казеин, 52 пациента (вторая группа) — обычное дошкольное питание. Все дети получали базисную медикаментозную метаболическую и сосудистую терапию.
Критерии включения: диагноз ЗПРР, возраст детей от 1,5 до 7 лет, подписанное информированное добровольное согласие родителей на диагностику и наблюдение детей, их комплаентность в вопросе диетотерапии. Критерии исключения пациентов из исследования: отказ родителей от участия в исследовании, низкая комплаентность ребенка. Протокол исследования одобрен локальным этическим комитетом ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет) (выписка из протокола № 16-21 от 16.09.2021 г.).
Проводилась клиническая оценка пациентов с анализом данных анамнеза и объективного осмотра с использованием шкал Integrative Medicine Assessment Scale (IMAS) 1 и 2, Childhood Autism Rating Scale, Autism Treatment Evaluation Checklist (ATEC), Integrative Medicine Patients Parent Scale. Осуществлялась лабораторная и инструментальная диагностика: общеклиническое и биохимическое исследования крови; исследование крови на гормоны щитовидной железы (ТТГ, тироксин), иммунологический анализ крови на суммарные IgA, IgM, IgG, IgE, антитела к тканевой трансглутаминазе классов A (Anti-tTG IgA), G (Anti-tTG IgG), антитела к казеину класса G (IgG); генетический анализ при необходимости (полное экзомное секвенирование и анализ на кариотип), УЗИ органов брюшной полости, почек, сердца, транскраниальная ультразвуковая доплерография сосудов головного мозга, МРТ головного мозга[10, 11]. Все дети были консультированы неврологом, психиатром, генетиком, сурдологом.
Проведен всесторонний статистический анализ представленных данных: описательный, корреляционный и сравнительный. Для описательного анализа количественных признаков использована программа PAST, в которой реализованы современные универсальные непараметрические (рандомизационно-перестановочные) алгоритмы построения ДИ и статистических сравнений на основе процедур бутстрепа и Монте-Карло (Ø. Hammer и соавт., 2001). Для статистического описания этих показателей проверяли их согласие с нормальным распределением и оценивали средние значения, медианы с 95%-ми ДИ.
Для описательного анализа категориальных признаков использована программа IBM SPSS Statistics 27.
Перед сравнением данных в разные периоды или в разных группах проводили проверку согласия распределения количественных признаков с нормальным распределением с помощью критериев Андерсона — Дарлинга, Шапиро — Уилка, Лиллиефорса и Харке — Бера и оценки Р-значений методом Монте-Карло. Для статистических сравнений применяли параметрические критерии: t-критерий Стьюдента для независимых выборок, ранговый U-критерий Манна — Уитни, дисперсионный анализ с повторениями, точный критерий для таблиц сопряженности Фишера или Фишера — Фримана — Холтона. Апостериорные сравнения выполнены с поправкой на множественные сравнения Тьюки или Бонферрони. Различия считали статистически значимыми при р < 0,05.
РЕЗУЛЬТАТЫ
Как видно из таблицы 1, нозологическая структура у наших пациентов имела достаточную нозологическую гетерогенность, и алгоритм диагностики подразумевал наличие синдрома ЗПРР. В соответствии с разработанным алгоритмом диагностики ЗПРР [12] верифицированы нозологические формы: 36 (34,3%) детей были с последствиями перинатального поражения нервной системы органического характера, 35 (33,3%) — с дезинтегративным расстройством детства, 10 (9,5%) — с ранним детским аутизмом, а остальные 24 (22,9%) — с различного рода генетической и хромосомной патологией, причем все нарушения носили спонтанный характер и не имели наследственной детерминированности.
Таблица 1
Нозологическая структура у наблюдаемых пациентов (n = 105), n (%)
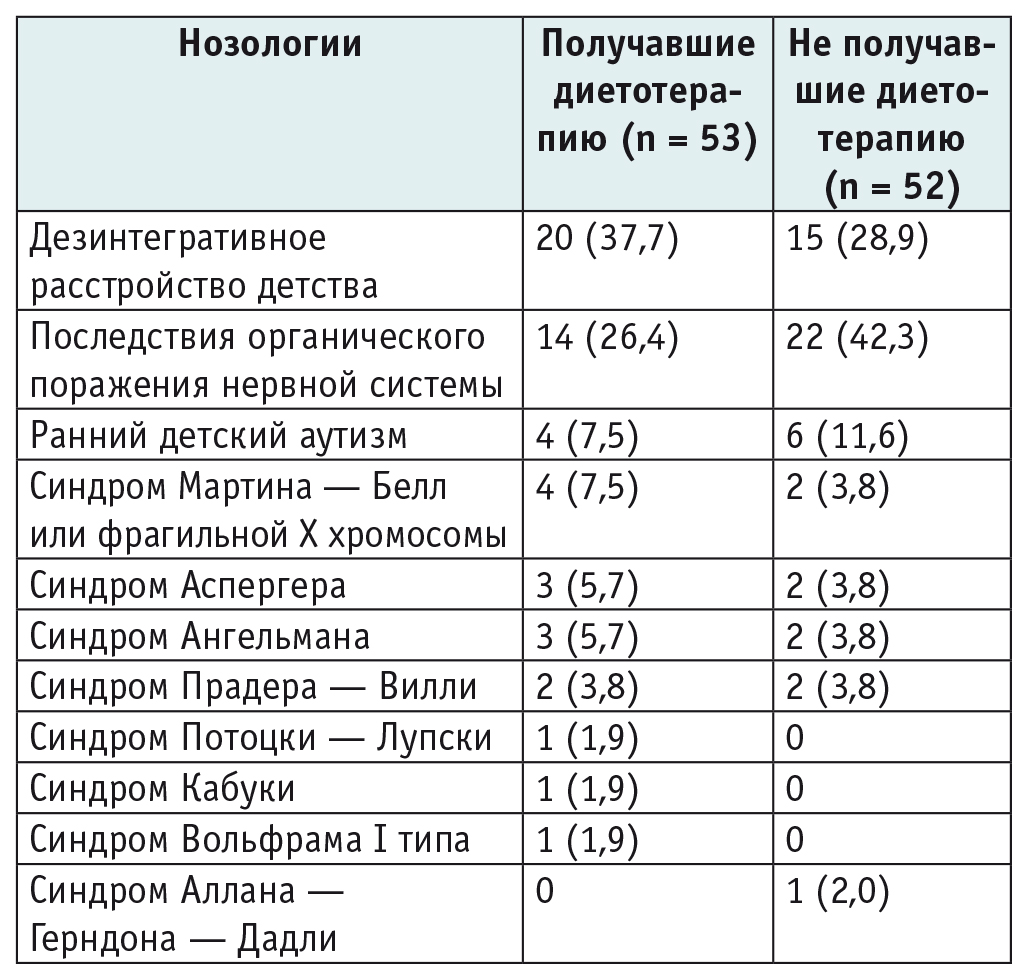
Однако из 105 детей нами наблюдались 8 пар близнецов (3 пары девочек и 5 пар мальчиков — бихориальные и биамниотические двойни, из них 3 рождены с помощью ЭКО) с диагнозом дезинтегративного расстройства детства, что верифицировало важную роль течения беременности, особенно ранних ее этапов, в формировании ЗПРР (табл. 2).
Таблица 2
Характеристика наблюдаемых пациентов, n (процент в группе с 95%-ным доверительным интервалом — Ме [25%; 75%])
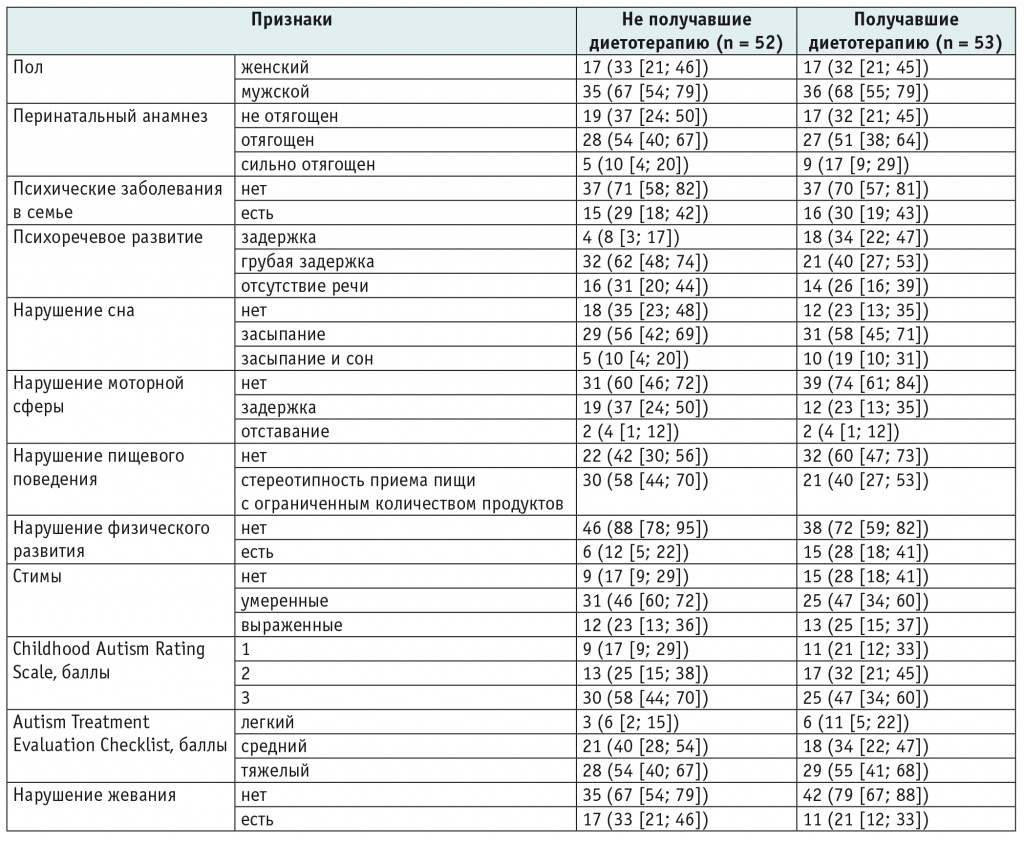
Из таблицы 2 видно, что мальчиков в обеих группах было в 2 раза больше, чем девочек. Анализ анамнестических данных выявил, что у большинства детей обеих групп (32 (60,4%) ребенка в первой и 28 (53,8%) детей во второй) проблемы с психоречевым развитием отмечались с рождения, а у 20 (37,7%) участников первой группы и у 15 (28,9%) второй группы (дети с дезинтегративным расстройстом) в среднем нарушения в развитии начались с 16 ± 3,7 и 17 ± 2,8 месяца, со слов родителей и по медицинским документам.
Перинатальный анамнез был отягощен гипоксией и/или внутриутробной инфекцией у 69 (65,7%) больных, что привело к нарушению не только интеллектуальной сферы, но у 35 (33,3%) пациентов — еще и к разной степени дефицитарности двигательной сферы, особенно мелкой моторики и координации. В семейном анамнезе у трети детей отмечалась отягощенность по психическим, онкологическим и аутоиммунным (ревматоидный артрит, псориаз, рассеянный склероз) заболеваниям у родственников первого и второго круга родства. У 81 (77%) из 105 пациентов наблюдались стереотипные движения (стимы) в виде «стряхивания» рук, подпрыгивания и кручения на месте.
Детальный анализ соматического статуса мы начали с определения нарушения физического развития. У 21 (20%) ребенка была задержка физического развития. Все пациенты с дефицитом росто-весовых показателей (не более 2 сигмальных отклонений) имели основное врожденное генетическое или хромосомное заболевание, что обусловливало задержку их роста и нутритивную недостаточность. При этом из 51 (48,5%) ребенка с различного рода нарушениями пищевого поведения значимые нарушения физического развития имелись только у 5 детей: двое с синдромом Прадера — Вилли с избыточным весом вследствие булимии и трое детей с конституционально-экзогенной формой ожирения 1–2-й степени.
У 51 пациента выявлялись стереотипность приема пищи, употребление ограниченного количества продуктов, проблемы с дегустацией новых продуктов. У 33% пациентов первой группы и 21% второй отмечались сложности с процессом жевания пищи, и, несмотря на возраст старше 3,5 года, они употребляли только гомогенизированную пищу.
Оценка по шкале IMAS врачебного наблюдения показала, что у 44 (83%) детей, получавших диетотерапию, были нарушения дефекации: у 5 — тенденция к диарее, у 39 детей — к выраженным запорам (в соответствии с Римскими критериями IV, стул не чаще 2 раз в неделю), у 18 из них (34% из общего количества детей первой группы) дефекация была возможна только в вертикальном положении и отсутствовал центральный контроль тазовых функций.
Следует отметить, что у 2 пациентов с выраженным абдоминальным болевым синдромом проведено эндоскопическое обследование (включавшее ЭГДС и колоноскопию), не выявившее органическую патологию ЖКТ.
В соматическом статусе у 12 (11,4%) больных имелись аллергические заболевания: атопический дерматит, бронхиальная астма; у 21 (20%) пациента — патология ЛОР-органов (аденоиды, отиты, тонзиллиты), что не превышает среднепопуляционные показатели. Заболеваемость респираторными инфекциями у детей в среднем составляла 4,7 ± 2,3 раза в год. Общая оценка по шкале IMAS состояния соматического статуса через 12 месяцев в первой группе составляла 8 ± 3 балла (р < 0,001), а во второй группе — 10 ± 2,6 балла (р < 0,03).
Динамическое клиническое наблюдение детей с детальной комплексной оценкой на фоне проводимой диетотерапии показало (табл. 3), что из 38 (71,6%) детей со стимами, из которых выраженные стереотипы имели 13 детей и 25 — умеренные, через 6 месяцев только у 1 ребенка они сохранялись с высокой интенсивностью, а у 12 стали умеренными. Умеренные стимы (возбуждение при эмоциональной нагрузке, стрессовых ситуациях, т. е. индуцированные) у 7 детей полностью нивелировались.
Таблица 3
Характеристика 53 пациентов группы диетотерапии по категориальным признакам в разные периоды, n (процент в группе с 95%-ным доверительным интервалом — Ме [25%; 75%])
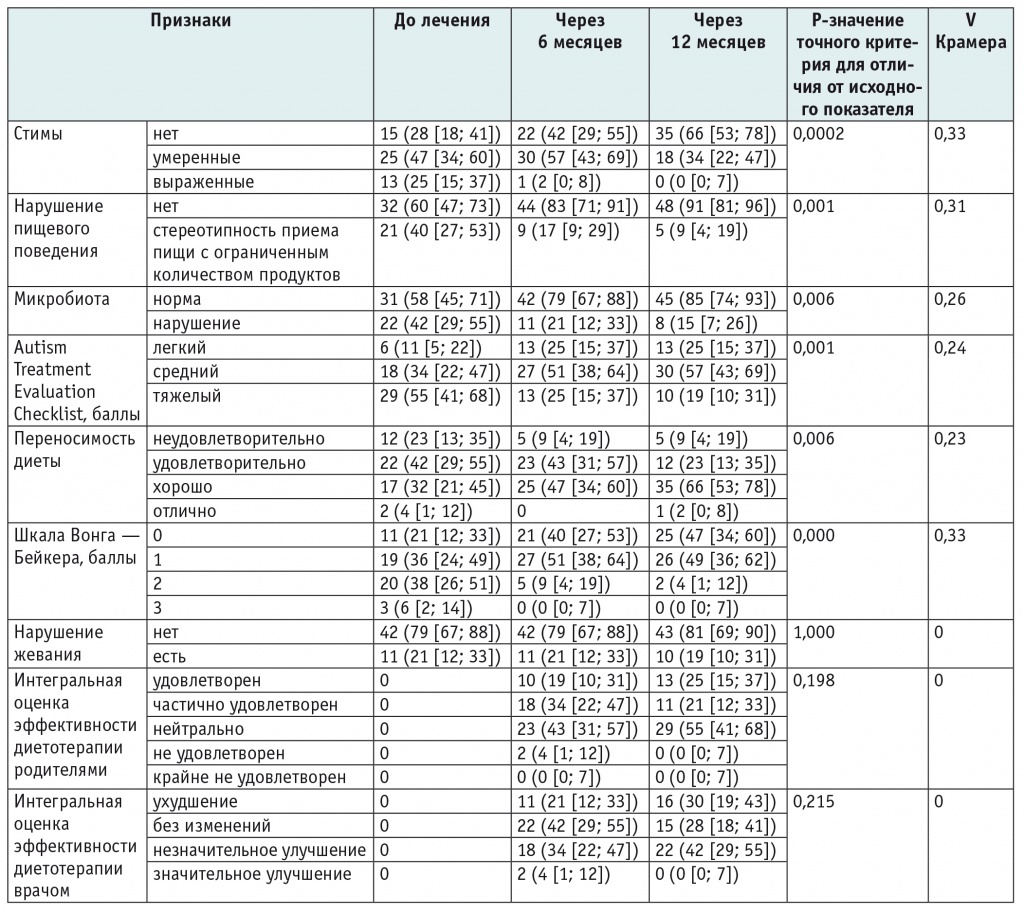
При оценке через 12 месяцев от начала наблюдения общее количество детей без стим было 35 (66%) против 15 (28%) исходно, оно выросло в 2,3 раза (p < 0,002), у всех 13 детей со значительно выраженными стимами они стали умеренными, а в группе без диетотерапии существенной динамики по этому параметру не было (табл. 4).
Таблица 4
Характеристика 52 пациентов группы без диетотерапии по категориальным признакам в разные периоды, n (процент в группе с 95%-ным доверительным интервалом — Ме [25%; 75%])
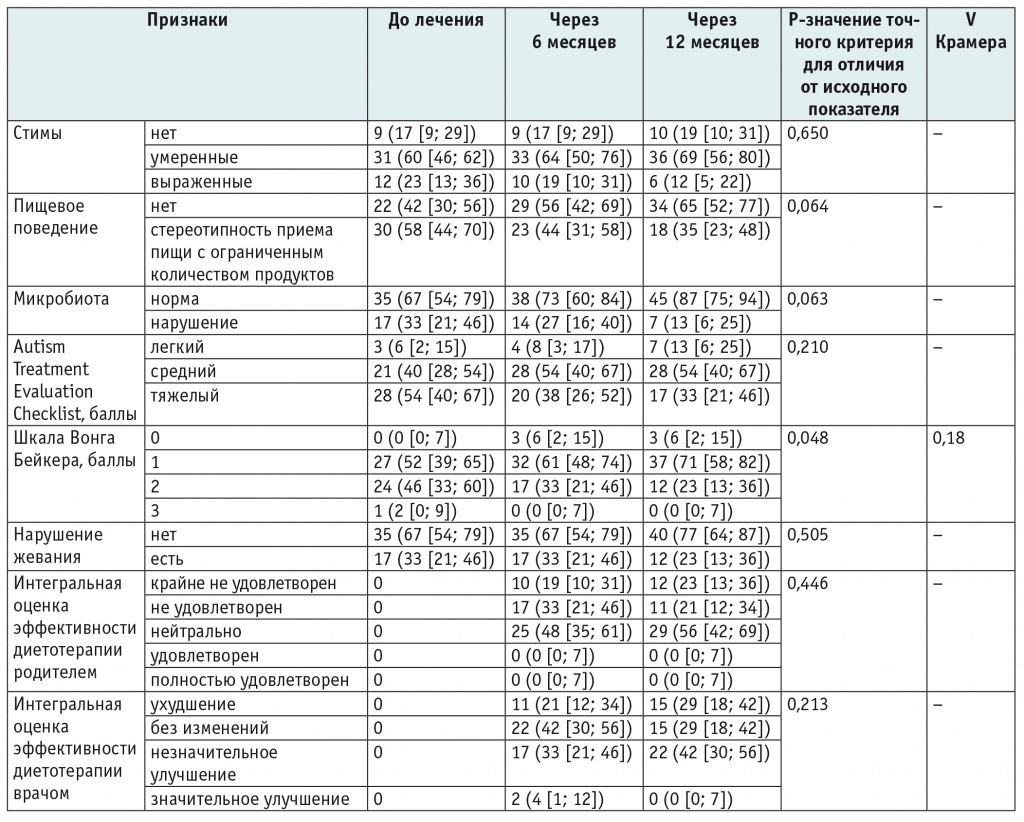
Улучшения в пищевом поведении зафиксированы через 6 месяцев у 12 (23%) детей первой группы (p < 0,001), через 12 месяцев наблюдения еще у 4 детей отмечена положительная динамика по этому показателю (p < 0,001), при этом 1 ребенку из 11 с нарушением жевания удалось освоить данный навык. В группе без диетотерапии пищевое поведение улучшилось у 12 детей.
Таким образом, диетотерапия улучшала пищевое поведение (уменьшение количества стереотипов в выборе продуктов питания, расширение пищевого рациона, порядка употребления продуктов и потребление продуктов без специальной обработки — размельчения, гомогенизации) в 4,2 раза.
При оценке по шкале динамического контроля ATEС отмечалось некоторое снижение количества детей с тяжелыми нарушениями через 12 месяцев: на фоне диетотерапии у 19 из 29 пациентов с тяжелым поражением и у 12 из 18 пациентов с умеренным (p = 0,001) наблюдалась положительная динамика (см. табл. 3).
По шкале родительской интегральной оценки переносимости диеты родители 23 (43%) детей отмечали хорошую ее переносимость, а 29 (55%) были частично удовлетворены диетой. По шкале врачебной оценки эффективности диетотерапии значительное улучшение регистрировалось у 22 (42%) участников.
Нами произведена лабораторно-параклиническая оценка пациентов обеих групп до и через 6 и 12 месяцев после начала наблюдения (табл. 5).
Таблица 5
Количественные лабораторные показатели у пациентов в разные периоды
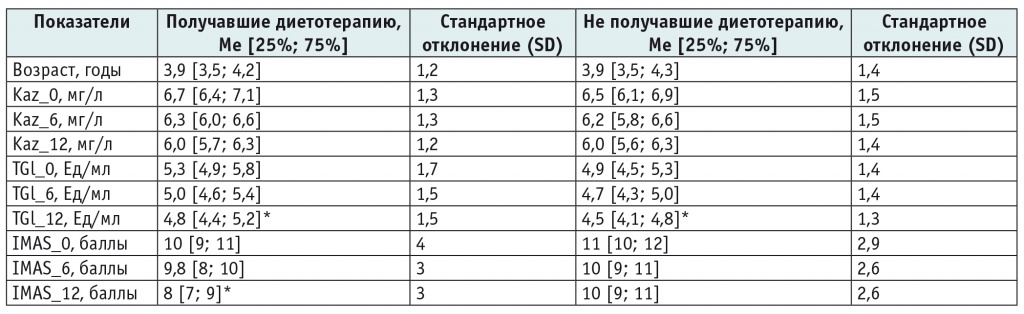
Примечание: Kaz_0, Kaz_6, Kaz_12 — антитела к казеину до, через 6 и 12 месяцев от начала наблюдения соответственно; TGl_0, TGl_6, TGl_12 — антитела к трансглутаминазе до, через 6 и 12 месяцев от начала наблюдения; IMAS_0, IMAS_6, IMAS_12 — оценка по шкале Integrative Medicine Assessment Scale до, через 6 и 12 месяцев от начала наблюдения.
* Отличия от исходного показателя статистически значимы (р < 0,05).
Средние исходные уровни IgG к казеину составляли 6,7 ± 1,3 мг/л в группе диетотерапии и 6,5 ± 1,5 мг/л в группе, не получавшей диетотерапию (при норме до 10 мг/л), существенная динамика в обеих группах отсутствовала (рис. 1).
Рис. 1. Динамика уровней антител к казеину: до начала наблюдения, через 6 и 12 месяцев от начала наблюдения в группе диетотерапии (Koz_0_1, Koz_6_1, Koz_12_1) и в группе без нее (Koz_0_0, Koz_6_0, Koz_12_0)
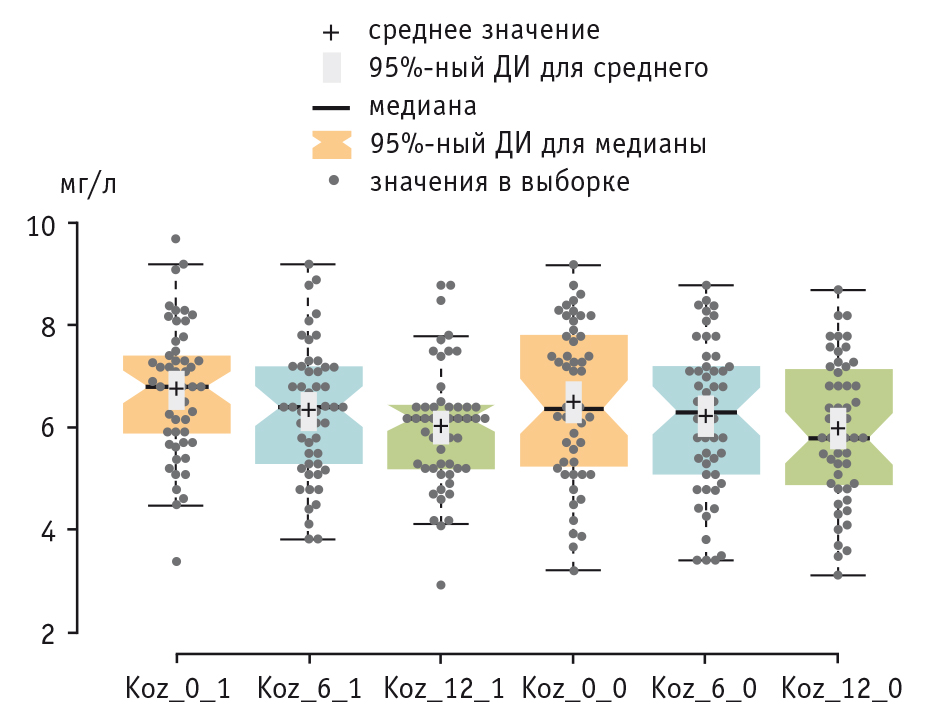
Наиболее чувствительным и значимым оказался уровень антител к тканевой трансглутаминазе. При его анализе наблюдалась та же тенденция, что и в показателях антител к казеину. Практически у всех детей первой группы уровень Anti-tTG IgA находился в пределах нормы (кроме 2 пациентов, у которых отмечалось его повышение в 1,3 раза), а уровень Anti-tTG IgG был увеличен до 8,4 ± 1,7 Ед/мл (при норме до 7 Ед/мл) у 9 (17%) детей. Во второй группе у 3 детей уровень Anti-tTG IgG был повышен до 8,4 ± 1,7 Ед/мл, у остальных этот показатель находился в пределах нормы, а уровень Anti-tTG IgG у 7 детей оказался увеличен до 9, 1 ± 1,5 Ед/мл (рис. 2).
Рис. 2. Динамика уровней антител к трансглутаминазе: до, через 6 и 12 месяцев от начала наблюдения в группе диетотерапии (TGL_0_1, TGL _6_1, TGL _12_1) и в группе без нее (TGL_0_0, TGL_6_0, TGL_12_0).
Примечание. Отличия от исходного показателя статистически значимы: (*) — p < 0,009; (**) — p < 0,02
С учетом высокой вариативности величин нами рассчитан коэффициент вариации (отношение стандартного отклонения к среднему значению), который по некоторым позициям превышал 40%. В этих случаях для статистической оценки результатов большое значение имел показатель медианы.
Нами зафиксирована значимая положительная динамика уровней антител к трансглутаминазе на фоне диетотерапии (см. рис. 2). Детальный анализ по пациентам с высокими
концентрациями антител показал нормализацию уровней IgА и IgG у детей, получавших диетотерапию. Необходимо отметить, что через 12 месяцев в обеих группах отличие от исходного показателя было статистически значимым. Проведенный корреляционный анализ не выявил значимой связи между разными лабораторными показателями.
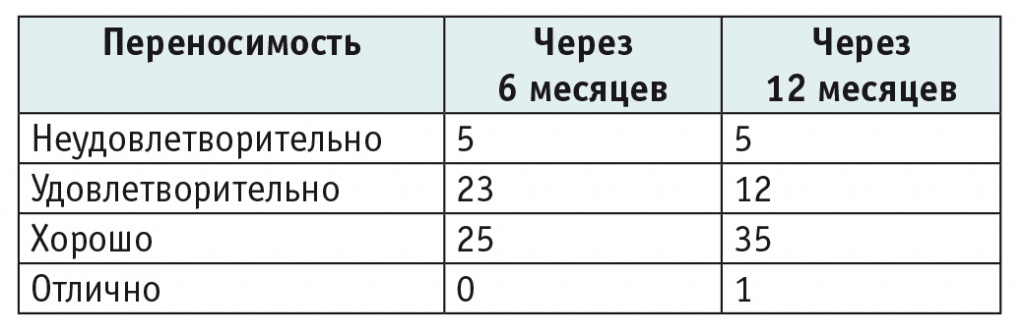
Для статистического анализа связи между переносимостью диетотерапии и уровнем антител к трансглутаминазе использован непараметрический критерий Джонкхиера — Терпстры. Дети с хорошей и отличной переносимостью диеты через 12 месяцев были объединены в одну группу «хорошо и отлично». Родители 48 (90,5%) пациентов оценили переносимость диеты на «отлично», «хорошо» и «удовлетворительно». Сложности организационного плана и перестройки питания отмечали 50% родителей, но уже со второй недели они увидели улучшение в поведении детей, а с 3–4-й недели — уменьшение стим и нормализацию функционирования ЖКТ в виде нивелирования запоров и метеоризма, что коррелировало с данными IMAS и уровнем антител к трансглутаминазе.
Только у 5 детей были сложности с употреблением определенного набора продуктов, поддержанием диетотерапии, что отразилось на отрицательной оценке их родителей (табл. 6). Статистические расчеты показали, что через 6 и 12 месяцев между переносимостью диеты и уровнем антител к трансглутаминазе имелась взаимосвязь, т. к. у детей с разной переносимостью диеты медианные значения антител значимо различались (p < 0,005).
Таблица 6
Количество пациентов с разной переносимостью диеты (родительская оценка), n
ОБСУЖДЕНИЕ
Результаты клинико-лабораторного наблюдения показали существенную положительную динамику в группе, получавшей диетотерапию, в отличие от группы без диетической коррекции: через 6 и 12 месяцев от начала наблюдения увеличилось число детей без стим (в 1,5 и 2,3 раза), а также без проблем с пищеварением; через 6 месяцев в 2,3 раза снизилась доля выраженных стереотипов. Согласно шкале ATEC, через 6 и 12 месяцев в 2,2 и 2,9 раза уменьшилось количество детей с тяжелыми нарушениями; по шкале оценки соматического статуса IMAS суммарный балл был в 1,25 раза меньше.
ЗАКЛЮЧЕНИЕ
С учетом федеральных клинических рекомендаций и рекомендаций Европейского общества специалистов в области детской гастроэнтерологии, гепатологии и питания (European Society for Paediatric Gastroenterology, Hepatology and Nutrition) по глютеновой энтеропатии[13, 14] у пациентов с задержками психоречевого развития аутистического спектра можно предположить так называемую нецелиакийную чувствительность к глютену — неаутоиммунную неаллергическую непереносимость глютена. Отсутствие антител к трансглутаминазе, казеину или нормальные их уровни не исключают необходимости соблюдения элиминационной диеты (безглютеновой, безказеиновой) у этих пациентов, так как диетотерапия имеет положительное влияние на их психоневрологический и соматический статус.
Поступила: 17.03.2022
Принята к публикации: 23.03.2022







