Болезнь Паркинсона относится к числу наиболее распространенных нейродегенеративных заболеваний [1]. Основой клинической картины БП являются двигательные нарушения (гипокинезия, тремор покоя, ригидность), которые манифестируют при гибели 50–80% дофаминергических нейронов компактной части черной субстанции[2].
С комплексным поражением дофаминергических систем связано появление не только моторных нарушений, но и широкого спектра вегетативных, сенсорных, аффективных, когнитивных проявлений, которые могут возникать на доклинической стадии БП, иногда задолго до манифестации классических двигательных расстройств. Частота и тяжесть немоторных нарушений коррелируют с длительностью БП и тяжестью моторных расстройств[3]. По данным ряда исследователей, немоторные симптомы в значительной степени определяют качество жизни пациентов с БП[4, 5]. В премоторной фазе БП преобладают гипосмия, инсомнические расстройства фазы быстрого движения глаз, запоры, депрессия, боли; для поздних стадий заболевания более характерны трудности при глотании, неполное опорожнение кишечника, нарушение мочеиспускания, ортостатическая гипотензия, нарушение когнитивных функций, психозы[6].
Среди немоторных симптомов отмечаются нарушения метаболизма, которые проявляются изменениями основного обмена, массы тела, дисбалансом питания[7].
В нескольких клинических исследованиях установлена связь между длительностью БП, выраженностью двигательных и немоторных симптомов и изменением пищевого поведения пациентов[8, 9].
Контроль потребления пищи и энергетического метаболизма зависит от взаимодействий энергетического гомеостаза, эмоциональных факторов (в том числе гедонических аспектов пищи) и факторов внешней среды. Эти сложные взаимодействия обеспечивает сеть взаимосвязанных нейронов гомеостатической и гедонической систем, получающих и интегрирующих множественные орексигенные и анорексигенные сигналы от периферических тканей о концентрации питательных веществ в крови, а также других областей ЦНС. Гипоталамус является центральным компонентом данной сети и содержит несколько ядер, которые осуществляют двунаправленный гомеостатический контроль потребления пищи и метаболизма в ответ на периферические сигналы, отражающие поглощающее состояние и энергетический резерв. Островная кора, орбитофронтальная кора, прилежащее ядро прозрачной перегородки, миндалевидное тело и дофаминергические нейроны вентральной тегментальной области играют ключевую роль в контроле пищевого поведения[10].
Вследствие изменений пищевого поведения, уровня энерготрат у больных БП с прогрессированием заболевания может отмечаться рост или снижение массы тела[11]. Вопрос о роли повышенной массы тела у пациентов с БП остается спорным. Определенной взаимосвязи между ИМТ и риском развития БП в ходе крупных эпидемиологических исследований установлено не было[12]. Однако описана возможная корреляция абдоминального ожирения с повышенным риском развития БП[13].
Около 50% пациентов с БП отмечают непреднамеренное снижение веса[14]. Причинами потери веса при БП могут быть снижение потребления энергии вследствие дисфункции желудочно-кишечного тракта, увеличение энерготрат, вызванное моторными проявлениями заболевания (тремором, ригидностью, дискинезиями) или усилением метаболизма глюкозы при применении препаратов леводопы[15]. С учетом роли дофамина в регуляции гедонических механизмов пищевого поведения предполагается влияние дофаминовой дисфункции на снижение массы тела у пациентов с БП путем образования анорексигенных сигналов в гипоталамусе[14, 16]. Снижение массы тела пациентов на ранних стадиях заболевания является прогностически неблагоприятным признаком[17]. Пациенты со сниженной массой тела также имеют более высокий риск развития дискинезий при лечении препаратами леводопы по мере прогрессирования заболевания[18]. Такие частые немоторные проявления, как запоры, гастропарез, дисфагия, в значительной степени ухудшают качество жизни пациентов, могут приводить к дефициту поступления питательных микроэлементов[11].
В ряде исследований отмечена корреляция дефицита потребления тиамина, витамина D, магния, полиненасыщенных жирных кислот, повышенного потребления железа, животных жиров с высоким риском развития БП[19–22]. Другие авторы отмечают возможность снижения риска развития заболевания при повышенном потреблении витамина Е, бета-каротина, флавоноидов[20, 23, 24]. В исследовании пищевого поведения 1053 пациентов с БП было отмечено, что употребление в пищу свежих овощей, фруктов, орехов и семян, рыбы, оливкового масла, вина, кокосового масла, свежих трав и использование специй связаны со статистически значимо более медленным прогрессированием заболевания[25]. С другой стороны, увеличение потребления консервированных фруктов и овощей, молочных продуктов, жареной пищи, говядины ассоциировалось с ростом скорости прогрессирования заболевания[25].
Таким образом, изучение особенностей пищевого поведения пациентов с начальными проявлениями БП с последующей диетологической коррекцией может быть одним из факторов повышения качества жизни при этом прогрессирующем нейродегенеративном заболевании[26].
Цель исследования: анализ структуры пищевого поведения пациентов с начальными проявлениями болезни Паркинсона.
МАТЕРИАЛЫ И МЕТОДЫ
В рамках совместного научного исследования Федерального исследовательского центра питания, биотехнологии и безопасности пищи (г. Москва) и Московского областного научно-исследовательского клинического института им. М.Ф. Владимирского, одобренного локальным этическим комитетом, проведена оценка фактического питания 65 пациентов с начальными проявлениями БП. Больные ранее не получали дофаминергической терапии и имели I–II стадию заболевания (по шкале Хён — Яра); средний возраст пациентов составил 51,2 ± 5,7 года, ИМТ — 28,5 ± 1,0 кг/м2.
Оценку пищевого поведения проводили с использованием компьютерной программы Nutrilogic, разработанной на базе Научно-исследовательского института питания РАН. Оценивали долю (%) отклонения от индивидуальной физиологической нормы.
Статистическая обработка выполнена с помощью программного пакета Statistica 10.0 (StatSoft, США) c использованием описательной статистики и непараметрических методов анализа.
РЕЗУЛЬТАТЫ
Структура пищевого поведения пациентов с начальными проявлениями БП представлена в таблице.
Таблица
Отклонение от индивидуальной физиологической нормы потребления основных нутриентов у пациентов с начальными проявлениями болезни Паркинсона (n = 65)
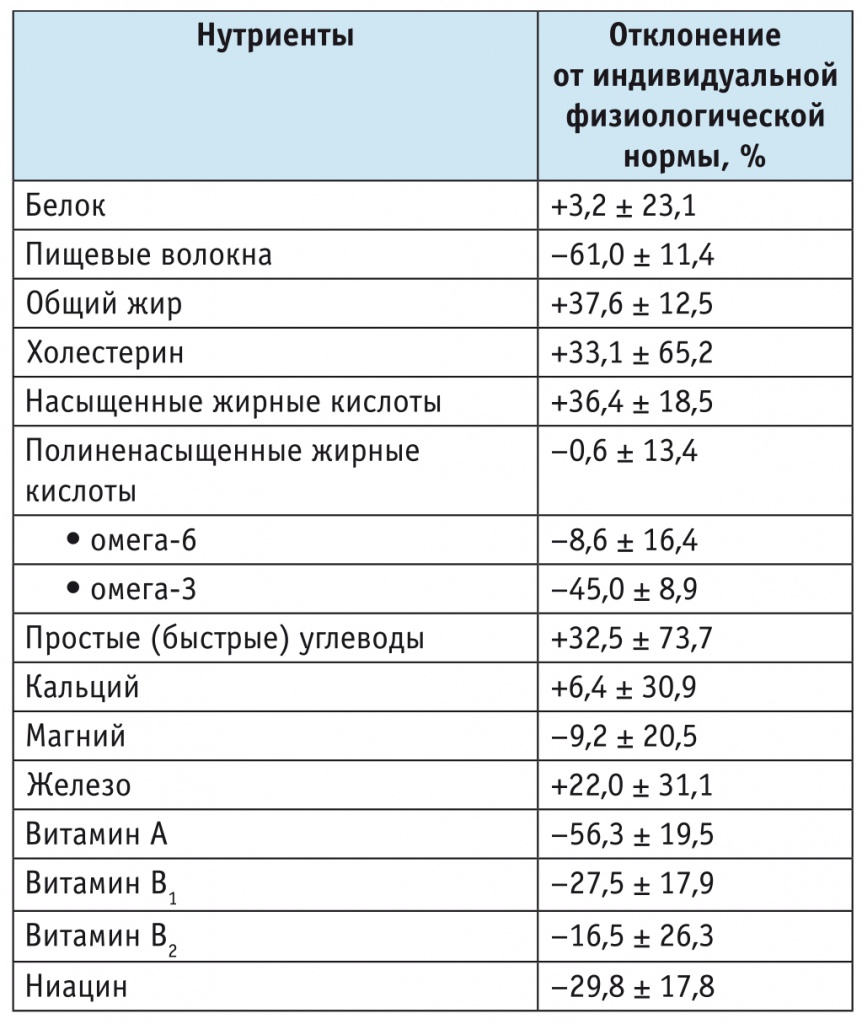
Примечание. Данные представлены в форме M ± SE, где M — среднее значение, SE — стандартная ошибка среднего.
Как видно из таблицы, пищевое поведение пациентов с начальными стадиями БП характеризовалось избыточным потреблением жиров (+37,6%), преимущественно за счет насыщенных жирных кислот (+36,4%); при этом наблюдался дефицит потребления полиненасыщенных жирных кислот, в первую очередь группы омега-3 (–45,0%). В спектре углеводов отмечалось избыточное потребление простых (быстрых) углеводов (+32,5%). Наряду с этим выявлен выраженный дефицит потребления пищевых волокон (–61,0%). Среди витаминов наиболее выраженный дефицит обнаружен в потреблении витамина А (–56,3%). В группе минералов наблюдались избыточное потребление железа (+22,0%), тенденция к увеличению потребления кальция (+6,4%) и к дефициту — магния (–9,2%).
Таким образом, паттерн пищевого поведения пациентов с начальными проявлениями БП не был сбалансированным по основным нутриентам и характеризовался избыточным потреблением жиров за счет насыщенных жирных кислот при дефиците полиненасыщенных (особенно омега-3) и избыточным потреблением простых углеводов на фоне выраженного дефицита употребления в пищу пищевых волокон. Подобная структура пищевого поведения может отражать адаптацию к изменению метаболизма при БП[7]: повышению скорости окисления жиров и углеводов на фоне повышенного уровня основного обмена.
Отмечался дефицит потребления витаминов, среди которых дефицит витамина А был максимальным. Спектр потребления микроэлементов характеризовался избыточным потреблением железа и кальция при тенденции к уменьшению потребления магния, что, по ряду данных, может являться фактором риска развития заболевания[21, 22].
Традиционный подход к коррекции метаболических нарушений включает в себя рекомендации по построению изокалорийного рациона с учетом индивидуальных физиологических потребностей организма. Основываясь на полученных данных, пациентам с повышенным уровнем основного обмена можно дать следующие диетологические рекомендации: 1) надо стремиться к соблюдению принципа изокалорийности питания; 2) при этом необходимо изменить структуру рациона в виде уменьшения потребления насыщенных жирных кислот и увеличения потребления омега-6 и, особенно, омега-3 полиненасыщенных жирных кислот, увеличения квоты медленных углеводов и редукции моно- и дисахаридов; 3) следует повысить потребление пищевых волокон, витамина А; 4) желательно увеличить в рационе квоты магния, а также исключить избыточное потребление железа и кальция.
ЗАКЛЮЧЕНИЕ
Анализ структуры пищевого поведения пациентов с начальными проявлениями болезни Паркинсона (БП) показал отклонения от индивидуальных физиологических потребностей, что требует диетологической коррекции с последующей оценкой ее эффективности.
Оценка питания с дальнейшим назначением индивидуальной диетологической коррекции должна быть частью обычной работы при ведении пациентов с БП, которая позволит улучшить пищевой статус, нормализовать массу тела и повысить качество жизни пациентов[26]. Это имеет большое значение в рамках комплексного подхода к ведению пациентов с неуклонно прогрессирующим нейродегенеративным заболеванием.








