Для описания динамики изменения концентрации лекарственного средства в ткани необходимо использовать диффузионный подход. В качестве источников, как правило, выступают малые сосуды и средние капилляры. Ранее было показано, что симметричность геометрии элементарной бифуркации в значительной степени влияет на падение содержания метаболитов в прилегающих тканях [3]. Данное обстоятельство может являться существенным фактором при формировании локального ишемического очага [4]. В то же время возникает вопрос: возможно ли сформулировать общие закономерности для градиента медиатора, метаболита или ксенобиотика, возникающего вблизи сосуда, которые позволили бы предсказать превышение некоторого порогового значения концентрации в ткани. В данной работе предложен наглядный и простой способ оценки подобной ситуации на основании сопоставления физико-химических параметров.
Цель исследования: выявить общие закономерности формирования в ткани области, содержащей лекарственный препарат в концентрации, превышающей пороговую.
МАТЕРИАЛЫ И МЕТОДЫ
Для получения общих зависимостей было использовано моделирование пространственно-временного распределения концентрации химического соединения в локальной области на примере универсального трехмерного фантома (рис. 1). В качестве математической постановки задачи применялась первая краевая задача для однородного уравнения диффузии с линейным стоком, решение которой для фантома биологического объекта было подробно описано ранее [5].
Рис. 1. Схематическое изображение универсального трехмерного виртуального фантома локальной области ткани. В качестве элементарного источника диффузии рассматривается сфера заданного радиуса — r0. Значения концентрации лекарственного средства оцениваются в узлах сетки из пространства диффузии. Сетка однородна и пересекает как пространство диффузии, так и область источника
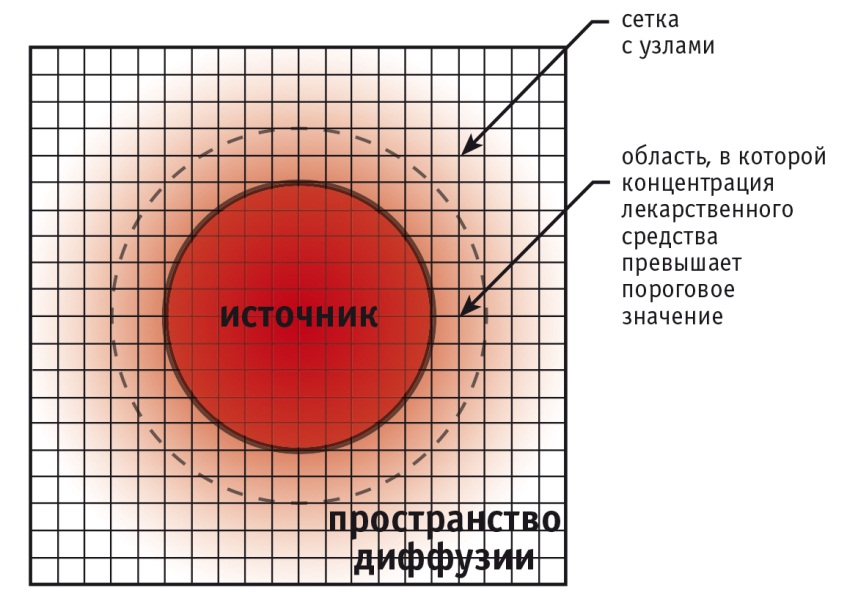
Предполагалось, что на поверхности источника (источников) наблюдается однородное распределение лекарственного средства, приводящее к некоторому постоянному значению — Xo. Пороговое значение концентрации в области ткани обозначали как Xth. Область рассматриваемого биологического объекта (ρth), в которой концентрация лекарственного средства превышала пороговое значение, оценивали как отношение количества узлов трехмерной сетки (Nth) к общему числу узлов пространства диффузии (NΛ). Долю источников (ρϖ) определяли как отношение узлов сетки, попадающих в область источников (Nω), к общему числу узлов (Ntotal = NΛ + Nω). В качестве простейших параметров среды использовали коэффициент диффузии — D, коэффициент поглощения лекарственного средства тканью — k, а также радиус элементарного сферического источника — r0. Для наглядности выявления закономерности применяли безразмерный параметр, предложенный ранее [5]:
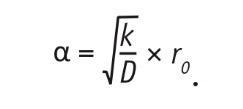
На основе полученных объемных пространственно-временных градиентов концентрации лекарственного средства проводили расчет доли узлов сетки с превышением значения Xth.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Зависимость доли узлов сетки пространства диффузии фантома, в которых концентрация лекарственного средства превышает некоторое пороговое значение, как функция от α, Xth и ρϖ представлена на рисунке 2.
Рис. 2. Зависимость доли узлов сетки пространства диффузии (ρth), в которых концентрация лекарственного средства превышает пороговое значение, от α и относительной пороговой концентрации (Xth/Xo) (А) и от α и доли пространства фантома, занимаемого источником (ρϖ) (Б)
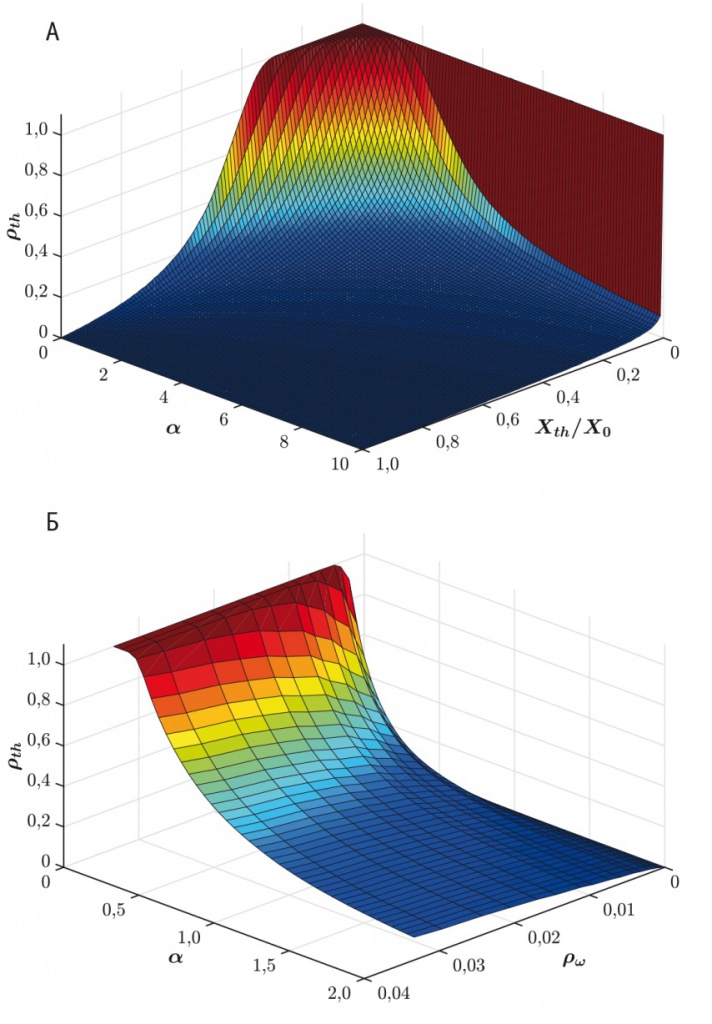
В выбранной постановке задачи в любой точке фантома концентрация лекарственного средства не может превысить значение Xo. Данное обстоятельство не ограничивает общности рассуждений, но позволяет наглядно продемонстрировать, что при высокой способности вещества диффундировать и при низком его поглощении тканью (высокое значение D, низкое значение k — низкое значение α) даже относительно высокая пороговая концентрация будет достигаться в большей части фантома. Если же среда существенным образом «противится» формированию градиента (α > 1), то в большом количестве узлов будут достигаться только относительно невысокие концентрации. Чтобы добиться такого же эффекта, как и для легко диффундирующего соединения, необходимо существенно увеличить значение Xo.
Еще одним способом добиться расширения области с концентрацией выше пороговой является увеличение доли источника в фантоме, однако влияние данного параметра на представленность лекарственного средства в рассматриваемом образце в значительной степени уменьшается при возрастании α.
Полученные результаты указывают на существенное влияние масштаба диффузионного процесса на достижение более высокой концентрации. В частности, для препаратов с высоким
Таблица
Экспериментальные значения коэффициентов диффузии и константы поглощения лекарственных средств в различных тканях
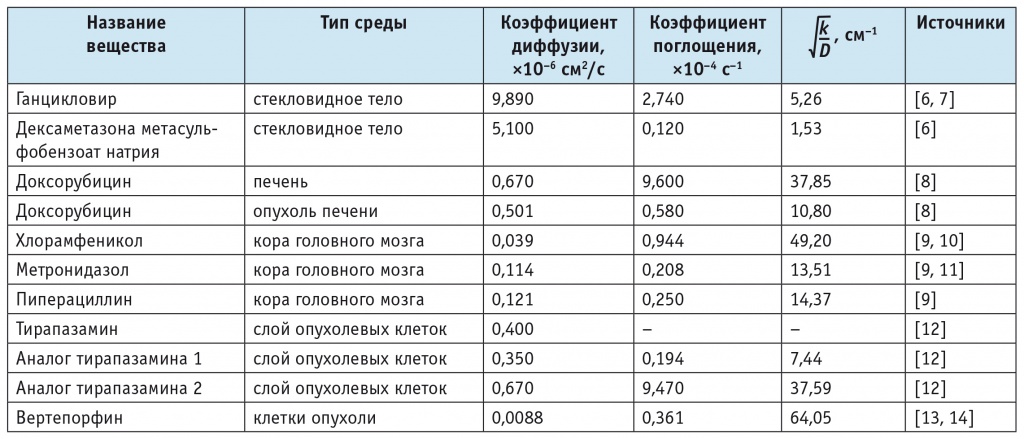
Примечание. D — коэффициент диффузии; k — коэффициент поглощения лекарственного средства тканью.
Вопросы моделирования диффузии лекарственных препаратов в организме человека и животного являются важнейшим аспектом разработки лекарственных средств, и сегодня существует целый комплекс подходов к оценке выбора моделей в зависимости от вида лекарственной формы [15]. Представленный в работе подход позволяет дать простую рекомендацию практикующим врачам: если лекарственные средства принадлежат к одному классу химических соединений (являются производными какого-то одного соединения), наилучшим выбором для поддержания порогового содержания в ткани пациента будет препарат с наименьшим поглощением. Данное утверждение в первую очередь относится к препаратам с длительным курсом приема.
На основании полученных в работе результатов можно наглядно объяснить особенности применения психотропных препаратов. По мере проведения курса лечения подобными лекарственными средствами в ткани мозга происходит активация различных (в том числе неспецифических) систем, окисляющих ксенобиотики [16]. При неизменных остальных физико-химических параметрах это приводит к росту поглощения и, как следствие, к увеличению α, что, в свою очередь, обусловливает уменьшение области ткани, содержащей лекарственное средство в концентрации выше порогового значения. Для компенсации подобного эффекта, как упоминалось выше, необходимо увеличивать Xo, а это означает повышение дозы лекарства, принимаемого пациентом. Данное заключение полностью подтверждается результатами клинических наблюдений, в частности у больных, получавших терапию трициклическими антидепрессантами [17].
ЗАКЛЮЧЕНИЕ
Проведенный в работе теоретический анализ показал, что для получения терапевтического эффекта от лекарственного средства в определенной локальной области необходимо не только увеличивать дозу введения, но и применять химические соединения с оптимальным сочетанием диффузионных свойств.








