Эпидемический характер распространения сахарного диабета (СД) и предиабета в современной популяции отмечен экспертами ВОЗ, давшими прогноз о росте количества таких пациентов к 2030 г. до 552 млн человек, при этом отмечено, что более 90% из них составят больные СД 2 типа[24]. Основной причиной смерти пациентов с нарушениями углеводного обмена являются сосудистые осложнения, в том числе цереброваскулярные — инсульты и хроническая ишемия мозга[15]. СД также является самостоятельным фактором риска развития нарушений мозгового кровообращения, независимо от других факторов риска (АГ и повышение уровня холестерина). Отмечено, что у пациентов с СД хуже протекает процесс восстановления после инсульта[9, 27]. Анализ связи СД с увеличением частоты постинсультной деменции показал, что причинами ее могут быть характерное для СД поражение церебральных сосудов, ухудшающее восстановление после инсульта, а также обусловленный гипергликемией тканевой ацидоз, усиливающий повреждение нейронов[19]. Кроме этого, значимую негативную роль в нейрореабилитационном процессе играют диабетическая полинейропатия и связанные с ней нарушения равновесия. Диабетическая полинейропатия — одно из самых распространенных осложнений СД, наблюдающееся почти у половины больных, — препятствует адекватному восстановлению двигательных функций после инсульта, приводит к нарушению равновесия и падениям[18].
Реабилитация больных после инсульта не исчерпывается мероприятиями по восстановлению двигательных функций. Необходимость проведения реабилитации обусловливают также нарушения речи (различные афазии) и других высших корковых функций, сенсорные расстройства, дисфагия, зрительные нарушения и др.[17]. Афазии наблюдаются более чем у трети больных, перенесших инсульт, локализующийся в левой гемисфере, и в 70% случаев сочетаются с парезом мышц языка, т. е. речевые нарушения имеют сложное патогенетическое происхождение, что требует комплексного реабилитационного подхода.
К основным принципам реабилитации больных, перенесших инсульт, следует отнести раннее начало восстановительных мероприятий с активизацией пациента, мультидисциплинарный подход, непрерывность, последовательность и преемственность на всех реабилитационных этапах. Основным методом реабилитации больных с постинсультными речевыми нарушениями являются длительные и систематические психолого-педагогические коррекционные занятия (индивидуальные и коллективные), которые могут вести нейродефектологи (логопеды-афазиологи) и нейропсихологи[4, 12].
Занятия по восстановлению речи рекомендуется проводить на фоне приема ноотропных препаратов, оказывающих активирующее влияние на интегративные функции мозга: речь, память, внимание, способность к обучению. К медикаментозным средствам, доказавшим свою эффективность в нейрореабилитации, относят Церебролизин, холина альфосцерат, мемантин и пирацетам[4, 5, 12]. Учитывая, что в основе реабилитации лежит нейропластичность — способность мозга изменять свою функциональную и структурную организацию, а также способность различных его структур вовлекаться в разные формы деятельности под действием собственных нейротрофических факторов, — предпочтительными могут считаться препараты с доказанным нейротрофическим эффектом[2, 4]. Представителем данной группы является Церебролизин — единственный ноотропный пептидергический препарат с доказанной in vitro и in vivo нейронспецифической нейротрофической активностью, аналогичной действию собственных нейротрофических факторов[2, 4, 20, 29]. Благодаря современным методам идентификации веществ (к числу которых относятся иммунологические методы с применением антител, высокоэффективная жидкостная хроматография, масс-спектрометрия), продемонстрировано, что в Церебролизине содержатся более 100 биологически активных олигопептидов, которые обладают структурным сходством с нейротрофическими факторами: цилиарным нейротрофическим фактором, нейротрофическим фактором глиальных клеток, инсулиноподобными факторами роста 1 и 2 и фактором роста нервов (nerve growth factor — NGF)[2, 3].
Помимо содержания фрагментов нейротрофических факторов в своем составе, Церебролизин оказывает модулирующее действие на секрецию собственных нейротрофинов человека. Так, в недавних исследованиях с моделируемой болезнью Альцгеймера была продемонстрирована способность Церебролизина модулировать соотношение про- и зрелых собственных нейротрофинов, что прямо свидетельствует о нейротрофической регуляции[25]. Существуют данные о том, что препарат способен увеличивать связывание нейротрофичеcкого фактора мозга (brain-derived neurotrophic factor — BDNF) с рецепторами тирозинкиназы В, усиливая тем самым сигналы «выживания» нервных клеток, а также повышать содержание BDNF в сыворотке крови у больных после травм и у пациентов с постинсультной афазией[7, 10, 23]. Для пациентов с СД важно, что реализация одного из многих механизмов нейропротективного эффекта Церебролизина происходит путем увеличения транспорта глюкозы через гематоэнцефалический барьер, — это показано в целой серии работ. Выявлено, что Церебролизин регулирует экспрессию гена — транспортера глюкозы GLUT1, причем регуляция носит дозозависимый характер[16, 21].
NGF — секретируемый белок семейства нейротрофинов, поддерживающий жизнеспособность нейронов, стимулирующий их развитие и активность. Он был идентифицирован первым из всех известных факторов роста. Рита Леви-Монтальчини и Стэнли Коэн обнаружили NGF в 1950-х годах, что было отмечено Нобелевской премией по физиологии и медицине в 1986 г.[2, 21]. В процессе исследований было также показано, что NGF участвует в патогенезе неврологических осложнений СД[6, 14, 26].
Несмотря на то что хорошо известно о широкой распространенности углеводных нарушений в популяции больных с инсультом и о неблагоприятном влиянии данных нарушений на прогноз пациента, на сегодняшний день отсутствуют исследования, учитывающие данный преморбидный статус у пациентов с постинсультной афазией, а также его возможное влияние на эффективность реабилитационных мероприятий.
Целью настоящего открытого рандомизированного контролируемого исследования явилось изучение динамики восстановления речевых функций и концентрации NGF у пациентов с углеводными нарушениями или без таковых, перенесших ишемический инсульт (ИИ) в левом полушарии головного мозга, на фоне применения Церебролизина.
МАТЕРИАЛЫ И МЕТОДЫ
В исследовании приняли участие 60 пациентов (31 мужчина и 29 женщин), которые после первого ИИ поступили на реабилитацию в стационарное отделение с круглосуточным пребыванием Центра патологии речи и нейрореабилитации Департамента здравоохранения города Москвы (научный руководитель Центра — докт. психол. наук, академик РАО, профессор В. М. Шкловский). На момент развития инсульта больные находились в возрасте от 45 до 75 лет (Ме — 63 года; интерквартильный размах — 57–68 лет).
Критерии включения в исследование:
- первый ИИ в бассейне левой средней мозговой артерии;
- верифицированный данными МРТ/КТ головного мозга (допускалось наличие признаков хронической ишемии головного мозга и указаний на возможное перенесение транзиторных ишемических атак);
- госпитализация в период от 1 месяца до 1 года после развития ИИ;
- допускалось наличие нарушений углеводного обмена: СД 2 типа, пониженной толерантности к глюкозе, нарушенной гликемии натощак. В исследование включались пациенты как с нарушениями углеводного обмена, так и без таковых.
Критерии исключения из исследования:
- повторный ИИ;
- локализация очага не в доминантном полушарии головного мозга;
- паренхиматозное либо субарахноидальное кровоизлияние;
- эпилептический синдром в анамнезе или в структуре настоящего заболевания;
- приверженность к алкоголю;
- установленная гиперчувствительность к компонентам Церебролизина.
В отделении на протяжении периода реабилитации все пациенты наблюдались врачами-специалистами: неврологом, терапевтом, психиатром, эндокринологом. Всем пациентам, включенным в исследование, было выполнено обследование, включавшее:
- антропометрические измерения: определение веса, роста, расчет ИМТ, измерение окружности бедер и окружности талии;
- ЭКГ в 12 стандартных отведениях;
- ЭЭГ по стандартной методике для исключения эпилептических паттернов;
- дуплексное сканирование брахиоцефальных артерий;
- МРТ для верификации очагового поражения головного мозга, анализа топики и размеров постинсультных изменений, выявления признаков хронической ишемии;
- двукратное исследование NGF (в начале курса лечения и по его завершении).
Всем пациентам, включенным в исследование, было выполнено двукратное нейропсихологическое обследование высших психических функций (ВПФ) с выделением форм афазии и количественной оценкой речи (КОР) в баллах, что отражает степень выраженности речевых нарушений. Нейропсихологическое исследование состояния ВПФ проводилось в русле методологии А. Р. Лурии — в соответствии с представлениями о системной динамической локализации ВПФ и с применением принципа синдромного анализа[6, 13]. Для стандартизации нейропсихологических проб была использована «Карта нейропсихологического исследования больных с нарушениями высших психических функций»[8]. При количественном анализе выраженности речевых нарушений применялась «Методика количественной оценки речи при афазии»[1].
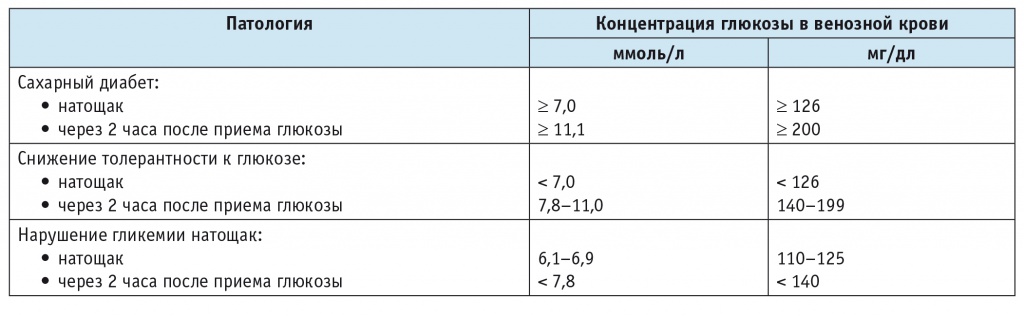
Углеводные нарушения диагностировали согласно алгоритму, предложенному Ассоциацией эндокринологов РФ (табл. 1).
Таблица 1
Диагностические критерии сахарного диабета и других состояний гипергликемии
Курс нейрореабилитационного лечения для каждого пациента составлял 45 дней и был основан на комплексном междисциплинарном подходе. Все пациенты ежедневно получали базовую медикаментозную терапию основных сердечно-сосудистых, эндокринных, неврологических заболеваний. Ежедневно проводились занятия лечебной физкультурой, массаж, физиопроцедуры, а также обязательные индивидуальные и групповые занятия с нейродефектологами и нейропсихологами.
В зависимости от наличия или отсутствия углеводных нарушений пациенты составили две группы:
- с углеводными нарушениями (группа А, n = 30);
- без углеводных нарушений (группа Б, n = 30).
Далее участники каждой группы методом конвертов были рандомизированы в подгруппы: А1 (с углеводными нарушениями, n = 15) и Б1 (без углеводных нарушений, n = 15), где в комплекс нейрореабилитации был включен Церебролизин (20 мл/100 мл физиологического раствора в/в, 5 дней в неделю на протяжении 4 недель), и А2 (с углеводными нарушениями, n = 15) и Б2 (без углеводных нарушений, n = 15), где Церебролизин не применялся.
Исследование выполнено в соответствии с Хельсинкской декларацией, принятой в июне 1964 г. и пересмотренной в октябре 2000 г. (Эдинбург, Шотландия). От каждого пациента было получено информированное согласие.
Статистическая обработка результатов осуществлялась с применением пакета анализа Microsoft Excel, а также при помощи пакета программ Statistica 6.0. Распределения количественных данных, отличные от нормального, описывали с указанием медианы (Ме) и интерквартильного размаха в виде 25-го и 75-го процентилей. Значимость различий оценивали по методу вариационной статистики с использованием критериев Манна — Уитни, Краскела — Уоллиса и Данна для независимых выборок и критерия Уилкоксона для парных случаев непараметрических распределений. Различия считали статистически значимыми при значениях p < 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
По данным первичного анализа нарушений различных видов речевой деятельности и количественной оценки степени выраженности речевых нарушений очень грубая выраженность афазии выявлена у 12 пациентов (20,0%), грубая — у 6 (10,0%), средняя — у 39 (65,0%), легкая степень — у 3 пациентов (5,0%). В конце цикла нейрореабилитации, согласно оценочным критериям[8], была проведена повторная КОР в баллах, в результате чего были получены интервалы, соответствовавшие разным вариантам улучшений, подробно описанным в нашей предыдущей публикации[10]. Следует отметить, что по баллам КОР лучшие показатели восстановления речи были достигнуты в подгруппах пациентов, получавших Церебролизин. Данная терапия оказалась наиболее эффективной у больных с очень грубыми и грубыми речевыми нарушениями, о чем свидетельствовало максимально возможное улучшение состояния речи за первый проведенный курс нейрореабилитационных мероприятий у этих пациентов. Важным результатом явилось получение подтверждения эффективности терапии Церебролизином у пациентов как с нарушениями углеводного обмена, так и без таковых[10].
Результаты реабилитационного процесса оценивали также в комплексе с количественным определением концентрации NGF (табл. 2, рис. 1–3).
Таблица 2
Динамика изменения концентрации фактора роста нервов в группах 1 и 2, пг/мл

* P < 0,01 при сравнении с исходным значением (критерий Уилкоксона).
** P < 0,03 — при сравнении с контролем (критерий Манна — Уитни).
Примечание. Здесь и на рисунках 1–3 данные приведены в виде Ме и 25-го и 75-го процентилей.
Рис. 1. Динамика изменения концентрации фактора роста нервов в группе, получавшей терапию Церебролизином, и в контрольной группе, пг/мл.
* Критерий Уилкоксона.
** Критерий Манна — Уитни
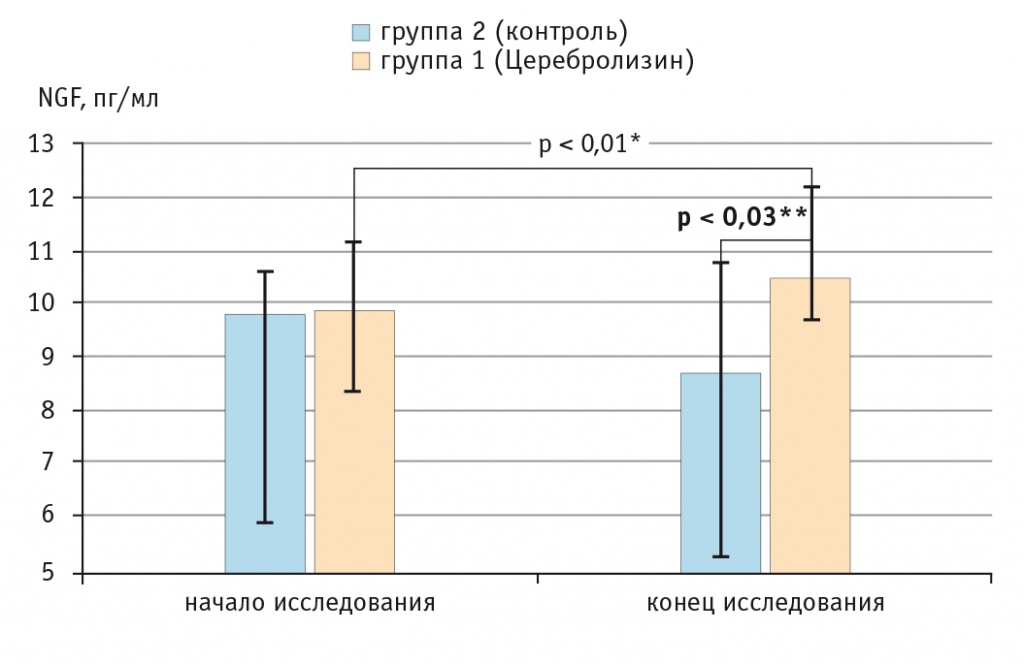
Рис. 2. Динамика изменения концентрации фактора роста нервов в зависимости от наличия или отсутствия углеводных нарушений, пг/мл.
* Критерий Уилкоксона.
** Критерий Данна
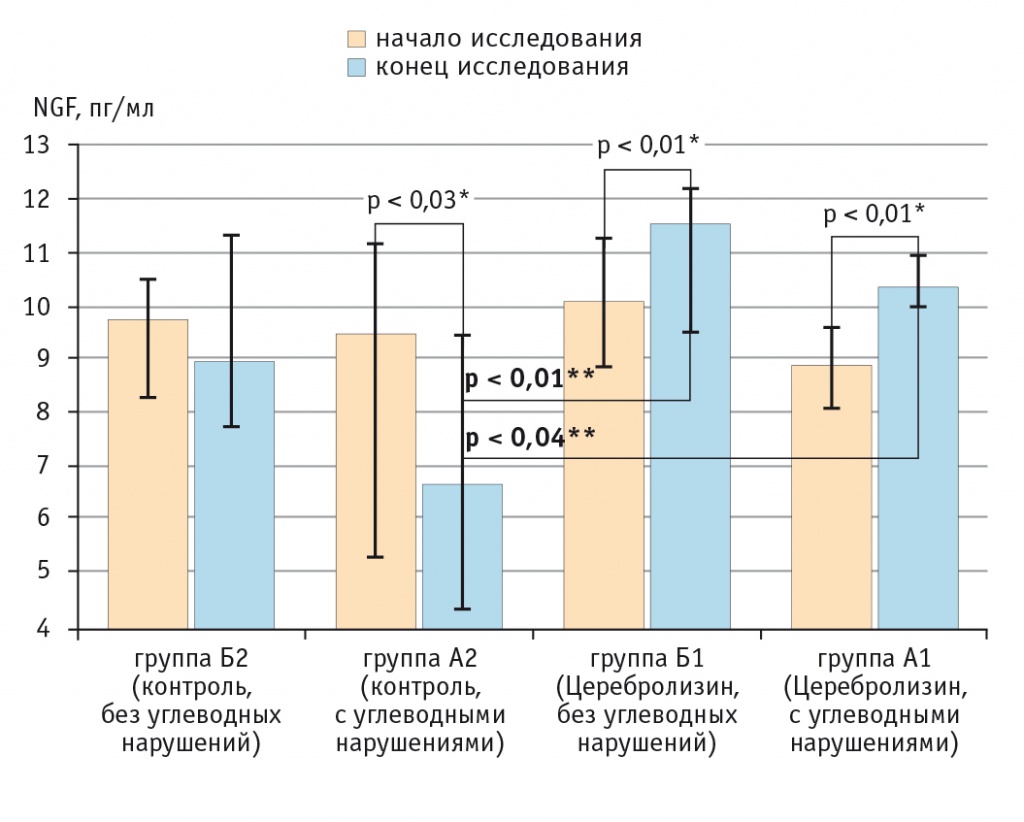
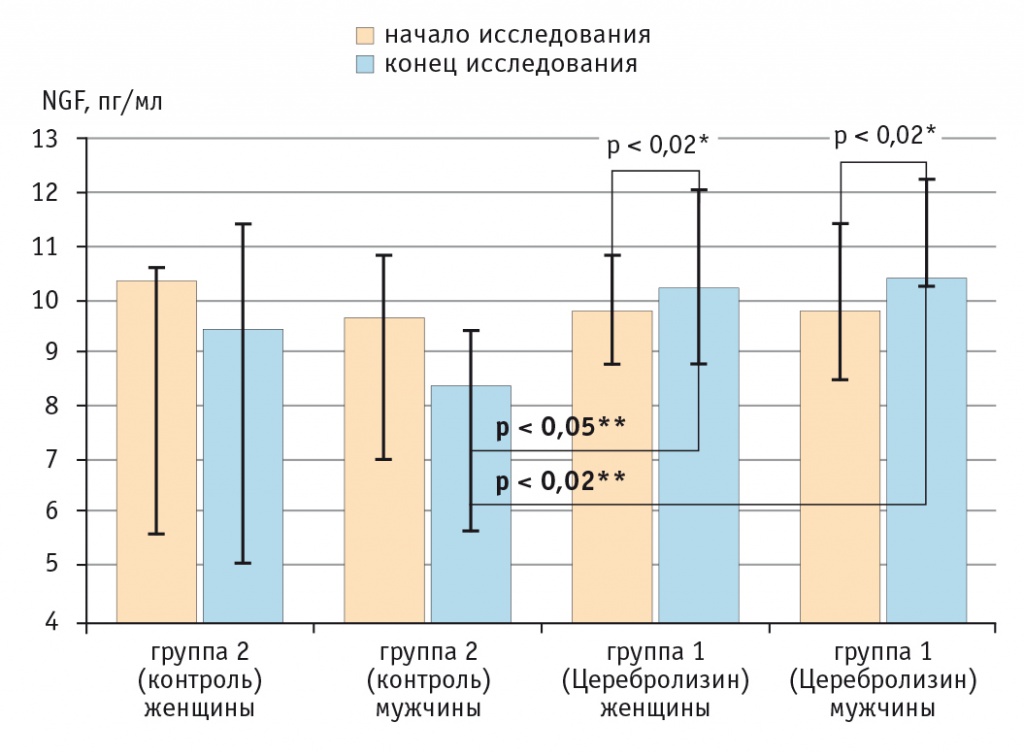
Рис. 3. Динамика изменения концентрации фактора роста нервов в зависимости от пола пациента, пг/мл.
* Критерий Уилкоксона.
** Критерий Данна
Как видно из данных, представленных в таблице 2 и на рисунке 1, исходно группы 1 (с применением Церебролизина) и 2 (без использования Церебролизина) не имели статистически значимых различий по концентрации NGF (p > 0,05, критерий Манна — Уитни). В ходе лечения между группами была замечена разница по этому показателю, которая к концу лечения приобрела значимый характер (p < 0,03, критерий Манна — Уитни). Сравнение значений концентрации NGF в группах 1 и 2 до и после лечения показало, что в группе 1 произошел ее рост на 6,6% (p < 0,01, критерий Уилкоксона), а в группе 2 — снижение на 11,3% (p > 0,05, критерий Уилкоксона).
На основании полученных данных можно сделать вывод о том, что включение в терапию нейрореабилитационного периода препарата Церебролизин (20 мл/100 мл физиологического раствора в/в, 5 дней в неделю на протяжении 4 недель) приводит к статистически значимому увеличению концентрации NGF; как показано в недавних исследованиях, это может способствовать повышению восстановительного потенциала[2, 3, 10, 20, 23, 25, 29].
На рисунке 2 представлены результаты исследования динамики концентрации NGF в подгруппах пациентов, имевших нарушения углеводного обмена (А1 и А2), и больных без углеводных нарушений (Б1 и Б2). В начале лечения подгруппы не различались между собой по данному параметру (p > 0,05, критерий Краскела — Уоллиса), но сравнение после лечения показало наличие значимой разницы (p < 0,01, критерий Краскела — Уоллиса). Множественное сравнение с использованием критерия Данна после окончания терапии выявило статистически значимую разницу между подгруппами A1 и A2 (p < 0,04), Б1 и A2 (p < 0,01).
На рисунке 2 показаны также концентрации NGF в каждой подгруппе до и после лечения с оценкой их изменений по критерию Уилкоксона: A1 — увеличение на 17,6% (p < 0,01), Б1 — увеличение на 13,9% (p < 0,01), А2 — снижение на 41,1% (p < 0,03), Б2 — снижение на 9,2% (p > 0,05). Тот факт что в группе 1 отмечен статистически значимый рост концентрации NGF вне зависимости от наличия или отсутствия углеводных нарушений, может свидетельствовать о равной эффективности терапии Церебролизином в обеих подгруппах. Изменения концентрации NGF в группе 2 при наличии и отсутствии углеводных нарушений указывают на большее снижение концентрации NGF под влиянием углеводных нарушений, что может быть связано с худшим прогнозом восстановления таких пациентов. В ранних исследованиях отмечено значимое влияние снижения концентрации NGF на развитие неврологических осложнений СД, а также предположительно оценена позитивная роль терапии Церебролизином у таких пациентов[1, 14, 21, 22, 26, 28].
Возможность оценить эффективность любого терапевтического вмешательства в зависимости от пола пациента с постинсультной афазией представляет сегодня особенную ценность, учитывая участившиеся расхождения в научных данных, особенно в отношении женщин[11]. На рисунке 3 представлены изменения концентрации NGF у мужчин и женщин групп 1 и 2. Сравнение между данными подгруппами с использованием критерия Краскела — Уоллиса не показало различий в концентрации NGF в начале исследования (p > 0,05). Измерение концентрации NGF в конце наблюдения выявило наличие статистически значимой разницы между гендерными подгруппами (p < 0,02, критерий Краскела — Уоллиса), поэтому было произведено множественное попарное сравнение с использованием критерия Данна. В результате были получены значимые различия между подгруппами 1 (мужчины) и 2 (мужчины) (p < 0,02), а также между подгруппой 1 (женщины) и подгруппой 2 (мужчины) (p < 0,05). Концентрация NGF в группе 1 у мужчин и женщин значимо возросла (p < 0,02, критерий Уилкоксона), а в группе 2 у мужчин и женщин произошло снижение этого параметра, не имевшее статистической значимости (p > 0,05, критерий Уилкоксона) (см. рис. 3). Отсутствие разницы между подгруппами 1 (мужчины) и 1 (женщины) в начале и в конце терапии указывает на то, что влияние терапии Церебролизином на рост концентрации NGF не зависит от пола пациента.
На основании полученных в данном исследовании результатов можно сделать вывод о клинической эффективности применения Церебролизина (20 мл/100 мл физиологического раствора в/в, 5 дней в неделю на протяжении 4 недель) в дополнение к стандартному курсу нейрореабилитационных мероприятий у пациентов с постинсультной афазией разной степени выраженности. Данная терапия оказалась наиболее эффективной у больных с очень грубыми и грубыми речевыми нарушениями, о чем свидетельствовало максимально возможное улучшение состояния речи у этих пациентов за проведенный курс нейрореабилитационных мероприятий. Наличие нарушений углеводного обмена не влияло на эффективность терапии Церебролизином[10].
Оценка динамического изменения концентрации NGF у пациентов, включенных в исследование, показала зависимость выраженного снижения концентрации NGF от наличия углеводных нарушений. В то же время, по полученным данным, включение в терапию нейрореабилитационного периода препарата Церебролизин приводит к значимому увеличению концентрации NGF вне зависимости от наличия или отсутствия углеводных нарушений, что может способствовать увеличению восстановительного потенциала у таких пациентов. Отмечено также, что эффективность терапии Церебролизином не зависит от пола пациента.
ЗАКЛЮЧЕНИЕ
Полученные результаты свидетельствуют об улучшении прогноза реабилитации пациентов с постинсультной афазией разной степени выраженности на фоне включения в комплексную терапию препарата Церебролизин (20 мл/100 мл физиологического раствора в/в, 5 дней в неделю на протяжении 4 недель) как на фоне углеводных нарушений, так и без таковых.








