ВВЕДЕНИЕ
Гипоксия плода и асфиксия новорожденного встречается в 4–6% случаев от общего числа родов. Причинами возникновения данной патологии являются отягощенный акушерско-гинекологический анамнез у женщин, патологическое течение беременности, осложнения во время родов[1–3].
Патологическое течение беременности, родов и рождение ребенка с асфиксией могут привести к гипоксически-ишемической энцефалопатии (ГИЭ), а она ассоциируется не только с летальностью, но и с развитием таких заболеваний, как детский церебральный паралич, эпилепсия, минимальная мозговая дисфункция[3, 4]. Истинную частоту перинатальных поражений мозга нельзя считать установленной, что обусловлено нечеткостью критериев, позволяющих отличать неврологическую патологию у новорожденных от нормы, переходные состояния от нормы к патологии (девиантные состояния)[3]. Классификация перинатальных поражений нервной системы у новорожденных (2000), разработанная Российской ассоциацией специалистов перинатальной медицины[5], включает гипоксические повреждения головного мозга.
В настоящее время изучено множество патогенетических механизмов развития гипоксических повреждений головного мозга, которые в конечном счете приводят к отеку и гибели нейронов головного мозга[8, 17]. Значимая роль в патогенезе гипоксии отводится про- и противовоспалительным интерлейкинам, высвобождаемым в ЦНС микроглией. Активированные микроглиальные клетки и астроциты продуцируют различные иммуноактивные молекулы, такие как цитокины (интерлейкины), факторы роста и хемоаттрактанты.
Цитокины могут оказывать как провоспалительное, так и противовоспалительное действие[9, 15]. Они представляют собой систему полипептидных молекул, регулирующих многие жизненно важные процессы в организме, обеспечивающих защитные реакции против патогенов и восстановление гомеостаза[18].
Согласно ряду исследований, значительное увеличение содержания интерлейкинов, таких как ИЛ-1β, ИЛ-6, ИЛ-8, а также их дисбаланс с противовоспалительными цитокинами (например, ИЛ-4, ИЛ-10) коррелируют с тяжестью ишемического повреждения головного мозга[6–9]. Изучение их влияния на патогенез гипоксии как одного из механизмов повреждения головного мозга поможет усовершенствовать подходы к диагностике и прогнозированию возникновения заболевания у доношенных новорожденных.
Кроме цитокинов, рассматривают ряд других биохимических маркеров перинатального поражения ЦНС, исследование которых является перспективным. Один из них — нейронспецифическая енолаза (НСЕ). По сути, это основной нейронспецифический белок, изоформа фермента енолазы, которая находится в цитоплазме и дендритах нейронов. Она обнаруживается на относительно поздних стадиях нейрональной дифференцировки, с началом синаптогенеза, т. е. после 22-й недели беременности, и выполняет ферментативную функцию, участвуя в процессах гликолиза.
Согласно литературным данным, уровень НСЕ повышается при ишемии и травме мозга, эпилепсии, внутричерепных кровоизлияниях, судорогах в анамнезе. У многих неврологических больных уровень НСЕ нарастает даже после проведенной терапии, что говорит о разрушении нейронов[10].
Цель исследования: оценить биохимические маркеры повреждения головного мозга у доношенных новорожденных детей, перенесших внутриутробную гипоксию и/или асфиксию при рождении.
МАТЕРИАЛЫ И МЕТОДЫ
В проспективное когортное клиническое исследование включены 142 доношенных новорожденных ребенка, которые наблюдались в Забайкальском краевом перинатальном центре и Перинатальном центре Краевой клинической больницы г. Читы в период с 2017 по 2018 г.
В ходе исследования дети были разделены на две группы: 1-я (основная) группа (n = 90) — дети, перенесшие хроническую внутриутробную гипоксию и/или асфиксию при рождении, 2-я (группа контроля) (n = 52) — дети, родившиеся с оценкой 8 баллов и более по шкале Апгар и не испытавшие внутриутробную гипоксию.
Критериями включения в клиническое исследование являлись:
- доношенность;
- патогномоничные признаки хронической гипоксии плода и асфиксии при рождении;
- информированное добровольное согласие родителей на участие в исследовании.
Критерии исключения:
- недоношенность;
- наличие генерализованных инфекций;
- наличие хромосомных и генетических заболеваний;
- отказ родителей от участия в исследовании.
Хроническая внутриутробная гипоксия плода зафиксирована во время беременности, < 8 баллов по данным кардиотокографии (КТГ) (тахикардия плода, наличие децелераций, монотонный низковариабельный ритм, единичные акцелерации или их отсутствие), биофизического профиля плода (суммарная оценка < 8 баллов), ультразвуковой допплерографии (нарушение маточно-плацентарного кровотока 1В 2 ст.).
Диагноз асфиксии установлен, согласно методическому письму «Первичная и реанимационная помощь новорожденным детям»[12].
Дети 1-й группы были рождены на сроке гестации 39,37 ± 0,91 недели, имели среднюю массу тела 3188,1 ± 362,94 г, длину тела 51,20 ± 1,99 см. Дети 2-й группы родились на сроке 39,43 ± 0,81 недели гестации с массой тела 3371,9 ± 328,95 г, длиной тела 51,96 ± 1,22 см.
Диагноз ГИЭ ставили на основании комплекса анамнестических данных (особенностей течения беременности и родов, внутриутробного состояния плода, пособия в родах, медикаментозной терапии матери во время беременности и в родах, оценки состояния младенца по шкале Апгар при рождении) и анализа динамики клинических симптомов
у ребенка[5]. Клиническая диагностика ГИЭ основана на использовании клинических классификаций и стандартных неврологических шкал, которые позволяют разграничить нормальный и девиантный неврологический статус.
В рамках девиантного неврологического статуса необходимо дифференцировать адаптационные, транзиторные отклонения у младенца (транзиторную неврологическую дисфункцию новорожденного, к примеру) и клинические проявления ГИЭ[13].
Исследования проводились на основе собственных наблюдений и данных медицинской документации в соответствии с текущей версией Хельсинкской декларации по медицинским исследованиям[14].
Уровни интерлейкинов (ИЛ-1β, ИЛ-4, ИЛ-6, ИЛ-8) и НСЕ в пуповинной крови определяли методом ИФА («сэндвич»-методом) с использованием готовых наборов реактивов фирмы «Вектор-Бест» на аппарате Expert 96. Показатели ИЛ выражались в пг/мл, НСЕ — в нг/мл.
Статистическую обработку выполняли с помощью прикладных программ Excel и Statistica 10. Описательная статистика представлена в виде М ± σ, где М — среднее арифметическое значение, σ — стандартное отклонение; Ме — медиана с указанием 25-го и 75-го перцентилей, качественные признаки описаны в виде относительной частоты наблюдений (%). Использовались методы непараметрической статистики — критерии Манна — Уитни (U) и χ2 c поправкой Йетса. Результаты рассматривали как статистически значимые при р ≤ 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В основной группе возраст матерей составил 28,71 ± 5,06 года, в группе контроля — 28,70 ± 5,04 года. У 8 (8,9%) женщин основной группы беременность осложнилась развитием преэклампсии, в группе сравнения такого не встречалось. Угроза прерывания беременности наблюдалась у 15 (16,7%) женщин основной группы и у 4 (7,7%) в группе контроля (р > 0,05).
Обвитие пуповиной произошло у 26 (28,8%) новорожденных основной группы и у 11 (21,1%) из группы контроля (р > 0,05). Только в основной группе отмечались острый дистресс плода (n = 11 (12,2%), р < 0,05) и преждевременная отслойка нормально расположенной плаценты (n = 4; 4,4%).
Во время родов у 9 (10%) женщин 1-й группы отмечалась родовая слабость, во 2-й группе был лишь один такой случай. Зеленые околоплодные воды диагностировали у 14 (15,5%) рожениц основной группы, в группе контроля данная патология не зафиксирована (р < 0,05). Более серьезным осложнением беременности в основной группе стала хроническая фетоплацентарная недостаточность (ХФПН), которая встречалась у 69 (76,6%) матерей, в группе контроля женщин с таким диагнозом не было (р < 0,05).
Развившаяся ХФПН (субкомпенсированная форма) в 1-й группе способствовала развитию хронической внутриутробной гипоксии плода в 61 (67,8%) случае. При ХФПН снижается транспорт кислорода и питательных веществ к плоду, что приводит к задержке его роста. В результате в основной группе диагнозы «малый» и «маловесный к сроку гестации» выставлены 11 младенцам (12,2%), в группе контроля — одному ребенку (1,9%) (р > 0,05). Этот ребенок родился маловесным (вес при рождении — 2446 г, рост — 49 см) скорее всего в силу конституциональных причин, поскольку другие причины задержки развития плода были исключены.
На момент родов у беременных женщин основной группы выявлено нарушение маточно-плацентарного кровообращения (по данным КТГ, биофизического профиля плода, УЗИ с допплерографией), которое стало поводом для оперативных родов у 44 (48,9%) матерей, что значимо чаще, чем в группе контроля (n = 8 (15,3%), р < 0,05). В группе контроля причинами кесарева сечения оказались крупный размер плода и узкий таз рожениц.
В 1-й группе 46 (51,1%) детей родились с асфиксией, средняя оценка по шкале Апгар на 1-й минуте жизни составила 6,8 ± 1,85 балла, на 5-й минуте — 7,9 ± 1,37 балла. В группе контроля оценка по шкале Апгар — 8,8 ± 0,74 балла и 9,2 ± 0,66 балла соответственно.
Клиническая картина раннего неонатального периода в основной группе характеризовалась изменением мышечного тонуса (гипотонией/дистонией), гипорефлексией и снижением двигательной активности у 48 (53,3%) младенцев, в группе контроля — у 19 (36,5%) (p < 0,05). У 8 (8,9%) детей основной группы был патологический гипертонус в конечностях, в группе контроля такие дети отсутствовали. Синдром сниженной нервно-рефлекторной деятельности наблюдался у 14 (15,5%) новорожденных 1-й группы, во 2-й группе таких детей не было (p < 0,05).
Только в группе детей, испытавших гипоксию и/или асфиксию, отмечалась неврологическая симптоматика: судорожный синдром — у 3 (3,3%) новорожденных, синдром гипервозбудимости — у 13 (14,4%), очаговая симптоматика (асимметрия лица, отсутствие реакции зрачков на свет, глазная симптоматика) — у 3 (3,3%).
Анализ неврологического статуса младенцев группы контроля показал, что отклонения (изменение мышечного тонуса, снижение двигательной активности) носили транзиторный характер. К концу раннего неонатального периода младенцы имели физиологический неврологический статус.
По данным нейросонографии, у 22 (24,4%) детей с гипоксическими событиями встречался умеренный общий отек головного мозга (p < 0,05), у 12 (13,33%) — внутрижелудочковые кровоизлияния I степени. У младенцев группы контроля изменения при нейросонографии не отмечены.
В результате анализа особенностей течения беременности и родов, оценки по шкале Апгар, неврологической симптоматики и данных дополнительных методов исследования диагноз ГИЭ II степени поставлен 10 (11,1%) детям основной группы, ГИЭ I степени — 68 (75, 6%) новорожденным (при сравнении с группой контроля p < 0,05). Хочется отметить, что 12 (13,3%) детей основной группы после рождения и все дети группы контроля не имели клинического неврологического диагноза.
В основной группе у новорожденных была сопутствующая патология. Так, у 13 (14,4%) младенцев наблюдались заболевания органов дыхания — транзиторное тахипноэ и синдром аспирации мекония, чего не было в группе контроля (р < 0,05).
По данным ЭхоКГ, у 7 (7,8%) детей основной группы присутствовали изменения в сердечно-сосудистой системе: дилатация правого или левого отдела сердца, трикуспидальная регургитация, гипертрофия миокарда, ускорение кровотока в аорте. Данные изменения отмечались и в группе контроля у 5 (9,6%) детей (р > 0,05). Показаниями для проведения ЭхоКГ во 2-й группе явились изменения, по данным УЗИ, во время беременности либо шум у новорожденного ребенка над областью сердца при аускультации. Изменения на ЭхоКГ в обеих группах имели характер транзиторного нарушения гемодинамики и купировались к концу раннего неонатального периода.
Физиологическая гипербилирубинемия наблюдалась как в основной группе — у 18 (20%) новорожденных, так и в группе сравнения — 6 (11,5%) случаев (р > 0,05).
В обеих группах проведено иммунологическое исследование, определялись концентрации ИЛ-1β, ИЛ-4, ИЛ-6, ИЛ-8 и НСЕ в пуповинной крови, при этом выявлены статистически значимые различия между показателями в группах сравнения (табл.).
Таблица
Концентрации интерлейкинов (ИЛ) в пуповинной крови у новорожденных основной и контрольной групп, Ме (25; 75)
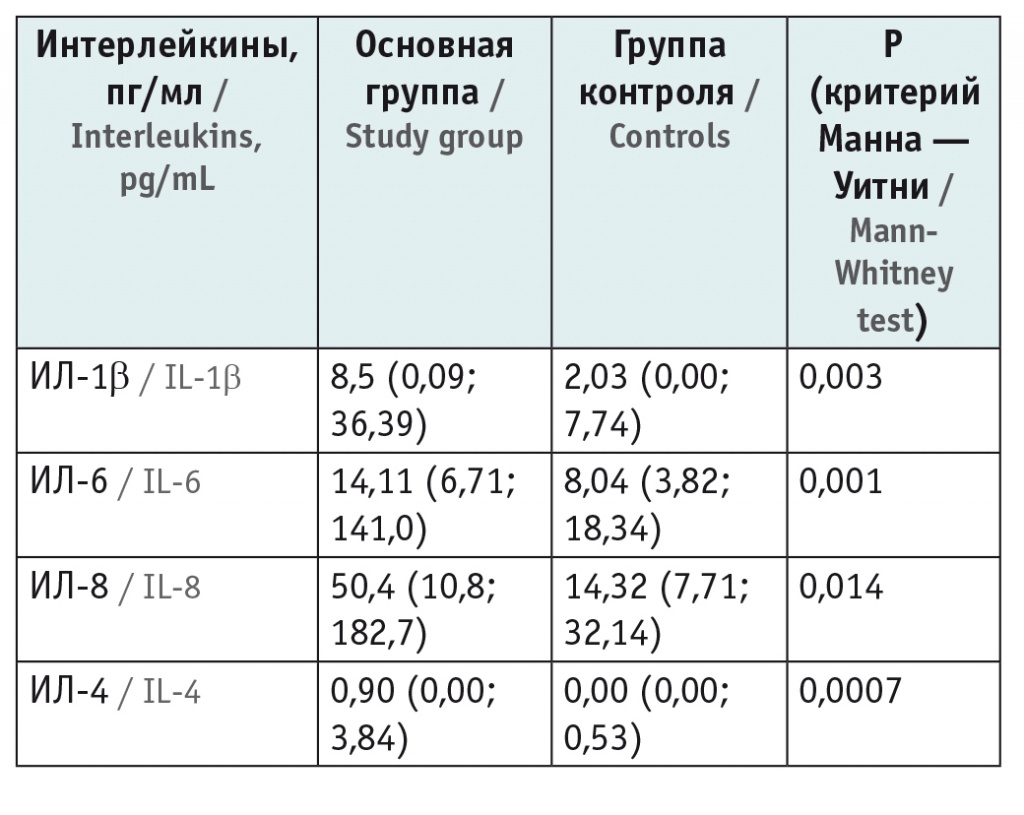
Так, у новорожденных основной группы концентрация ИЛ-1β была существенно выше, чем у участников группы контроля. Известно, что ИЛ-1β синтезируется моноцитами, макрофагами, дендритными клетками, В-лимфоцитами, NK-клетками, эпителиальными, эндотелиальными и гладкомышечными клетками сосудов[6, 7, 9, 18]. Повышение уровня ИЛ-1β в пуповинной крови у детей с гипоксическими событиями способствует нейроповреждению и выработке оксида азота, являющегося одним из основных регуляторов тонуса мозговых сосудов[6, 7, 9].
ИЛ-1β стимулирует выработку ИЛ-8, повышение содержания которого, по результатам исследования Г.Н. Чистяковой и соавт., является прогностически значимым событием при возникновении перинатального поражения ЦНС[19]. В данном исследовании отмечено, что уровень ИЛ-8 также оказался статистически значимо выше у детей, перенесших хроническую внутриутробную гипоксию и/или асфиксию при рождении, и составил в среднем 50,4 пг/мл против 14,32 пг/мл (р < 0,05) в группе контроля.
Подобная тенденция наблюдалась и при изучении уровня ИЛ-6, который в нашем исследовании был значимо выше у детей 1-й группы по сравнению с таковым во 2-й группе. Известно, что ИЛ-6 продуцируют многие клетки: Т-лимфоциты, макрофаги, эндотелиальные клетки, микроглия и астроциты. Согласно литературным данным, чем выше концентрации ИЛ-1β и ИЛ-6 у новорожденных детей после перенесенной асфиксии, тем тяжелее степень гипоксически-ишемического поражения головного мозга и выше вероятность повторных судорог[7, 9, 18, 20].
При оценке уровня такого противовоспалительного цитокина, как ИЛ-4, отмечено, что в 1-й группе этот показатель был значимо выше, чем во 2-й группе.
В дальнейшем у всех детей определено содержание НСЕ в пуповинной крови: у перенесших внутриутробную гипоксию и/или асфиксию при рождении оно равно 9,63 (6,71; 14,94) нг/мл, в группе контроля — 7,23 (5,28; 10,84) нг/мл (p = 0,01).
Данные литературы демонстрируют, что высокие показатели НСЕ наблюдались у больных с тяжелой степенью церебральной ишемии (особенно с 1-го по 5-й день жизни), и гораздо ниже они были у детей с легкой степенью указанной патологии. Повышение уровня НСЕ в сыворотке крови новорожденных может служить дополнительным критерием ранней диагностики и степени тяжести гипоксического поражения головного мозга[11].
Исследование E. Mazarico и соавт. (2019) показало, что чем выше показатели НСЕ у детей при рождении, тем в большей степени выражено отставание формирования тонических, рефлекторных реакций, циклической организации сна и психомоторного развития в возрасте 2 лет. По мнению авторов, это указывает на высокую прогностическую значимость данного биохимического маркера[21]. НСЕ является наиболее ярким и специфичным маркером повреждения нервной ткани, и определение ее содержания в крови целесообразно для установления повреждения головного мозга[10, 11].
ЗАКЛЮЧЕНИЕ
В современном мире диагностика поражений ЦНС должна основываться не только на выявлении определенных неврологических симптомов при объективном обследовании ребенка и на данных различных методов нейровизуализации, но и на использовании лабораторных методов с оценкой маркеров, указывающих на патологический процесс.
Как показало наше исследование, у детей с перенесенной внутриутробной гипоксией/асфиксией отмечаются повышенные уровни ИЛ-1β, ИЛ-6, ИЛ-8, ИЛ-4 и нейронспецифической енолазы (НСЕ), при этом некоторые дети основной группы не имели неврологической симптоматики и соответствующего диагноза.
Таким образом, повышенные концентрации цитокинов и нейроспецифических белков (НСЕ) в пуповинной крови детей с гипоксическими событиями могут быть маркерами поражения головного мозга. Ранняя лабораторная диагностика позволит профилактировать неврологические исходы путем своевременно предпринятых терапевтических мер.
Поступила: 29.01.2020
Принята к публикации: 18.02.2020








