Современные программы лечения пациентов с гемобластозами с внедрением высокоинтенсивных методов терапии, широким использованием трансплантации гематопоэтических стволовых клеток ведут к увеличению числа пациентов, нуждающихся в трансфузиях эритроцитсодержащих сред (ЭСС). После внедрения современных ресуспендирующих растворов с добавлением полисахаридов, фосфатов и аденина в повседневную практику заготовки эритроцитарной массы вопрос о хранении эритроцитов для обеспечения потребности лечебных учреждений был в основном решен. Во многих областях медицины 42-дневный срок хранения эритроцитов позволил проводить необходимое число лечебных мероприятий, а компоненты крови, подлежащие списанию по истечении срока годности, стали составлять не более 5%. Несмотря на это, сохраняются проблемы со своевременным обеспечением пациентов ЭСС, и прежде всего с удовлетворением остро возникшей потребности в трансфузии у пациентов с редкими группами крови, у сенсибилизированных больных при необходимости индивидуального подбора, а также при риске повторного развития аллергических реакций у реципиентов с длительным трансфузионным анамнезом. Актуальным остается вопрос о заготовке аутологичной крови.
Другой проблемой является предупреждение передачи гемотрансмиссивных инфекций. В связи с длительными сроками хранения замороженных эритроцитов появилась возможность их накопления в виде стратегического запаса, быстро готовящегося к применению. Особый акцент должен быть сделан на карантинизации ЭСС, существенно снижающей риск инфицирования реципиентов гепатитами В и С, ВИЧ-инфекцией.
Эти факторы вновь пробудили интерес к разработке и внедрению методик длительного хранения компонентов крови.
Различные методы криоконсервации крови и ее компонентов, в особенности эритроцитов, были изучены достаточно давно. Замороженные компоненты крови — один из альтернативных методов их хранения; возможность их заморозки активно исследовалась в 50–60-х годах прошлого века, срок годности эритроцитарной массы в то время не превышал 21 дня. Проведение криоконсервации было сопряжено со значительными потерями жизнеспособности и функциональной активности клеток крови. В процессе замерзания водных растворов ледяные кристаллы создаются из «чистой» воды, а пространство между кристаллами заполняется концентрированными электролитами. Это приводит к дегидратации клеток за счет изменения осмотического давления и pH среды[3, 5]. Защита клеток при замораживании достигается добавлением криозащитных веществ (криопротекторов). Так как последние вызывают значительное увеличение осмолярности, при добавлении растворов необходимо внимательно отслеживать все процедуры, контролировать осмотические изменения, чтобы избежать необратимого повреждения клеточных структур и оболочек[3, 5, 8]. По своему воздействию криопротекторы делятся на две группы: внутриклеточные («проникающие») и внеклеточные («непроникающие»).
Внутриклеточные криопротекторы. Благодаря относительно простой химической структуре внутриклеточные криопротекторы легко проникают в клеточную мембрану и при низкой концентрации не представляют опасности в плане токсического воздействия на клетки. В процессе заморозки эти вещества увеличивают выход внутриклеточной воды и поддерживают осмотический баланс, что приводит к уменьшению объема клеток, а также снижает осмотическую нагрузку[7, 13].
К данному типу криопротекторов относятся глицерол, диметилсульфоксид (ДМСО), некоторые типы гликолей (этанол, метанол, пропиленгликоль и т. п.), широко используемые при длительном хранении замороженных тканей и клеток (банки спермы, криобанки, банки стволовых клеток и клеток пуповинной крови). Криозащитный эффект глицерола, который также называют низкомолекулярным неэлектролитом, заключается в проникновении в клеточную мембрану и в ядро клетки и в создании гиперосмолярной окружающей среды. Ранее глицерол использовали для криоконсервации большого числа клеток млекопитающих, эмбрионов и неоплодотворенных яиц. В настоящее время он применяется главным образом для криоконсервации эритроцитов. Основная концентрация глицерола составляет 20–40% (максимальная — 55%). ДМСО, так же как и глицерол, является неэлектролитом с низкой молекулярной массой и может использоваться для длительной криоконсервации как ядросодержащих, так и не ядросодержащих клеток. Однако, в отличие от глицерола, цитотоксические свойства ДМСО проявляются уже при концентрациях, превышающих 10%.
Внеклеточные криопротекторы. В связи с большой молекулярной массой внеклеточные криопротекторы не проникают в клеточную мембрану и в основном используются для быстрого и сверхбыстрого замораживания. Существует много примеров таких криопротекторов: моносахариды (глюкоза, гексоза), дисахариды (сахароза, трегалоза), трисахариды (рафиноза) и полимеры (поливинилпирролидон, полиэтиленгликоль), а также другие высокомолекулярные вещества, такие как декстран, модифицированный желатин, гидроксиэтилкрахмал, альбумин.
Внеклеточные криопротекторы способны стабилизировать клеточную мембрану, а также обладают эффектом образования «стекловидного» вещества. При превращении воды в лед криопротекторы данного типа остаются за пределами клетки, обеспечивая создание пространства между клеточной мембраной и внеклеточной средой.
Вследствие изменения осмотического коэффициента внеклеточное давление вытесняет молекулы воды из медленно замерзающего межклеточного пространства, при этом не повреждается мембрана клетки[2, 10].
Размороженная эритроцитарная масса впервые была успешно перелита П. Л. Моллисоном (P. L. Mollison) в 1951 г.[6]. Эритроцитарная масса для этого переливания замораживалась с использованием 20%-ного раствора глицерола быстрым методом заморозки, открытым А. Т. Смитом (A. T. Smith)[8]. В стандарты клинической практики криоконсервирование эритроцитов введено в начале 1960 г. Для добавления используется высококонцентрированный (40%-ный) глицерол, что стало эталоном для большинства отделений ОПК на длительное время. После заморозки температура эритроцитов медленно снижается до –80 °С, хранение происходит при –65 °С. Этот метод впервые был описан Дж. Л. Таллисом (J. L. Tullis) и соавт. в 1958 г.[11, 12].
В 2011 г. FDA США зарегистрировала вторую версию аппарата Haemonetics ACP 215, который совершил прорыв в процессах глицеролизации и деглицеролизации, сделав их «закрытыми», защищенными от воздействий внешней среды.
Только недавно был частично преодолен главный недостаток криоконсервирования эритроцитов: с появлением в последние годы новых технологий и ресуспендирования жизнь эритроцитарной массы после разморозки стала составлять от 1 до 3 недель. C. R. Valery c группой ученых из Военно-морской научно-исследовательской лаборатории крови США, доказала достоверную возможность использования криоконсервированной эритроцитарной массы в течение 7 дней после ресуспендирования в добавочном растворе САГМ (аденин, глюкоза, маннитол) и 14 дней после ресуспендирования с использованием добавочного раствора — формула-3 (АS-3: цитрат, фосфат, глюкоза) соответственно[14, 15]. M. Bohonek и соавт. также доказали возможность использования криоконсервированной эритроцитарной взвеси в течение 3 недель[1].
Целью проведенного нами исследования был сравнительный анализ эффективности переливания размороженных и отмытых эритроцитов (РиОЭ) и обычной эритроцитной взвеси (ЭВ) детям, получавшим терапию при гемобластозах с анемическим синдромом.
МАТЕРИАЛЫ И МЕТОДЫ
Выполнен ретроспективный анализ историй болезни пациентов с гемобластозами, находившихся на лечении в отделениях ФГБУ «Федеральный научно-клинический центр детской гематологии, онкологии и иммунологии имени Дмитрия Рогачёва» Минздрава России и получавших гемотрансфузионную терапию ЭВ (группа А, 30 пациентов) и РиОЭ (группа В, 28 пациентов). Группы были сопоставимы по средней массе, диагнозам, показаниям к трансфузии (табл. 1). От законных представителей всех пациентов было получено информированное согласие на выполнение диагностических процедур и проведение гемотрансфузий.
Таблица 1
Демографические характеристики пациентов
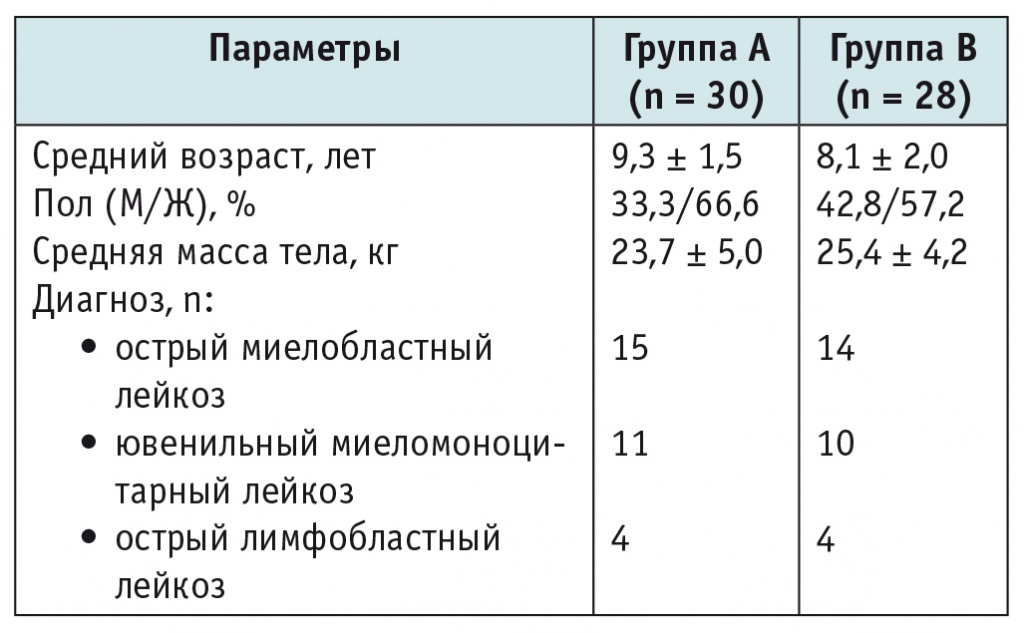
Примечание. Для всех сравниваемых параметров р > 0,05.
Основным критерием для проведения трансфузии являлось снижение уровня гемоглобина ниже 80 г/л при отсутствии продолжающегося кровотечения. Дозу ЭВ для реципиентов обеих групп определяли из расчета 10–12 мл/кг.
ЭВ была получена из 450 мл цельной донорской крови, заготовленной с использованием системы для сбора крови (Terumo IMUFLEX WB-RP, Terumo Corporation, Япония), в качестве консерванта применяли ЦФГ (цитрат, дигидрофосфат, глюкоза). Центрифугирование мешков производили в жестком режиме (3500 об/мин) при температуре +4 °C в течение 15 минут с последующим добавлением САГМ. Все компоненты были подвергнуты лейкофильтрации и облучению рентгеновскими лучами в дозе 25 Гр.
Замораживанию подвергали эритроцитную массу, заготовленную на глюкозо-цитратном растворе и хранившуюся не более 5 дней после взятия от донора. Эритроцитная масса для криоконсервации была получена из лейкофильтрованной и облученной ЭВ путем центрифугирования и последующего удаления САГМ. В качестве ограждающего раствора выступал 57,1%-ный раствор глицерола. Смешивание эритроцитной массы с криоконсервирующими растворами проводили с помощью автоматической системы обработки клеток АСР 215 (Haemonetics, США). После глицеринизации контейнеры с эритроцитами подвергали замораживанию и хранению при температуре –80 °С. Средний срок хранения замороженных эритроцитов составлял 8 ± 1,5 месяца от даты глицеринизации. Деглицеринизацию и отмывание эритроцитов выполняли непосредственно перед трансфузией в автоматической системе обработки клеток АСР 215 с использованием закрытой одноразовой магистрали при последующем добавлении САГМ.
Клинические проявления анемического синдрома в исследовании не оценивались, оценка эффективности трансфузий ЭСС проводилась только по лабораторным показателям коррекции анемии. Определение прироста показателей красной крови выполнялись через 24 часа после проведения трансфузии. Конечными точками оценки эффективности лечения были показатели прироста гемоглобина, гематокрита, эритроцитов.
Статистическая обработка данных включала в себя: проверку нормальности распределения, расчет среднего значения, стандартного отклонения, стандартной ошибки среднего значения. Использовали статистический критерий Стьюдента (t), уровень значения достоверности различий был принят 5% и менее.
РЕЗУЛЬТАТЫ
С целью сравнительной оценки качества компонентов все дозы ЭВ и РиОЭ были проанализированы перед трансфузией. Оценивались количество гемоглобина, эритроцитов и гематокрит (табл. 2). Средняя концентрация гемоглобина в РиОЭ на 16,5% ниже, чем в ЭВ, среднее содержание эритроцитов — на 11,8%, гематокрит на 12,8% ниже, чем в ЭВ. В процессе глицеролизации, деглицеролизации и хранения замороженных эритроцитов потери и частичный гемолиз эритроцитов неизбежны, что объясняет различия в показателях.
Таблица 2
Сравнительная характеристика эритроцитной взвеси и размороженных и очищенных эритроцитов (РиОЭ)
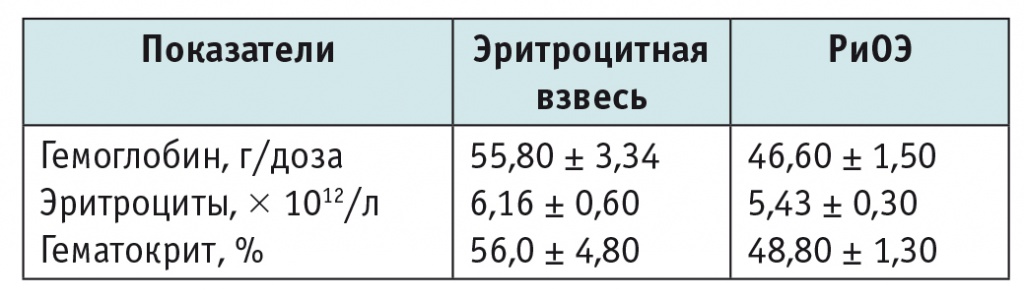
Примечание. Для всех сравниваемых показателей р < 0,001.
Для сравнения эффективности заместительной терапии ЭВ и РиОЭ мы проанализировали динамику уровней гемоглобина, эритроцитов и гематокрита в подгруппах с изначальным показателем гемоглобина 60–80 г/л (анемия тяжелой степени).
Подгруппы пациентов с тяжелой степенью анемии были сопоставимы: средняя масса тела детей, получавших ЭВ, составила 23,7 ± 5,0 кг, а получавших РиОЭ — 25,4 ± 4,2 кг (р > 0,05); объем использованной эритроцитарной массы у детей из группы ЭВ в среднем составил 271,6 ± 65,3 мл, а из группы РиОЭ — 263,0 ± 41,3 мл (р > 0,05).
Динамика лабораторных показателей красной крови в исследованных подгруппах представлена в таблицах 3–5. По исходным уровням гемоглобина, эритроцитов и гематокрита подгруппы практически не различались (p > 0,05).
Таблица 3
Показатели гемоглобина, эритроцитов и гематокрита до выполнения трансфузий в подгруппах пациентов
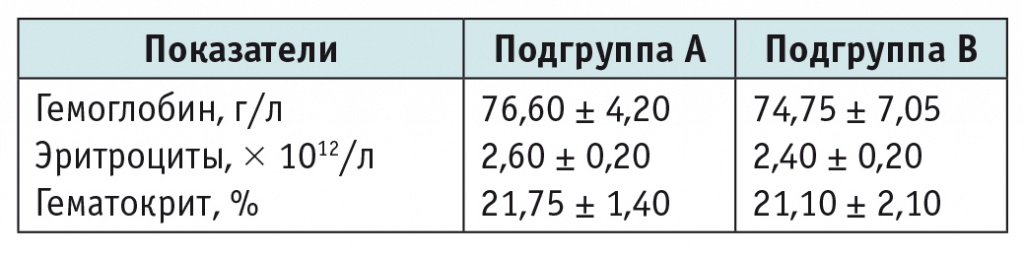
Примечание. Для всех сравниваемых показателей р > 0,05.
Таблица 4
Показатели гемоглобина, эритроцитов и гематокрита после выполнения трансфузий в подгруппах пациентов
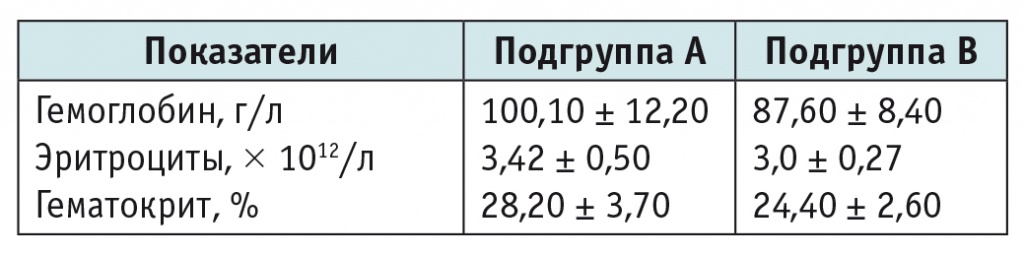
Примечание. Для всех сравниваемых показателей р < 0,001.
Таблица 5
Прирост показателей гемоглобина, эритроцитов и гематокрита после выполнения трансфузий в подгруппах пациентов
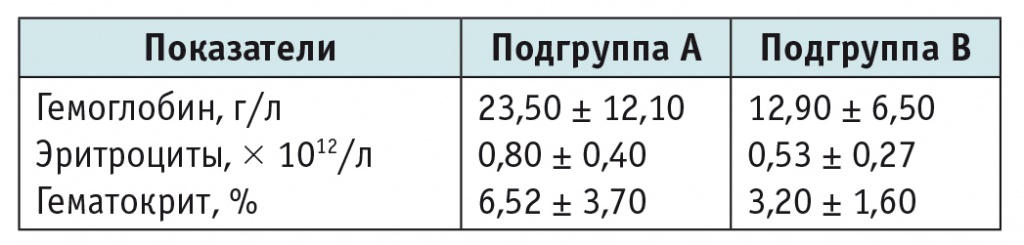
Примечание. Для всех сравниваемых показателей р < 0,05.
После выполнения трансфузий показатели красной крови в обеих подгруппах повысились и достигли целевых значений, представленных в таблице 4.
При анализе эффективности гемотрансфузий внутри каждой из подгрупп отмечен прирост показателей красной крови, однако в подгруппе пациентов, получивших РиОЭ, прирост уровней гемоглобина, эритроцитов и гематокрита был статистически значимо ниже (табл. 5). Учитывая изначально более низкие характеристики РиОЭ в сравнении с ЭВ (см. табл. 2), эффективность трансфузий ЭСС можно оценивать положительно.
В ходе оценки переносимости реципиентами трансфузий ЭВ и РиОЭ учитывали как общее состояние больных, так и динамику систолического и диастолического артериального давления, частоты пульса, дыхания, температуры тела. Во время и после трансфузий не было зафиксировано развития посттрансфузионных осложнений.
ОБСУЖДЕНИЕ
Создание запасов компонентов донорской крови является неотъемлемой частью трансфузиологического обеспечения пациентов с гемобластозами. Применение современных консервирующих растворов значительно улучшило возможности бесперебойного снабжения таких больных эритроцитсодержащими компонентами, тем не менее растущая потребность в компонентах крови у пациентов с онкологическими и гематологическими заболеваниями по-прежнему делает актуальным создание запасов длительного хранения. Создание банка замороженных эритроцитов позволяет более гибко выстраивать донорскую политику, экономит компоненты крови за счет минимизации объема компонентов с истекшим сроком годности, позволяет создать экстренные и текущие запасы эритроцитов редких групп крови, уже подвергнутых всем способам дополнительной обработки (лейкофильтрация, облучение 25 Гр, отмывание), т. е. универсальных для большинства клинических ситуаций. В связи с длительными сроками хранения замороженных эритроцитов появляется возможность их накопления в виде стратегического запаса, который быстро готовится к применению. Особый акцент должен быть сделан на возможности карантинизации ЭСС, что существенно снижает риск инфицирования реципиентов гепатитами В и С, ВИЧ-инфекцией. Автоматическая глицеролизация, деглицеролизация и отмывание эритроцитов существенно снижают риск человеческой ошибки, переливание осуществляется с меньшим риском побочных реакций у пациентов. Деглицеринизированные клетки сопоставимы по объему, гематокриту и эффективности применения с обычными эритроцитами[4, 9]. Специальный питательный взвешивающий раствор САГМ обеспечивает лучшую приживаемость донорских эритроцитов в кровяном русле пациента и сохраняет морфофункциональную полноценность эритроцитов до 72 часов. Показания к назначению размороженных эритроцитов аналогичны таковым при назначении нативной ЭВ или нативных отмытых эритроцитов.
В целом при анализе результатов использования ЭСС можно подтвердить достаточную эффективность применения как ЭВ, так и РиОЭ.
Однако следует отметить ряд особенностей, выявленных при анализе результатов показателей в группах пациентов, получавших РиОЭ. Потери гемоглобина и эритроцитов в дозе ЭВ, подвергнутой глицеролизации, заморозке, деглицеролизации, составили в среднем 16% и 19% соответственно, что нашло свое отражение в уровнях прироста этих показателей после проведения трансфузии. При этом целевые показатели уровней гемоглобина и гематокрита были достигнуты у всех пациентов, которым переливалась размороженная и отмытая взвесь эритроцитов. Проведенный анализ не выявил клинически значимых различий в частоте развития побочных реакций при использовании таких компонентов донорской крови.
ЗАКЛЮЧЕНИЕ
Проведенное нами исследование позволяет констатировать достаточную эффективность обеих эритроцитсодержащих сред в коррекции анемии у пациентов с гемобластозами.
Вместе с тем сравнительный анализ показал, что, в сравнении с использованием эритроцитной взвеси, для достижения целевых значений гемоглобина и гематокрита реципиенту может потребоваться больший объем размороженных и отмытых эритроцитов либо их повторная трансфузия.








