ВВЕДЕНИЕ
Частота заболеваний мочевыделительной системы у детей имеет тенденцию к неуклонному росту, в основном за счет инфекции мочевыводящих путей (ИМВП). ИМВП у детей до 18 лет занимает 2–3-е место среди бактериальной патологии, а в возрасте до 2 лет — первое место [1–3]. Интерес к данному заболеванию связан прежде всего с его высокой распространенностью, а также с развитием тяжелых осложнений вплоть до формирования хронической почечной недостаточности [1].
Нередко дебют патологии мочевой системы у детей, особенно грудного и раннего возраста, имеет маломанифестный характер, а сама патология приобретает латентное течение, что, безусловно, затрудняет своевременную диагностику и отдаляет начало адекватных терапевтических, реабилитационных и профилактических мероприятий [1].
Недооценка тяжести инфекционного процесса, позднее назначение этиотропной терапии могут привести к фиброзу в почечной паренхиме, поэтому необходим поиск предикторов развития инфекционного воспаления мочевыделительной системы. Актуальность поиска ранних информативных биомаркеров обусловлена также тем, что в детском возрасте возможно обратное развитие повреждения почек и восстановление функции органа.
В качестве ведущего пути инфицирования мочевого тракта всегда рассматривался восходящий. На сегодняшний день доказано, что приоритетным источником возбудителей ИМВП является кишечник. При этом основная роль отводится сложному процессу, при котором происходит последовательная транслокация бактерий (энтеробактерий, энтерококков и др.) из кишечника в мезентериальные лимфоузлы, а затем в кровеносное русло (вены портальной системы) с последующим лимфогенным или гематогенным инфицированием почечной ткани.
Таким образом, в патогенезе ИМВП у детей грудного и раннего возраста существенное значение имеет повышенная проницаемость слизистой оболочки ЖКТ [1, 4, 5], в связи с чем перспективно использование информативных биомаркеров в качестве предикторов при заболеваниях почек для оценки проницаемости кишечного барьера.
В литературе широко обсуждается роль эндогенных пептидов в развитии воспаления почек и мочевых путей, включая плазменные белки, связывающие жирные кислоты (fatty-acid-binding proteins, FABP), и бактерицидный белок, повышающий проницаемость мембран клеток (bactericidal/permeability-increasing protein, BPI).
Семейство FABP состоит из сравнительно большого количества различных изомеров, из которых печеночная (liver) (L-FABP) форма экспрессируется преимущественно в печени и почках, а кишечная (intestine) (I-FABP) — в кишечнике [6, 10].
В исследованиях именно печеночная форма в настоящее время рассматривается как один из потенциальных лабораторных маркеров раннего повреждения почек. Согласно литературным данным, в моче здорового человека практически не определяются белки семейства FABР, но их экскреция значительно возрастает при повреждении почечной ткани. Повышенная экспрессия L-FABP в клетках канальцев и его выделение с мочой были описаны только на животных моделях при остром почечном повреждении [8].
Показан защитный эффект L-FABP в отношении тубулоинтерстициальных структур почки при перегрузке проксимальных канальцев белком, а также при односторонней обструкции мочеточника. Установлена роль L-FABP, определяемого в моче, как перспективного биомаркера хронических заболеваний почек и острой почечной недостаточности [9, 10].
Помимо этого, L-FABP является индикатором ранней стадии диабетической нефропатии у пациентов с СД 1 типа. Определение уровня экскреции L-FABP в моче позволяет выявлять пациентов, у которых происходит снижение скорости клубочковой фильтрации еще до появления микроальбуминурии, что, вероятно, может быть использовано в комплексной оценке функции почек у больных с СД 1 типа [8].
Антимикробный пептид — бактерицидный белок, повышающий проницаемость мембран клеток, локализуется в азурофильных гранулах нейтрофилов [11, 12]. Концентрация BPI в сыворотке крови увеличивается при воспалительных заболеваниях и аллергических реакциях. BPI играет важную роль в обнаружении и нейтрализации грамотрицательных бактерий, в том числе Neisseria meningitidis [13]. BPI мобилизуется из нейтрофилов в ответ на вторжение грамотрицательных бактерий, связывается с липополисахаридом на поверхности клетки, увеличивает проницаемость бактериальной мембраны и ингибирует процессы клеточного деления, способствуя внутриклеточной и внеклеточной гибели бактерий, нейтрализации эндотоксина [14].
Особый интерес вызывает изучение роли зонулина, единственного физиологического модулятора межклеточного взаимодействия на плотных контактах и известного маркера повышенной проницаемости кишечника, в развитии воспалительных заболеваний мочевыводящей системы.
В доступной нам литературе не удалось найти данные об изучении содержания FABP, BPI и зонулина в биологических жидкостях у пациентов с ИМВП, в том числе у детей.
Целью нашего исследования стало определение диагностической и патогенетической значимости FABP, BPI и зонулина у детей грудного и раннего возраста с ИМВП.
МАТЕРИАЛЫ И МЕТОДЫ
Проведено контролируемое клиническое исследование детей, находившихся на обследовании и лечении в специализированных (нефрологическом, патологии детей раннего возраста) отделениях ГБУЗ «Краевая детская клиническая больница № 1» г. Владивостока (главный врач — к. м. н. Горелик Н.В.) с 2016 по 2020 г.
Под нашим наблюдением находились 34 ребенка (основная группа) в возрасте с 29-го дня жизни и до 2 лет 11 месяцев и 29 дней включительно, которым в результате комплексного обследования выставлен диагноз ИМВП. Диагностика заболеваний осуществлялась в соответствии со стандартами Федеральных клинических рекомендаций Союза педиатров России (2018), рекомендаций Европейской ассоциации урологов/Европейского общества педиатрической урологии «Инфекции мочевых путей у детей» (2015).
В группу контроля включили 20 относительно здоровых детей, сопоставимых по возрасту и полу, не имевших в анамнезе и на момент исследования заболеваний почек и кишечника, без изменений в анализах мочи. Группы обследованных детей не различались между собой по возрастному и массо-ростовым показателям (р > 0,05).
К критериям исключения из исследования относили возраст менее 29 дней жизни и старше 2 лет 11 месяцев и 29 дней, отсутствие информированного согласия родителей или законных представителей ребенка, отказ законного представителя пациента от включения в исследование, наличие сопутствующей инфекционной патологии или обострения хронического заболевания на момент обследования, подозрение на генетическое заболевание.
Родители всех пациентов оформили письменное согласие на участие в исследовании. Работа выполнена с учетом требований Хельсинкской декларации Всемирной медицинской ассоциации «Этические принципы проведения научных медицинских исследований с участием человека» с поправками 2000 г. и Правил клинической практики в Российской Федерации, утвержденных Приказом МЗ РФ от 01.04.2016 г. № 200н.
У всех участников основной и контрольной групп в сыворотке крови определяли содержание печеночной и кишечной форм FABP и бактерицидного белка BPI, а в моче — I-FABP и зонулина. Исследование проводили методом энзим-связанного иммуносорбентного анализа (ELISA) на иммуноферментном автоматическом анализаторе с использованием реактивов фирмы Hycult Biotech (США) и Cloud-Clone Corp. (CCC, США).
Статистическую обработку материала осуществляли с помощью пакета специализированных программ для исследований (Excel-2010 и Statistica 10) на персональном компьютере на базе процессора Intel Core i3. Результаты исследования обработаны с использованием методов непараметрической статистки. Характеристики групп пациентов по количественным признакам сравнивались при помощи непараметрического критерия Манна — Уитни. Различия считали статистически значимыми при p < 0,05.
РЕЗУЛЬТАТЫ
Проведен анализ клинико-лабораторных проявлений заболевания у детей основной группы: у 23 (67,6%) пациентов отмечался интоксикационный синдром, проявлявшийся повышением температуры тела до фебрильных цифр, снижением аппетита, слабостью, темными кругами вокруг глаз, бледностью кожных покровов. Пастозность век по утрам зарегистрирована у 5 (14,7%) больных.
Расстройства мочеиспускания в виде болезненных позывов на мочеиспускание или беспокойства при мочеиспускании наблюдались у 24 (70,6%) больных. У 3 (8,8%) детей имели место уменьшение числа микций и задержка опорожнения мочевого пузыря после ночного сна. Неприятный запах мочи отмечался у 10 (29,4%) пациентов.
Мочевой синдром проявлялся лейкоцитурией (100%), гематурией у 4 (11,8%) больных; протеинурия (степень ее варьировала от 0,004 до 0,363 г/л, в среднем 0,15 ± 0,046 г/л) выявлена у 4 (11,8%) детей (суточная потеря белка не превышала 1 г).
Повышение суточной экскреции оксалатов (более 1 мг/кг/сутки) зарегистрировано у 13 (38,2%) больных. Диагностическая бактериурия (более 105 КОЕ/мл) найдена у всех 34 (100%) детей.
В микробном пейзаже преобладала энтеробактериальная урофлора. В 22 (64,7%) пробах мочи выделена Escherichia coli, Enterococcus faecalis — в 4 (11,8%), Proteus mirabilis — в 2 (5,9%), Staphylococcus epidermidis — в 2 (5,9%), Enterobacter cloacae — в 2 (5,9%), Enterobacter aerogenes — в 1 (2,9%), Klebsiella pneumoniae — в 1 (2,9%).
Воспалительные изменения в клиническом анализе крови в виде лейкоцитоза были у 13 (38,2%) больных, в среднем количество лейкоцитов составило 16,58 ± 2,11 × 109/л. Повышение СОЭ регистрировалось в 7 (20,6%) случаях (21 ± 3,28 мм/ч).
При УЗИ почек у 4 (11,8%) детей выявлена пиелоэктазия почек, у одного — гидронефроз, у 2 (5,9%) — удвоение чашечно-лоханочной системы. Функциональное состояние почек было сохранным у всех пациентов.
В нашем исследовании у детей с ИМВП уровни печеночной и интестинальной фракций FABP в сыворотке крови значительно отличались от показателей у детей контрольной группы (р < 0,05). Содержание BPI было также повышено при его нулевом значении у здоровых детей. Результаты изучения сыворотки крови участников отражены в таблице.
Таблица
Содержание белков, связывающих жирные кислоты, и белка, повышающего проницаемость мембран, в сыворотке крови обследованных детей, нг/мл
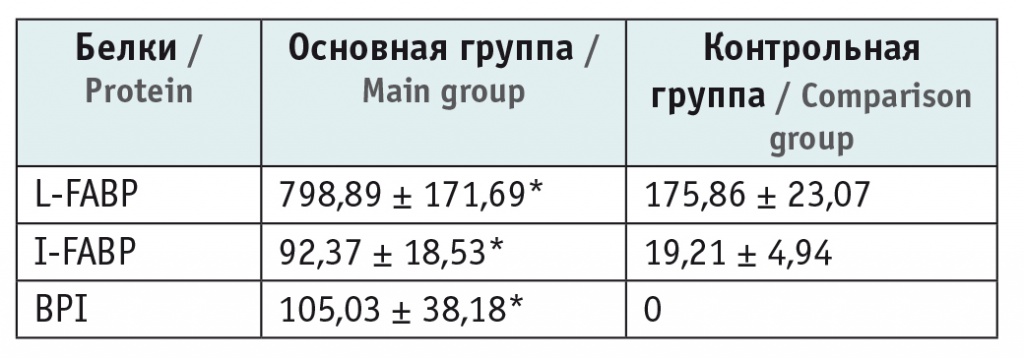
* Р < 0,05.
Далее мы провели исследование I-FABP и зонулина в моче. У детей с ИМВП уровень I-FABP в моче не так сильно, но все же значимо (0,11 ± 0,04 пг/мл) отличался от такового у здоровых детей (0,039 ± 0,009 пг/мл, р < 0,05, критерий Манна — Уитни). Концентрация же зонулина у детей основной группы была увеличена еще существеннее (3,15 ± 0,64 нг/мл против 0,12 ± 0,04 нг/мл, р < 0,01).
ОБСУЖДЕНИЕ
Полученные нами данные о повышении уровней FABP в сыворотке крови и моче свидетельствуют о вовлечении системы лигандов FABP в патологический процесс при развитии бактериального воспаления в мочевыводящих путях: в ответ на повреждение клеточных мембран почечной паренхимы и мочевого тракта увеличивается продукция FABP, как печеночной, так и интестинальной фракций.
Повышение концентраций исследуемых форм FABP, особенно L-FABP, отражает прежде всего степень тубулоинтерстициального повреждения почечной паренхимы. Увеличение уровня FABP также направлено на уменьшение оксидативного стресса, что показывает его цитопротективный эффект. Кроме того, полученные данные дают представление о морфофункциональных нарушениях в клеточных структурах не только почечной паренхимы, но и слизистой тонкой кишки, и расширяют представления о механизмах проникновения микробной флоры в мочевыводящие пути. Повышение содержания I-FABP и зонулина в моче может указывать на ведущую патогенетическую роль нарушения кишечного барьера в развитии ИМВП у детей грудного и раннего возраста.
В исследовании мы наблюдали увеличение мочевой экскреции I-FABP в 2,8 раза, тогда как изменения уровней FABP в сыворотке крови были более выраженными (более чем в 4–5 раз). Известно, что рост содержания FABP в моче связан в основном со значительным повреждением почек, сопровождающимся снижением почечных функций. В нашей основной группе ни у одного ребенка с ИМВП не зарегистрировано нарушение функционального состояния почек. Статистически значимое повышение сывороточных уровней FABP подтверждает роль повреждения кишечного барьера и транслокации микробной флоры при развитии ИМВП.
Увеличение концентрации BPI, выявленное в нашей работе, подчеркивает его антимикробное действие в отношении грамотрицательных бактерий, которые в основном и являются причиной ИМВП у детей.
ЗАКЛЮЧЕНИЕ
Исследование позволило уточнить патогенетическую значимость повышенной проницаемости кишечника в развитии воспалительного процесса и выделить ранние маркеры повреждения почек и мочевых путей (белки, связывающие жирные кислоты (FABP), и белок, повышающий проницаемость мембран в сыворотке крови). Увеличение уровней I-FABP и зонулина в моче может служить предиктором инфекций мочевыводящих путей у детей грудного и раннего возраста.
Поступила: 29.03.2021
Принята к публикации: 26.05.2021








