ВВЕДЕНИЕ
Инфекции мочевыводящих путей (ИМВП) — группа микробно-воспалительных заболеваний, при которых в большинстве случаев требуется назначение антибиотикотерапии. Среди госпитализированных детей раннего возраста с лихорадкой ИМВМ встречаются в 10–15% случаев.
Девочки страдают ИМВП чаще, что связано с анатомо-физиологическими особенностями организма [1, 2]. По данным Американской академии педиатрии, для лечения ИМВП у детей рекомендована антимикробная терапия, препаратами выбора являются защищенные аминопенициллины (амоксициллин + клавулановая кислота), ко-тримоксазол (триметоприм + сульфаметоксазол) или цефалоспорины II–III поколений, а также уреидопенициллины [3, 4].
Спектр микрофлоры, выделяемой при ИМВП, многообразен и зависит от возраста, пола, пути инфицирования и формы заболевания. Энтеробактерии, стафилококки и энтерококки — наиболее частые возбудители инфекции мочевой системы. Совокупный удельный вес энтеробактерий (с доминированием среди них Escherichia coli), энтерококков (преимущественно Enterococcus faecalis и Enterococcus faecium) и стафилококков (главным образом Staphylococcus aureus и Staphylococcus saprophyticus) в структуре этиологических агентов неспецифических уроинфекций достигает 90–95%, они ассоциируются с развитием как цистита, так и пиелонефрита [5, 6]. Подобная закономерность связана с видовыми особенностями факторов уропатогенности указанных возбудителей [7–10].
По результатам исследования ДАРМИС, общая доля представителей семейства Enterobacteriaceae при ИМВП составила 79,8%, из них E. сoli выявлена у 61,4% пациентов [7].
Актуальность рационального выбора антимикробного препарата (АМП) при лечении ИМВП у детей обусловлена ростом антибиотикорезистентности урофлоры, даже при внебольничных заболеваниях [11–13].
Антибиотикорезистентность (АР) в современном мире — это глобальная проблема, она затрагивает интересы всего мирового сообщества и ставит под угрозу лечение многих инфекционных заболеваний. ВОЗ еще в 2001 году предложила Глобальную стратегию в отношении сдерживания устойчивости к противомикробным препаратам. Резистентность к АМП подчеркивается в докладе ВОЗ (2014), имеет глобальный масштаб и представляет угрозу для жизни и здоровья детей и подростков [14, 15]. Согласно оценкам международных экспертов, АР является причиной более 700 тыс. смертельных случаев ежегодно (в т. ч. в Европе — 22 тыс. случаев). Предполагается, что к 2050 году эта цифра может увеличиться до 10 млн человек [15]. Опубликованный в 2016 году глобальный метаанализ, посвященный АР уропатогенов у детей, включает 58 исследований и около 78 тыс. штаммов E. сoli. Он показал, что АР существенно выше в странах безрецептурной продажи АМП, чем в государствах, где антибиотики продаются строго по рецепту. Штаммы E. сoli, выделенные из мочевых путей у детей, которые ранее получали АМП, имели более высокий уровень АР, которая сохранялась на протяжении 6 месяцев [8]. Обращают на себя внимание результаты исследования ДАРМИС (2017), свидетельствующие о росте резистентности к большинству АМП и среди внебольничных штаммов порядка Enterobacterales, в частности E. coli, в России [7].
Мониторинг резистентности урофлоры носит многоцентровой международный характер. Например, исследование ECO-SENS Project, проведенное на территории стран Европы и Канады, подтвердило предположение о существовании значительных географических отличий в уровне и характере АР микроорганизмов (МО). Например, частота выделения штаммов E. сoli, резистентных к ко-тримоксазолу, колебалась от 12,2% в Великобритании до 25,7% в Испании, а к ципрофлоксацину — 0,6% и 14,7% соответственно [12].
В РФ в 2017 году принята Стратегия предупреждения АР на период до 2030 года. Ее целями являются предупреждение и ограничение АР на территории РФ [15]. Среди задач — обеспечение системного мониторинга распространенности АР и изучение механизмов ее возникновения.
В связи с существованием региональных отличий в уровне АР важно проведение локального мониторинга резистентности возбудителей ИМВП. Данные о структуре уропатогенов и их чувствительности к АМП при различных формах ИМВП были получены в ходе многоцентровых проспективных эпидемиологических исследований (UTIAP-I, UTIAP-II, АРМИД, АРИМБ), организованных Научно-исследовательским институтом антимикробной химиотерапии ФГБОУ ВО «Смоленский государственный медицинский университет» Минздрава России и Научно-методическим центром по мониторингу антибиотикорезистентности Минздрава России [15].
Среди уропатогенов с детерминантами резистентности в настоящее время ведущее место занимают представители порядка Enterobacterales, являющиеся продуцентами плазмидных β-лактамаз расширенного спектра (ESBL класса А), обусловливающих устойчивость флоры к β-лактамным антибиотикам. Вызывает тревогу увеличение частоты выявления карбапенемаз, β-лактамаз, AmpC, комбинированных механизмов (ESBL + AmpC/MBL/OXA/KPC, комбинаций указанных механизмов резистентности к АМП с утратой поринов, изолированного варианта потери поринов, являющегося фенотипом резистентности ко всем β-лактамам, в т. ч. карбапенемам, в отсутствие продукции карбапенемаз) [15].
Таким образом, региональные исследования и мониторинг резистентности имеют большое значение для эффективной терапии ИМВП и профилактики осложнений, что определяет актуальность проведенной нами работы.
Цель исследования: изучить структуру уропатогенов и фенотипы их чувствительности к АМП при ИМВП у детей в Рязани и Рязанской области.
МАТЕРИАЛЫ И МЕТОДЫ
Проведен ретроспективный локальный лабораторный мониторинг микробиологического пейзажа мочи с оценкой уровня чувствительности к АМП у 111 пациентов в возрасте от 2 месяцев до 17 лет, получавших консервативное лечение по поводу ИМВП в педиатрическом отделении ГБУ РО «Городская клиническая больница № 11» (г. Рязань) в 2020 году. Среди обследованных было 75 (67,6%) девочек и 36 (32,4%) мальчиков.
Выделение и видовая идентификация возбудителей производились на базе бактериологической лаборатории ГБУ РО «Городская клиническая больница № 11» (г. Рязань) из образцов мочи, собранных после предварительного туалета наружных половых органов в стерильные одноразовые пластиковые контейнеры до начала антимикробной терапии. Материал доставлялся на исследование в течение 2 ч от момента сбора.
Исследование проводилось на микробиологическом анализаторе Labsystems iEMS Reader с использованием программы ВАСТ, коммерческих тест-систем ENTEROtest 16 (Erba Lachema, Чехия), аналитического хромогенного метода (Системы индикаторные бумажные для идентификации МО, фирма «Микроген», Россия) и иммунологического латексного метода для детекции антигенов стрептококков групп А, В, С и D (Oxoid Ltd., Великобритания).
Для определения категории чувствительности МО к АМП применяли фенотипический диско-диффузионный метод (ДДМ)1 и аналитический метод инактивации карбапенемов2. При лабораторном мониторинге полученных результатов по определению категорий чувствительности использована актуальная версия руководства EUCAST.
Клинически значимый рост учитывался при выявлении в образцах мочи представителей порядка Enterobacterales и неферментирующих грамотрицательных бактерий (Pseudomonas aeruginosa, Acinetobacter baumannii) в любом количестве, поскольку при проведении скрининга на продукцию ЕSBL, АmpС и CPE (карбапенемазопродуцирующие штаммы энтеробактерий) обнаруживалась продукция клинически и/или эпидемиологически значимых механизмов резистентности, в т. ч. и в крайне низких титрах (менее 103 КОЕ/мл). Одной из причин детекции проблемных резистентных возбудителей (ПРВ) в крайне низких или низких титрах может являться их бессимптомное носительство [16].
При высеве других МО, например представителей рода стафилококков, стрептококков или грибов, клинически значимым титром признавалась микробная нагрузка ≥ 104 КОЕ/мл.
Статистическую обработку данных проводили с использованием компьютерной программы «Журнал микробиолога» (разработчик — ТОО «Восточная Корона»).
РЕЗУЛЬТАТЫ
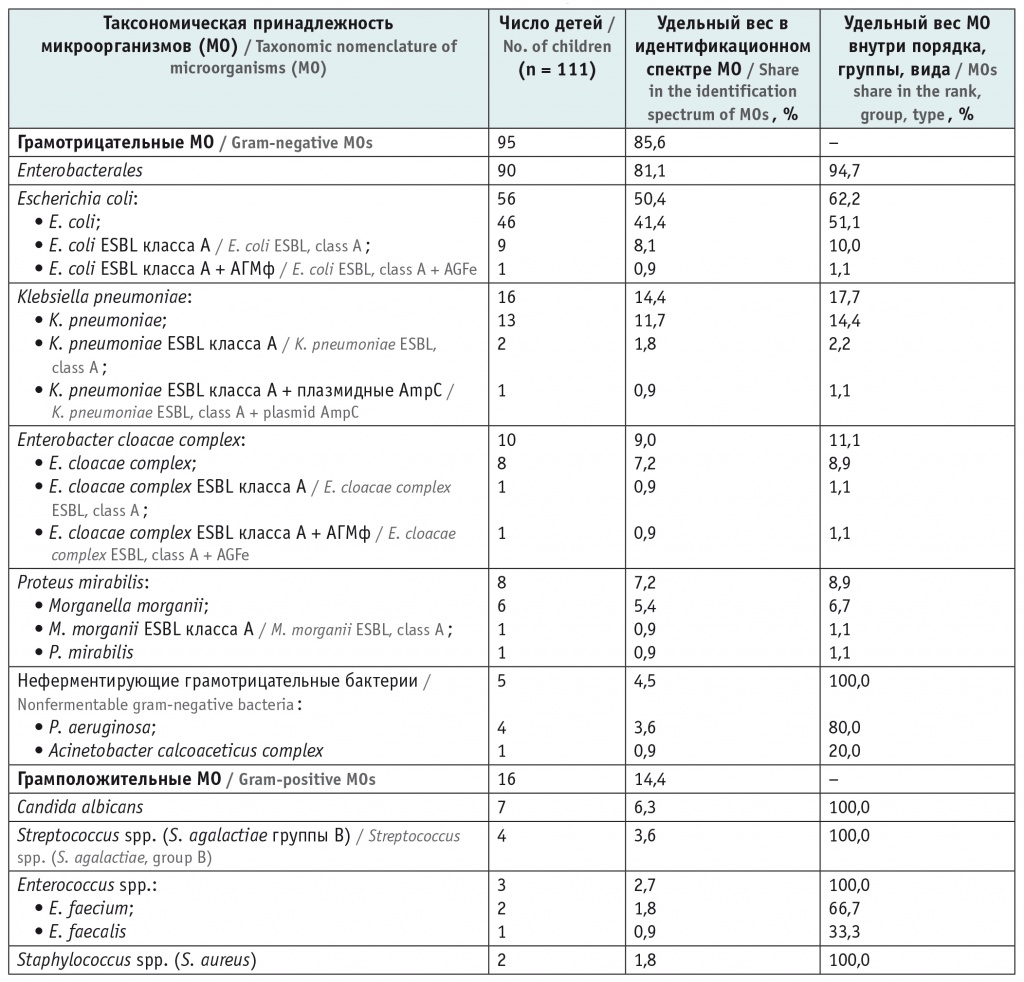
В микробном пейзаже урологической флоры из 204 проб мочи 111 детей регистрировался значительный удельный вес грамотрицательных МО — 85,6% (n = 95) — с абсолютным доминированием МО порядка Enterobacteralеs как в общем спектре флоры — 81,1% (n = 90), так и внутри грамотрицательной группы — 94,7% (n = 90) (табл. 1).
Таблица 1
Спектр флоры, высеваемой из мочи детей с инфекциями мочевыводящих путей в 2020 г.
Примечание. Здесь и в таблице 2: АГМф — аминогликозид-модифицирующие ферменты, обусловливающие неэффективность группы аминогликозидов.
Доминирующим возбудителем являлась E. сoli как в целом в этиологической структуре возбудителей ИМВП (50,4%), так и в группе энтеробактерий (порядок Enterobacteralеs) (62,2%). Доминантом бактериурии у детей с ИМВП была E. сoli без детерминант резистентности, она высевалась в 41,4% от общего спектра МО. Частота встречаемости детерминант резистентности внутри вида E. сoli составила 9,0%: E. сoli ESBL — 8,1%, E. сoli ESBL + АГМф (АГМф — аминогликозид-модифицирующие ферменты, обусловливающие неэффективность группы аминогликозидов) — 0,9%.
Второе место по распространенности занимала K. pneumoniae, составляя 14,4% в общем спектре МО и 17,7% среди порядка Enterobacteralеs. Детерминанты резистентности детектированы у 2,7% штаммов данного вида ПРВ: K. pneumoniae ESBL — 1,8%, K. pneumoniae ESBL + плазмидные АmpC — 0,9%.
Реже выделялись Enterobacter cloacae complex и группа Proteus mirabilis (виды P. mirabilis и Morganella morganii объединены из-за их таксономической близости).
В единичных случаях у E. сoli (n = 1) и E. cloacaе complex ESBL (n = 1) встречались комбинированный механизм резистентности к β-лактамным АМП и продукция АГМф. У выявленной грамотрицательной флоры не детектирована продукция изолированных цефалоспориназ AmpC и карбапенемаз — МВL класса В, КРС класса А (карбапенемаз K. pneumoniae), группы ОХА-48-подобных класса D.
Доля неферментирующих грамотрицательных бактерий в общем спектре составила 4,5%, они представлены в основном P. aeruginosa — 3,6%. Высев грамположительных МО получен в 14,4% случаев, что в 5,6 раз меньше, чем грамотрицательных МО. Спектр грамположительных МО включал грибы Candida albicans, Streptococcus agalactiae группы В, Enterococcus sрр. и Staphylococcus aureus. Детерминанты резистентности, присущие грамположительной флоре (MRSA, М-фенотип, индуцибельный MLSВ фенотип, VRE), не выявлены.
Детерминанты резистентности обнаружены у МО, относящихся к порядку Enterobacterales (n = 16): 17,8% среди всего порядка Enterobacteralеs (табл. 2) и 14,4% в общем спектре возбудителей ИМВП у детей. Продукция ЕSBL класса А определялась во всех случаях, и в трех из них выявлены комбинированные механизмы резистентности: ЕSBL + АГМф (E. cloacaе complex, E. сoli) и ЕSBL + плазмидные АmpС (K. pneumoniae).
Таблица 2
Внутривидовая встречаемость продукции детерминант резистентности к антимикробным препаратам у микроорганизмов порядка Enterobacterales, выделенных из мочи детей, n (%)
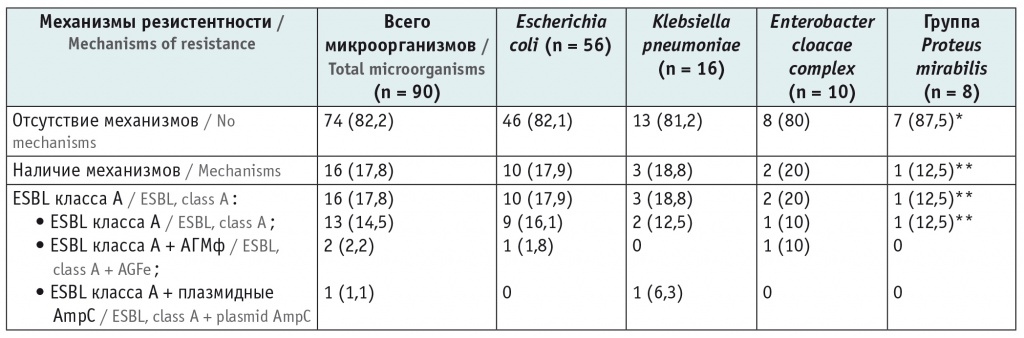
* Morganella morganii и Proteus mirabilis.
** Morganella morganii.
Удельный вес комбинированных механизмов в общем идентификационном спектре порядка Enterobacterales был незначительным — 3,3% (n = 3). Основным носителем приобретенных детерминант резистентности являлась Е. соli, составляя в общем микробном пейзаже урологической флоры 9,0%, а среди порядка Enterobacterales — 11,1% (n = 10).
Во всех случаях обнаружения механизмов резистентности использовался аналитический метод инактивации карбапенемов. В результате проведенного тестирования продуценты карбопенемаз среди представителей порядка Enterobacteralеs не найдены. Однако данный метод не позволяет дифференцировать тип продукции карбапенемаз — МВL класса В, КРС класса А, группу ОХА-48-подобных класса D, — но при этом эффективно выявляет факт гидролиза меропенема микроорганизмом.
Оценка активности АМП в отношении основных возбудителей ИМВП у детей продемонстрировала, что против Е. coli с обычным фенотипом чувствительности 100% активны in vitro цефалоспорины III–IV поколения, аминогликозиды и фосфомицин. Для этого вида МО частота устойчивости к нитрофурантоину составила 8,7%, к пенициллинам-ингибиторам ESBL — 13,1–23,9%, к ампициллину — 52,2%.
В отношении E. coli, обладающей детерминантами резистентности ESBL и ESBL + АГМф, оказались ожидаемо неэффективными незащищенные пенициллины, цефалоспорины I–IV поколения, монобактам (азтреонам), но отмечена высокая (100%) активность in vitro цефоперазон-сульбактама, карбапенемов, фосфомицина, нитрофурантоина, тигециклина, аминогликозидов (при отсутствии продукции АГМф). Уровень активности защищенных пенициллинов — 40–50%, что почти в 2 раза меньше в сравнении с таковой против Е. coli без механизма резистентности.
Цефалоспорины III–IV поколения и аминогликозиды проявляли высокую активность (100%) в отношении K. pneumoniae с обычным фенотипом чувствительности. Показатель активности защищенных пенициллинов был существенно ниже, чем цефалоспоринов для K. pneumoniae и защищенных пенициллинов для E. coli (40–60% и 76,1–86,9% соответственно).
При выявлении K. pneumoniaе — продуцента ESBL и ESBL + AmpC — определена нулевая активность незащищенных и защищенных пенициллинов, цефалоспоринов III–IV поколения, монобактама. Против K. pneumoniaе — продуцента ESBL и ESBL + AmpC — были высокоактивны (100%) in vitro цефоперазон-сульбактам, карбапенемы, аминогликозиды, а в 33,3% — хлорамфеникол.
Среди ПРВ отсутствовали Enterobacteralеs, продуцирующие карбапенемазы (CPE), — МВL, КРС и группа ОХА-48-подобных.
ЗАКЛЮЧЕНИЕ
Результаты локального микробиологического мониторинга, проведенного в 2020 году, свидетельствуют о том, что в Рязанской области у детей с инфекциями мочевыводящих путей (ИМВП) из мочи высевались преимущественно грамотрицательные бактерии (85,6%), среди которых доминировали представители порядка Enterobacteralеs (81,1%), в частности Escherichia сoli (50,4%) и Klebsiella pneumoniae (14,4%). Частота встречаемости микроорганизмов другой видовой/родовой принадлежности была значительно ниже (1,8–9%). Подобная таксономическая структура возбудителей ИМВП у детей в целом характерна для большинства регионов Российской Федерации [17].
Следует отметить, что среди уропатогенных штаммов бактерий, относящихся к порядку Enterobacteralеs, детерминанты резистентности к антимикробным препаратам (АМП) выявлялись относительно редко — у 17,8% уроизолятов, причем все они относились к продуцентам ЕSBL класса А. Комбинированные механизмы устойчивости (в частности, ЕSBL + АГМ ферменты и ЕSBL + плазмидные AmpC) регистрировались в единичных случаях. В изученной выборке бактериальных штаммов отсутствовали уроизоляты микроорганизмов-продуцентов карбапенемаз. Эти данные указывают на то, что доминирующие возбудители ИМВП у детей Рязанской области пока обладают ограниченным арсеналом механизмов резистентности к АМП.
Выявленные особенности антибиотикорезистентности уропатогенных штаммов энтеробактерий как приритетных возбудителей ИМВП у детей, с одной стороны, позволяют использовать β-лактамные антибиотики при эмпирической стартовой терапии, с другой — определяют необходимость внедрения персонифицированного подхода к выбору АМП для повышения эффективности консервативного лечения подобных пациентов.
Поступила: 08.10.2021
Принята к публикации: 18.10.2021
________
1 Европейский комитет по определению чувствительности к антимикробным препаратам. Таблицы пограничных значений для интерпретации значений МПК и диаметров зон подавления роста. Версия 10.0, 2020. URL: http://www.eucast.org (дата обращения — 10.10.2021).
2 Руководство EUCAST по выявлению механизмов резистентности и резистентности, имеющей особое клиническое и/или эпидемиологическое значение. Версия 2.0, июль 2017 г. URL: http://old.antibiotic.ru/iacmac/ru/docs/eucast/eucast-guideline-on-detection-of-resistance-mechanism... (дата обращения — 10.10.2021).








