Проявления бронхиальной обструкции (БО), часто диагностируемые у детей дошкольного возраста на фоне различных заболеваний респираторного тракта, связаны с нарушением бронхиальной проходимости функционального или органического происхождения.
Симптомокомплекс БО отражает нарушение проходимости бронхов функционального, реже органического характера. Термин «бронхообструктивный синдром» не является самостоятельным нозологическим диагнозом. В каждом конкретном случае должны быть установлены причина БО и основное заболевание[1].
Наиболее частые клинические проявления БО на фоне ОРВИ — малопродуктивный кашель, удлинение выдоха и свистящие (иногда дистанционные) хрипы, возникающие у ребенка на фоне лихорадки, катаральных явлений, ринита, как правило, на 2–3-й день болезни. Основными компонентами БО при инфекционной этиологии являются отек слизистой оболочки бронхов, воспалительная инфильтрация, гиперсекреция слизи, дистония бронхов. Спазм гладкой мускулатуры бронхов выражен в меньшей степени, чем при обострении атопической бронхиальной астмы (БА). Вклад отдельных компонентов у каждого пациента различается в зависимости от этиологии заболевания и индивидуальных особенностей реактивности[1, 2].
Как правило, эпизоды БО связаны с инфекциями верхних дыхательных путей, которые могут возникать у дошкольников от 5 до 7 раз в год[3]. Основные возбудители вирусных респираторных инфекций, для которых характерно появление БО: риновирусы (RHV) C- и D-серотипов, аденовирус (AdV), человеческий метапневмовирус (HMPV), короновирусы (HCoV-NL63, HCoV-229E, HC0V-OC43), бокавирус (HbOV), вирус парагриппа (hPIV). Респираторно-синцитиальный вирус (RSV) играет важную роль в возникновении острого бронхиолита у детей первых месяцев жизни. У детей старше 3 лет в 10–40% случаев острый обструктивный бронхит вызван Mycoplasma pneumoniaе, а в 27–58% — Chlamydophila pneumoniae [4].
Частое рецидивирование вирусных инфекций нередко сочетается с их атопическим фенотипом, и в анамнезе или при осмотре детей с ними выявляются аллергические коморбидные заболевания (экзема/атопический дерматит, аллергический ринит, риносинусит) и отягощенная аллергическими заболеваниями или реакциями наследственность. Однако у большинства пациентов наблюдаются 2–3 эпизода БО в год без повышения риска развития БА в дальнейшем. У таких детей клинические проявления БО возникают только на фоне острого респираторного заболевания, а между эпизодами нет клинических проявлений гиперреактивности бронхов[1, 5, 6]. Именно у детей дошкольного возраста сложно оценить прогноз дальнейшего течения БО. У большинства детей с эпизодической БО частота эпизодов снижается, и они полностью исчезают к 4–6 годам[6–8].
Однако повторяющиеся эпизоды БО могут быть начальными проявлениями БА, и вирусные инфекции являются ведущими триггерами обострений заболевания[4, 8]. В этих ситуациях требуются пристальное динамическое наблюдение и консультации специалиста (аллерголога/пульмонолога). Показано, что для формирования БА в раннем возрасте большое значение имеют частота и тяжесть эпизодов вирус-индуцированной обструкции нижних дыхательных путей[1, 2, 9].
На практике у врача-педиатра не всегда есть возможность оценить действительную частоту и тяжесть бронхообструктивных состояний, так как в течение жизни ребенок может наблюдаться разными врачами, а в медицинской документации не всегда отражены количество и выраженность эпизодов БО. Врачу первичного звена (педиатру, семейному врачу, врачу общей практики) важно фиксировать каждый эпизод обструкции в документации, поскольку именно персистирование на протяжении последнего года (> 3 эпизодов в год), а также эффект терапии (бронхолитиков, глюкокортикостероидов и др.) являются ключевым факторами в диагностике БА у детей дошкольного возраста[1, 10].
Сходство клинических проявлений БО, возникающей при ОРВИ и связанной с возрастными особенностями, и БА, в частности при легком и среднетяжелом ее течении, обусловило унифицированный подход к диагностике[8], отраженный в алгоритме, полезном для практического врача при постановке диагноза (рис.).
Рис. Алгоритм диагностики бронхиальной астмы (БА) у детей дошкольного возраста с рецидивирующей бронхиальной обструкцией (БО)

ТЕРАПИЯ БРОНХИАЛЬНОЙ ОБСТРУКЦИИ НА ФОНЕ ВИРУСНОЙ ИНФЕКЦИИ
В бронхиальном дереве детей раннего возраста (особенно до 2 лет) относительно мало гладкомышечных клеток, и у некоторых пациентов может наблюдаться полиморфизм β2-адренорецепторов с изменением их чувствительности[1]. Это объясняется неполным клиническим эффектом применения у таких пациентов β2-агонистов короткого действия для купирования среднетяжелой/тяжелой БО [10].
У детей при выраженной БО используются ингаляционные глюкокортикостероиды (ИГКС)[11, 12]. Будесонид суспензия — негалогенизированный ГКС, который оказывает выраженное противовоспалительное действие и обладает высоким профилем безопасности благодаря связыванию тканей и инактивации при первом прохождении через печень[13]. Препарат предназначен для небулайзерной терапии. В бронхах будесонид быстро всасывается и связывается с глюкокортикостероидными рецепторами, при этом продолжительное действие (до 24 часов) обеспечивается конъюгацией с длинноцепочечными жирными кислотами. Это свойство является уникальной особенностью молекулы будесонида и позволяет применять его 1–2 раза в сутки[13].
Важная составляющая — негеномный эффект будесонида, который включает в себя сосудосуживающее действие, снижение экссудации плазмы, продукции мокроты в дыхательных путях[13]. Быстрое уменьшение отека и гиперсекреции позволяет использовать микронизированную суспензию будесонида при вирус-индуцированной БО[14].
Своевременное проведение терапии при наличии или отсутствии факторов риска помогает добиться положительного результата и снизить гипердиагностику БА у детей раннего возраста[14, 15]>/span>. Прогноз как эпизодической, так и мультитриггерной БО может быть различным — от полного исчезновения до формирования БА[7, 8, 16].
Эффективность и безопасность суспензии будесонида продемонстрированы при обострениях БА разной степени тяжести[11, 14, 17]. Действие будесонида для небулайзера (Пульмикорт) в виде микронизированной суспензии является одним из наиболее изученных при базисной терапии у детей с БА. Использование будесонида в качестве средства базисной терапии БА и терапии обострений существенно снижает частоту дневных и ночных симптомов и потребность в препаратах скорой помощи, улучшает функцию легких и уменьшает частоту обострений[15, 17].
Будесонид суспензия отличается высоким профилем безопасности, что доказано многочисленными исследованиями[18–21]. Длительная терапия будесонид суспензией детей с БА не оказывала влияния на их конечный рост[19]. Кроме того, не было значимой разницы в минеральной плотности и уровне кальция в костях между получавшими будесонид и детьми контрольной группой[20].
Благодаря этим данным препарат разрешен детям раннего возраста, начиная с 6 месяцев, беременным женщинам и кормящим матерям[18].
Важный аспект терапии БО — доставка препарата непосредственно в дыхательные пути. Компрессорный или мембранный (электронно-сетчатый) тип небулайзера обеспечивают эффективную депозицию аэрозоля в достаточно глубокие отделы дыхательных путей без специальных усилий со стороны пациента. Современные меш-небулайзеры (мембранные небулайзеры) работают бесшумно, обеспечивают комфортную температуру и высокую скорость распыления лекарственного аэрозоля, при этом не меняя свойства лекарственного препарата. Меш-небулайзеры подходят для пациентов любого возраста, в том числе для детей.
Технология меш-распыления (Vibrating Mesh Technology) основана на «просеивании» частиц раствора через специальную сетку-мембрану. Колебания повышенных частот подаются на сетку-мембрану, а не на раствор, при этом лекарственный препарат распыляется равномерно, не разрушаясь. Среди таких небулайзеров — портативный небулайзер «Гленмарк NEBZMART» MBPN002, Omron MicroAir NE-U22 и другие.
Дополнительное разведение препарата в небулайзере не требуется, поскольку минимальный остаточный объем, например в небулайзере «Гленмарк NEBZMART», составляет всего 0,1 мл, следовательно, весь объем препарата будет введен полностью, что поможет наиболее экономно расходовать лекарственные средства.
Респирабельная фракция в меш-небулайзерах достигает 77% частиц 3–5 мкм, что позволяет лекарственному веществу проникать в дистальные отделы дыхательных путей. Применяя небулайзер «Гленмарк NEBZMART», можно использовать все лекарственные растворы, предназначенные для ингаляционной терапии, в том числе суспензии будесонида, что подтверждено техническими испытаниями прибора[22].
В ходе метаанализа, проведенного J.A. Castro-Rodríguez и соавт., дана сравнительная оценка эффективности ИГКС у детей раннего возраста (0–23 месяца) и дошкольников (2–5 лет) с рецидивирующими свистящими хрипами и БА. В метаанализе, в который включены рандомизированные проспективные контролируемые исследования, ИГКС назначались минимум на 4 недели. У пациентов, получавших ИГКС, отмечалось статистически значимое уменьшение частоты появления/обострений свистящих хрипов по сравнению с показателями детей, принимавших плацебо. Эффект ИГКС не зависел от возраста детей и от атопического анамнеза[11, 15].
В открытом исследовании, выполненном M. Kajosaari и соавт., в которое включены 117 детей (средний возраст — 2,6 месяца), госпитализированных с бронхиолитом, вызванным РС-вирусом, будесонид назначался в дозе 500 мкг 2 раза в сутки курсом на 2 месяца. За детьми осуществлялось динамическое наблюдение после выписки из стационара, после чего был сделан вывод о том, что включение ИГКС в терапию бронхиолита, вызванного РС-вирусом, возможно, уменьшает частоту бронхообструкций[12].
В результате исследования эффективности ИГКС у детей ранней возрастной группы (3–26 месяцев) с рецидивирующим кашлем или свистящими хрипами, проведенного A.S. Pelkonen и соавт.[23], сделан вывод, что будесонид улучшает показатели бронхиальной проводимости у таких детей.
В исследовании L. Campusano и соавт.[24] изучена реакция на терапию будесонидом у детей первого года жизни и дошкольников с рецидивирующими свистящими хрипами с атопией и без. Пациенты, не получавшие ИГКС до момента включения в исследование (n = 173), были разделены на две группы: в первую группу вошли дети с атопией (содержание эозинофилов в периферической крови — 4% и более), во вторую — дети без атопии (содержание эозинофилов в периферической крови менее 4%). Пациенты обеих групп получали ингаляционный будесонид в дозе 200 мкг 2 раза в сутки в течение 3 месяцев. В результате исследования был сделан следующий вывод: применение ингаляционного будесонида у детей первого года жизни и дошкольников способствует уменьшению частоты эпизодов бронхообструкции вне зависимости от наличия атопии.
В ходе рандомизированного плацебо-контролируемого двойного слепого мультицентрового исследования также изучалась безопасность небулизированной суспензии будесонида у детей 6–12 месяцев (n = 141) с персистирующей среднетяжелой БА или рецидивирующими свистящими хрипами[18]. Профиль безопасности ингаляционного будесонида был сопоставим с таковым у плацебо. При применении у детей первого года жизни с БА или свистящими хрипами на протяжении 6 месяцев будесонид не оказывал влияния на функцию надпочечников.
Согласно данным обзоров литературы, применение высоких доз ИГКС короткими курсами может уменьшить выраженность вирус-индуцированной БО[25]. Поддерживающая терапия низкими или средними дозами ИГКС рекомендована детям с частыми, повторяющимися бронхообструктивными состояниями с высоким риском возникновения БА[26]. Международные эксперты в области педиатрии и пульмонологии также поддерживают идею использования интермиттирующих курсов ИГКС как потенциальной терапевтической опции для пациентов-дошкольников при эпизодической вирус-индуцированной БО[15, 25–27].
Эксперты Китайского торакального общества создали согласительный документ, в котором даны практические рекомендации по применению ИГКС при состояниях с БО у детей раннего возраста. При выраженной обструкции рекомендована комбинация ингаляций суспензии будесонида 1 мг с бронходилататором. Ингаляции бронхолитика проводятся 3 раза каждые 20 минут в течение часа, а затем — с постепенным увеличением интервала. Для детей до 3 лет с высоким риском развития БА рекомендованы ингаляции суспензии будесонида начиная от 1 мг в день с постепенным уменьшением дозы. Курсы терапии подбираются индивидуально до 3, 6, 9 или 12 месяцев ингаляции. Необходим также контроль терапии каждые 1–3 месяца со снижением дозы будесонида до минимально эффективной [28].
Российские эксперты пришли к единому мнению, что доза суспензии будесонида при обструкции должна составлять 0,5 мг на ингаляцию 2 раза в день. Основные практические рекомендации экспертов указаны в таблице[1].
Таблица
Практические рекомендации по терапии бронхиальной обструкции и обострений бронхиальной астмы
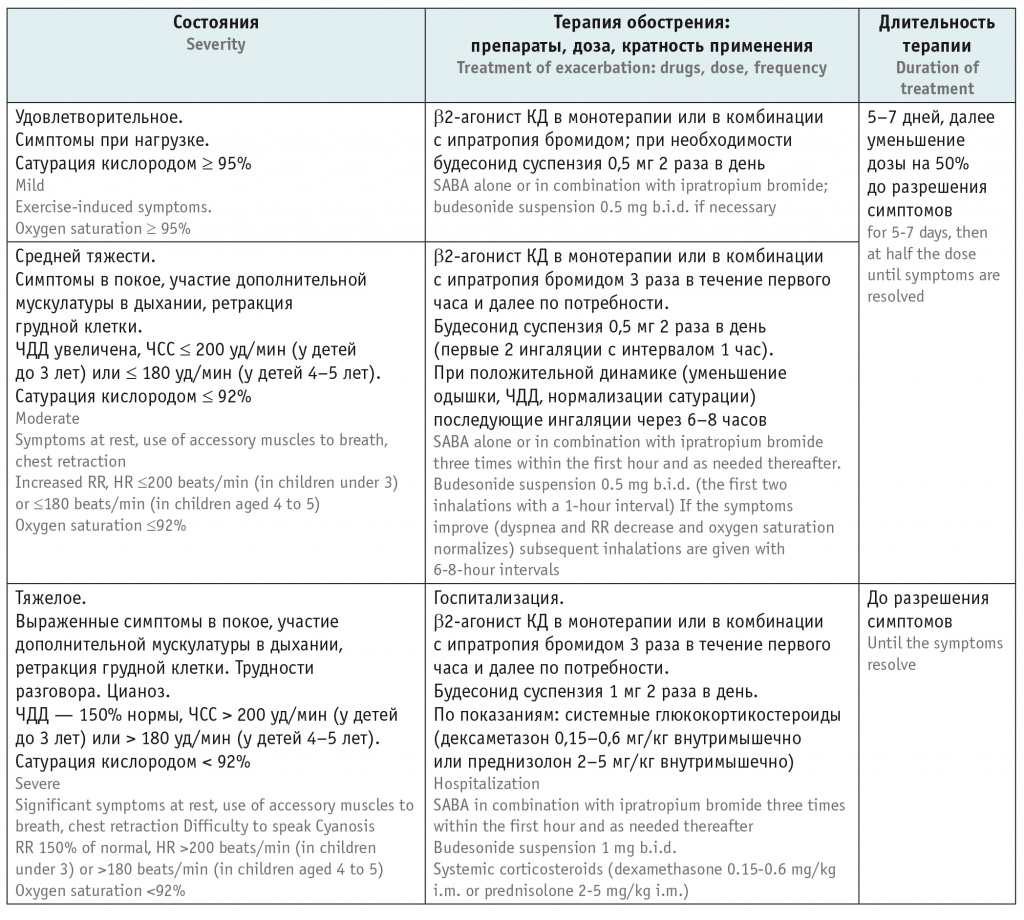
Примечание: КД — короткого действия, ЧДД — частота дыхательных движений, ЧСС — частота сердечных сокращений.
Эксперты заключили, что терапия вирус-индуцированных обострений сходна с терапией обострений БА[16]. При острой обструкции используется небулизированный ИГКС — 0,5 мг будесонида 2 раза в день на протяжении 7 дней. Если обструкция рецидивирует, рекомендуется уменьшить дозу на 50% и увеличить продолжительность терапии до 2–3 месяцев. При повторной обструкции необходима консультация аллерголога/пульмонолога для уточнения диагноза и решения вопроса о длительной противовоспалительной базисной терапии.
ЗАКЛЮЧЕНИЕ
Современные подходы к терапии бронхиальной обструкции (БО) у детей не зависят от этиологии и включают использование бронхолитической терапии в сочетании с ингаляционными глюкокортикостероидами. Необходимы мультидисциплинарное взаимодействие и ступенчатый подход к ведению детей с выраженной и повторяющейся БО.








