Основными задачами неонатального скрининга муковисцидоза (НС МВ) являются раннее выявление детей с этим наследственным заболеванием, до развития клинической картины и сокращение (в перспективе) распространенности МВ в популяции. Доказаны очевидные преимущества ранней диагностики МВ на доклиническом этапе, такие как улучшение показателей выживаемости[1], физического и когнитивного развития[2], функции дыхательной системы[3], снижение психологической нагрузки в семье пробанда в процессе диагностического поиска.
За последние 30 лет НС МВ прошел три фазы развития:
- определение уровня иммунореактивного трипсиногена (ИРТ) в 1970-х гг.;
- оценка его применимости в качестве биомаркера в ряде клинических исследований в начале 1980-х гг.;
- внедрение и распространение измерения его содержания в программах НС в системах здравоохранения развитых стран (1980–1990-е гг.)[4, 5].
В России НС МВ был начат в ряде регионов с июня 2006 г. в качестве пилотного проекта, а с января 2007 г. является обязательным во всех регионах в соответствии с Приказом Минздравсоцразвития РФ № 185 от 22.03.2006 г. «О массовом обследовании новорожденных детей на наследственные заболевания».
При этом сохраняется необходимость совершенствования подходов к оценке результатов НС МВ, поскольку концентрация ИРТ в крови новорожденных весьма динамична. Считается, что даже у здоровых детей в первые три дня после рождения она может повышаться до 58 нг/мл,затем снижаться, на 4-й день вновь повышаться, снижаясь на 5-й день, и еще раз увеличиваться к 8-му дню[6]. Возможные причины таких скачков — недоношенность и неонатальный стресс[7].
Кроме того, показано, что факторы внешней среды могут значительно влиять на уровень ИРТ в исследуемых образцах: так, он снижался на 40% в течение недели при хранении сухих пятен крови на бланках НС при температуре 27 °С и влажности 80%[8]. Загрязнение сухих пятен крови фекалиями новорожденного ведет к ложноположительному результату[9]. Считается, что повышенная температура (особенно в летние месяцы) способствует снижению активной концентрации исследуемого аналита в пятнах крови[9]. Данное обстоятельство для территории ХМАО-Югры играет весомую роль вследствие сложной логистики доставки в центральную генетическую лабораторию образцов крови из отдаленных территорий округа.
Подобная индивидуальная вариабельность сильно осложняет определение корректных референсных интервалов, необходимых для выявления МВ. Более того, тип питания (грудное/искусственное вскармливание) и этническая гетерогенность исследуемой популяции (популяционная вариабельность) также вносят свой вклад в размытость референсных интервалов при их оценке[10, 11]. О проблеме ложноположительных результатов измерения содержания ИРТ говорится и в Национальном консенсусе «Муковисцидоз: определение, диагностические критерии, терапия»[12].
В ранее представленном нами исследовании, анализировавшем результаты НС МВ в ХМАО-Югры за период 2006–2014 гг., выявлено наличие большого количества ложноположительных результатов тестирования ИРТ-1[13] и обоснована по этой причине необходимость уточнения региональных референсных показателей ИРТ. Пороговое значение биомаркера является верхней точкой так называемого референсного интервала, который представляет собой интервал значений, куда входят данные пациентов с характеристиками, аналогичными подобным у участников референс-группы[14].
В практической работе многие лаборатории используют референсные интервалы, опубликованные другими исследователями, установленные на другом оборудовании и для других популяций[15]. Это может привести к значительным искажениям реальных операционных характеристик лабораторного теста (чувствительности, специфичности и пр.). Более того, сам производитель наборов для НС МВ (Pribory Oy) в инструкции к ним указывает на необходимость разработки локальных референсных пороговых значений ИРТ (DELFIA Neonatal IRT kit. Instructions for use. Reagents for 960 (384) assays (Perkin Elmer). Last revision Feb 2011).
По умолчанию предлагается использовать порог, соответствующий 99-му процентилю в исследуемой выборке (n = 1896). Однако его абсолютные значения для пороговой концентрации ИРТ довольно значительно различаются для разных наборов: для AutoDELFIA (автоматизированное измерение ИРТ) — 73,3 нг/мл, тогда как для DELFIA (полуавтоматическое измерение) — 57,8 нг/мл (для наборов, использующихся с 2014 г.). Такая неопределенность и побудила нас провести собственное исследование для выяснения оптимального алгоритма расчетов пороговых уровней (ПУ) ИРТ.
В русскоязычной научной литературе подобные вопросы до сих пор не обсуждались, а научные статьи описывают лишь практические результаты проведения НС на территории регионов РФ за последние годы. При анализе англоязычных научных публикаций мы опирались на исследования проблематики расчета ПУ ИРТ специалистами Школы медицины Висконсина, США[16, 17].
Целью настоящего исследования стало совершенствование НС МВ путем применения плавающего ПУ (ППУ) ИРТ и сравнение его эффективности с таковой использования фиксированного ПУ (ФПУ) ИРТ в региональных условиях ХМАО-Югры.
МАТЕРИАЛЫ И МЕТОДЫ
Проведено сплошное ретроспективно-проспективное когортное исследование, в которое на этапе оценки эффективности НС МВ и определения ППУ ИРТ включались результаты всех новорожденных детей на территории ХМАО-Югры с 2006 по 2017 г. (ретроспективная часть) и результаты НС МВ за 2018 г. (проверочный этап исследования, проспективная часть).
Концентрацию ИРТ определяли с помощью коммерческих наборов DELFIA Neonatal IRT kit, AutoDELFIA Neonatal IRT kit (PerkinElmer, Wallac Oy, Финляндия) на флуориметрах Victor2, AutoDELFIA (PerkinElmer, Wallac Oy, Финляндия) методом флуоресцентного иммунного анализа с разрешением по времени.
Источником статистических данных стали лабораторные журналы НС МВ, оформленные в соответствии с упомянутым выше Приказом Минздравсоцразвития № 185 от 22.03.2006 г. Была проведена оцифровка рукописных данных (ИРТ-1, ИРТ-2, даты забора крови; для каждого образца создавался уникальный идентификационный ID-номер). Первичная статистическая обработка выполнялась в программе MS Office Excel.
ППУ ИРТ рассчитывали с помощью программного обеспечения floating Level of IRT (flIRT), разработанного нами совместно с IT-специалистами Сургутского государственного университета[18]. При этом выборка данных для расчета ППУ ИРТ производилась по принципу «скользящего» окна для всех подтвержденных случаев МВ (n = 32) за весь период ретроспективного наблюдения (2006–2017). Выбирались все показатели концентраций ИРТ-1, полученные за несколько дней лабораторных постановок, таким образом, чтобы общее число исследуемых образцов находилось в диапазоне 500–600. Для каждого случая МВ отбирали по 500 образцов, предшествующих случаю, и по 500 образцов, последующих за случаем МВ.
С помощью программного обеспечения flIRT строили гистограмму для каждой исследуемой совокупности случаев, после предварительного логарифмирования набора данных (по основанию натурального числа e) проводили первичное удаление «выбросов» методом «трех сигм» и расчет 99,5 процентиля с определением ID-номеров образцов, выходящих за границы ПУ ИРТ и предназначенных для повторного тестирования (ретеста, ИРТ-2). Образцы, выделенные в группу ретеста, экспортировались в таблицу в виде, максимально удобном для интерпретации врачами генетической лаборатории. Пороговым считали рекомендованный в указанном выше Национальном консенсусе 99,5 процентиль совокупности показателей ИРТ в пределах «скользящего окна».
В течение 2018 г. использовали стандартный (оценка ИРТ-1 по ФПУ = 57,8 нг/мл) и инновационный (оценка результатов НС МВ по ППУ > 99,5 процентиля) подходы и сравнивали их.
Идентичность происхождения сухих пятен крови для ложноотрицательного случая МВ (с ретестом ИРТ в пределах нормы) верифицировали методом ПЦР-диагностики 12 независимых полиморфизмов (тест-системы «КардиоГенетика Тромбофилия» и «Генетика Метаболизма Фолатов», «ДНК-Технология», Россия) для образцов сухих пятен крови, отобранных на первичный тест, ретест, и для образца цельной крови пациента с МВ.
При статистической обработке материала использовали непараметрические методы: определение моды, расчет процентилей, исследование операционных характеристик теста — чувствительности (Se), специфичности (Sp), прогностической ценности положительного (PPV) и отрицательного (NPV) результата[19].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
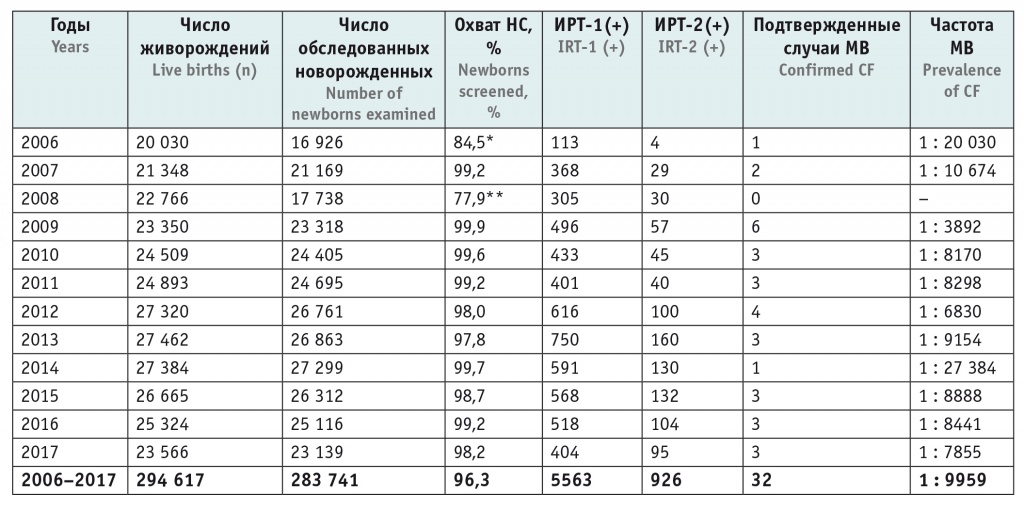
Массовый скрининг новорожденных на МВ в рамках Национального проекта «Здоровье» проводится в ХМАО-Югры с 01.06.2006 г. За период с июня 2006 г. по декабрь 2017 г. обследован 283 741 новорожденный, среднемноголетний охват скринингом составил 96,3%; при этом охват в период 2009–2017 гг. — в среднем 98,9% (табл. 1). Сниженные цифры охвата в начале проведения НС МВ связаны с рабочими моментами по внедрению инфраструктуры и логистики исследований на обширной территории ХМАО-Югры. В 2006–2017 гг. выявлены 32 пациента с подтвержденным диагнозом МВ.
Таблица 1
Результаты неонатального скрининга (НС) на муковисцидоз в ХМАО-Югры за период 2006–2017 гг.
Примечание. Здесь и в таблице 2, рисунках: ИРТ — иммунореактивный трипсиноген, МВ — муковисцидоз.
* В 2006 г. неонатальный скрининг выполнялся с июня по декабрь.
** В 2008 г. неонатальный скрининг выполнялся в течение всего года, кроме марта.
Среднемноголетняя частота МВ в ХМАО-Югры составила 1 случай на 9207 новорожденных детей; среднемноголетние операционные характеристики теста: Se — 100,0%, Sp — 98,1%; PPV — 0,65%; NPV — 100,0%. Проведены 5563 ретеста (около 2,0% от всего количества первичных исследований), из них только 32 оказались истинно-положительными. Такое число ретестов при отсутствии МВ соответствует примерно 2,5-месячному объему выполняемых исследований НС МВ.
Накопленный 12-летний опыт по осуществлению НС МВ в ХМАО-Югры и большой объем данных позволили произвести полноценное объективное исследование полученных результатов с целью возможной оптимизации существующих алгоритмов. В сплошном ретроспективном исследовании, охватывающем период 2006–2017 гг., проанализирована информация по НС МВ обо всех 32 детях с подтвержденным диагнозом МВ.
На рисунке 1 приведены данные, отображающие показатели первичных тестов ИРТ и ретестов с соответствующим диапазоном концентраций для каждого случая МВ. У 16 человек концентрация ИРТ в ретесте была ниже концентрации первичного ИРТ (темные бары), у 14 человек — выше (светлые бары).
Рис. 1. Показатели первичного теста (иммунореактивный трипсиноген 1) и ретеста (иммунореактивный трипсиноген 2) для всех случаев муковисцидоза, выявленных во время неонатального скрининга за период 2006–2017 гг. Светлые бары: ИРТ-2 > ИРТ-1; темные бары: ИРТ-2 < ИРТ-1
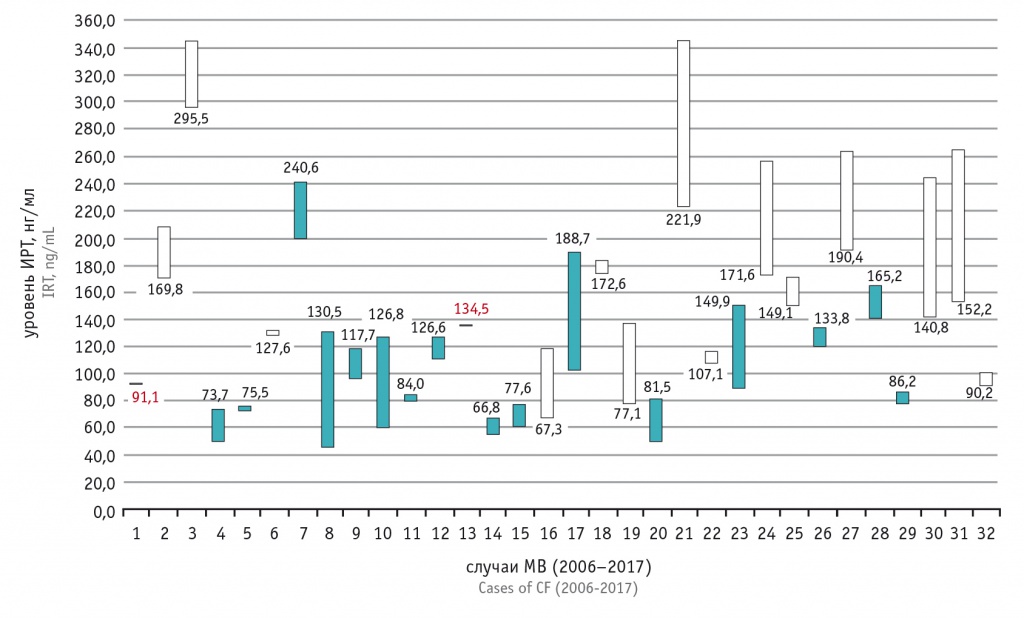
У ребенка № 1 ретест не проводился по причине отсутствия реактивов, у ребенка № 13 ретест оказался ложноотрицательным, однако при последующей проверке выяснилось, что на бланке НС была нанесена кровь другого человека (эти случаи выделены красным на диаграмме).
Красными линиями обозначены рекомендованные производителем реагента ФПУ ИРТ, при этом заметно последовательное снижение ПУ с 65,0 нг/мл до 57,8 нг/мл.
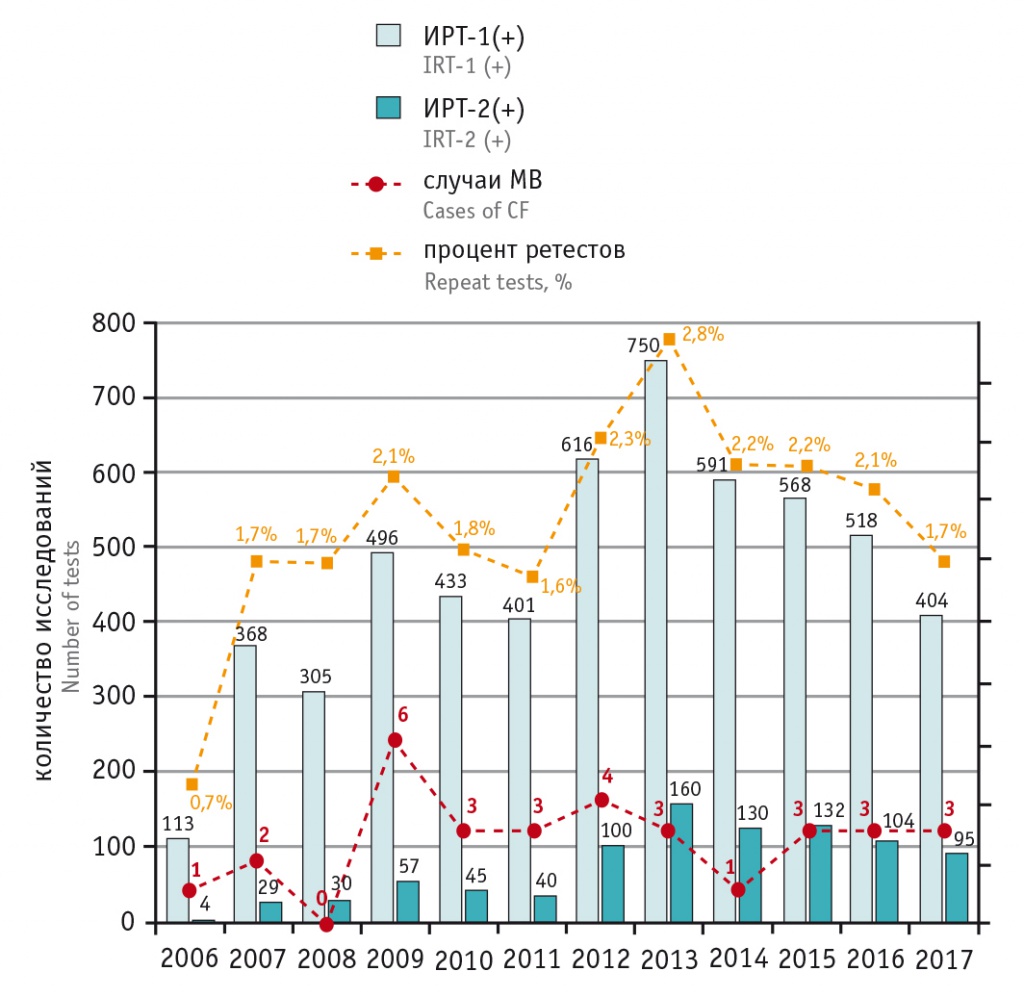
На рисунке 2 приведены диаграммы ежегодного сравнения количества образцов с концентрациями ИРТ-1, ИРТ-2 выше ФПУ и подтвержденных случаев МВ. Видно, что «просеивающая» способность НС для выявления МВ весьма высока, и в последовательных раундах скрининга возможно отобрать из десятков тысяч буквально несколько единиц образцов с истинно-положительным результатом, руководствуясь определенным пороговым значением концентрации ИРТ-1 для отбора образцов на повторное тестирование в рамках алгоритма ИРТ-1/ИРТ-2.
Рис. 2. «Просеивающая» способность неонатального скрининга на муковисцидоз в ХМАО-Югры: общее количество ретестов (абсолютное число и процент от числа первичных тестов); число положительных ретестов; число подтвержденных случаев муковисцидоза
Нами совместно с IT-специалистами СурГУ разработано программное обеспечение flIRT для быстрой статистической обработки наборов данных НС МВ. На первом этапе была визуализирована выборка из 5000 образцов ИРТ-1 за 2009 г. путем построения гистограммы (рис. 3), где наиболее частой оказалась концентрация ИРТ по величине моды в 12,5 нг/мл.
Рис. 3. Логнормальное распределение концентраций иммунореактивного трипсиногена 1 на гистограмме выборки из 5000 образцов сухих пятен крови неонатального скрининга муковисцидоза (2009)
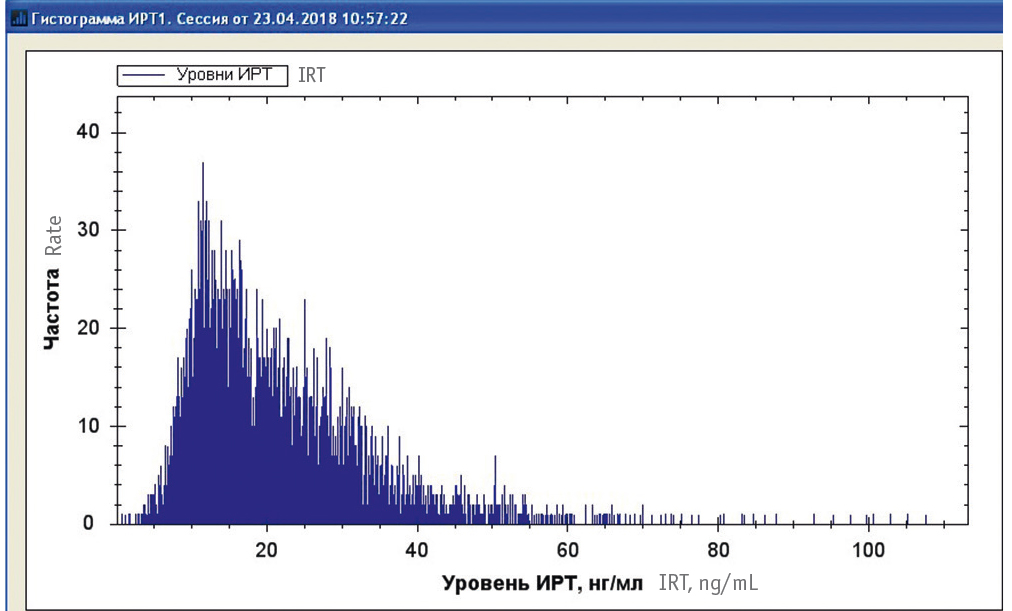
Предварительный анализ показал, что тип распределения такой выборки — логнормальный, т. к. при логарифмировании гистограмма принимает вид нормального распределения.
Большой набор неоцифрованных данных (более 283 тыс. показателей уровня ИРТ-1) значительно осложнил предстоящую задачу расчета региональных ППУ ИРТ. Поэтому мы использовали принцип «горячих точек», когда для подтверждения/опровержения применимости метода ППУ были оцифрованы и использованы для статистической обработки ограниченные, «локальные» сеты данных, группирующиеся вокруг каждого подтвержденного случая МВ с размером выборки n ≈ 1000 для каждого случая. Таким образом, при числе случаев подтвержденного МВ за всю историю проведения НС в ХМАО-Югре, равном 32, анализируемый объем выборки значительно уменьшился (≈ 32 000 уникальных данных).
Вся выборка была разбита на 32 локальных сета, причем в каждом сете позиция случая с МВ занимала такое место, чтобы была реализована возможность всестороннего анализа. Каждый сет данных разбивался на несколько частей, и каждая часть соответствовала объему ежедневной работы лаборатории и варьировала в пределах от 50 до 150 образцов.
Для каждого рабочего дня рассчитывался свой ППУ ИРТ, причем общее число образцов должно быть в пределах от 500 до 600[16]. Такая совокупность образуется при объединении результатов постановок за несколько (4–8) рабочих дней.
При вычислении (пересчете) ППУ для следующего рабочего дня некоторая часть прежних данных совокупности замещается новыми, полученными в текущий рабочий день, таким образом, чтобы соблюдался критерий 500 < n < 600. Подобное «окно» данных каждый следующий рабочий день сдвигается вправо при умозрительном расположении всех результатов на временно́й шкале (принцип «скользящего окна»). Необходимо обратить внимание на то, что для каждого сета данных ППУ вычисляется не для выборки, а для всей совокупности полученных результатов за несколько рабочих дней, что значительно повышает информационную емкость метода.
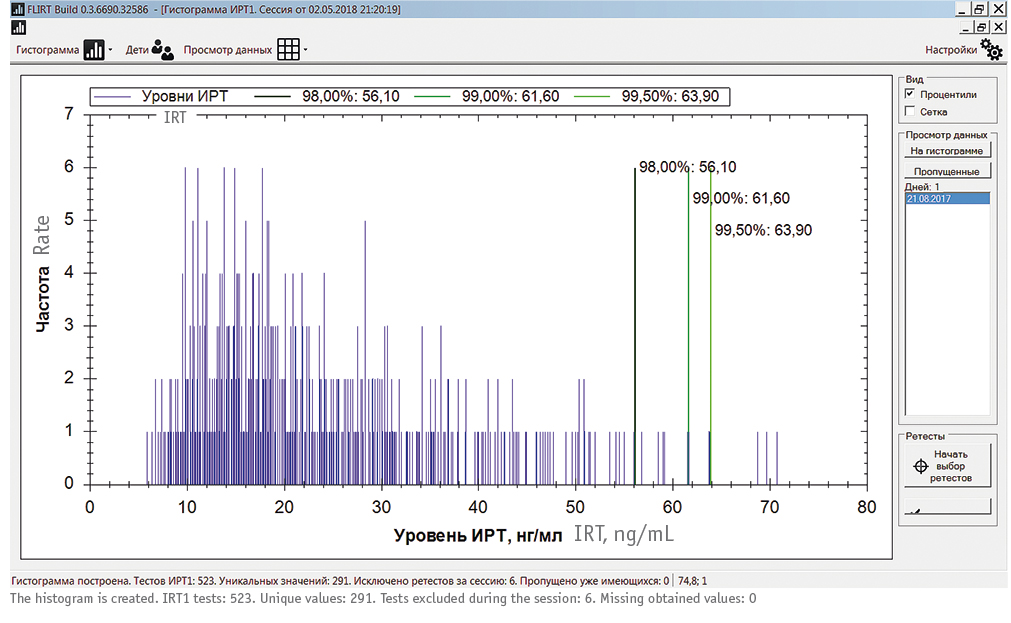
Путем последовательного отбора в качестве оптимального ПУ ИРТ был выбран 99,5 процентиль, что соответствует европейским[20] и российским[12]>/span> рекомендациям. Использование меньших значений процентилей при расчете ППУ (99-й, 95-й) показало сильное занижение порога ИРТ-1 и нецелесообразность дальнейшего моделирования с процентилями, меньшими, чем 99,5 (рис. 4). Использование алгоритма расчета ППУ ИРТ-1 для трех случаев МВ из 32 с самыми низкими цифрами ИРТ-1 (67,3; 66,8; 77,6 нг/мл) подтвердил его применимость даже для этих случаев (рис. 5).
Рис. 4. Использование программного обеспечения floating Level of IRT для расчета плавающего порогового уровня иммунореактивного трипсиногена 1 в соответствии с разными процентилями в локальной выборке из 500 образцов сухих пятен крови
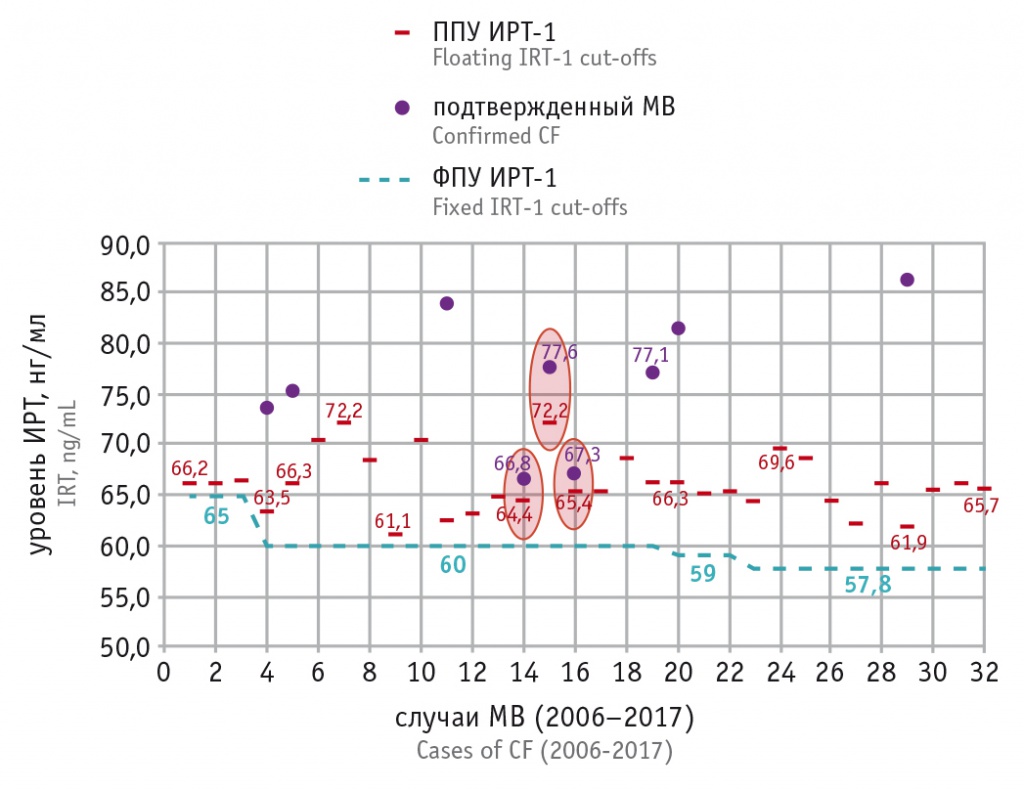
На рисунке 5 приведены ППУ ИРТ, рассчитанные для всех случаев МВ, в сравнении с фиксированными уровнями. Видно, что диапазон ППУ колеблется в пределах 61,1–72,2 нг/мл, и практически везде уровни ИРТ-1 при МВ слишком высоки, чтобы попасть в число ложноотрицательных результатов (на диаграмме обозначены только 9 таких случаев, все остальные уровни ИРТ-1 — за пределами области построения графика). Овалами выделены 3 случая МВ, при которых концентрация ИРТ-1 «вплотную» приближается к ППУ, однако во всех этих случаях ИРТ-1 > ППУ.
При анализе данных НС МВ за период 2014–2017 гг., когда применялся при расчетах ФПУ ИРТ 57,8 нг/мл, отмечено, что при использовании ППУ наблюдается значительное снижение количества результатов ИРТ-1 выше ППУ и, соответственно, количества направляемых на ретест образцов.
В течение 2018 г. проводился сравнительный анализ эффективности НС МВ с использованием двух подходов — стандартного (учет ФПУ = 57,8 нг/мл) и разработанного нами (оценка ИРТ-1 по ППУ > 99,5 процентиля), результаты представлены в таблице 2. Внедрение компьютерной программы по оценке ИРТ-1 на основе ППУ [18] позволило практически в 4 раза снизить необходимость проведения ретеста без уменьшения эффективности диагностики МВ. Всего в 2018 г. МВ впервые диагностирован у 3 детей, причем у всех этих новорожденных результат НС МВ расценен как положительный и при стандартном подходе, и при оценке показателя ИРТ-1 методом ППУ.
Таблица 2
Сравнительная оценка результатов неонатального скрининга муковисцидоза в 2018 г. при использовании фиксированного и плавающего пороговых уровней иммунореактивного трипсиногена
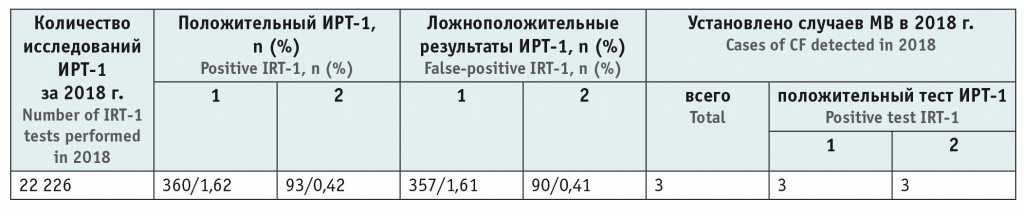
Примечание: 1 — стандартный подход (ИРТ > 57,8 нг/мл); 2 — метод плавающего порогового его уровня (ИРТ > 99,5 процентиля).
Se теста, по данным 2018 г., при использовании обоих методов оценки результатов НС МВ (ФПУ и ППУ) составила 100%, Sp при использовании ФПУ — 98,4%, ППУ — 99,6%.
Среднее значение (мода) ППУ ИРТ-1 в 2018 г. было 65,4 нг/мл против рекомендуемого изготовителем реагента ФПУ 57,8 нг/мл, минимальный ППУ — 61,9 нг/мл, максимальный — 66,2 нг/мл. Анализ НС всех случаев установленного МВ за период 2006–2018 гг. (35 детей) показал, что каждый из 35 показателей ИРТ-1 был больше соответствующего ему ППУ как при ретроспективном, так и при проспективном исследовании.
ЗАКЛЮЧЕНИЕ
Внедрение неонатального скрининга муковисцидоза (НС МВ) позволило обеспечить раннюю (уже в периоде новорожденности) диагностику заболевания и своевременно начать его базисную терапию. Ретроспективный анализ результатов НС МВ за период 2006–2017 гг. позволил установить среднемноголетнюю частоту МВ на территории ХМАО-Югры, которая составила 1 случай на 9207 живорожденных детей. Знание этого эпидемиологического показателя важно с точки зрения планирования ресурсов здравоохранения: затрат на диагностику (включая генную), дорогостоящее лечение и реабилитацию пациентов с МВ на региональном уровне.
Применение при НС МВ фиксированного порогового уровня (ФПУ) иммунореактивного трипсиногена (ИРТ) 1, рекомендованного изготовителем реагента, дает большое количество ложноположительных результатов (до 2,0% от общего числа ИРТ-1), следствием чего становятся нерациональные затраты на проведение ретеста (ИРТ-2). Негативным является и психологическое состояние родителей в ожидании повторного исследования уровня ИРТ в течение первого месяца жизни ребенка.
Разработанный метод расчета плавающего порогового уровня (ППУ) ИРТ (> 99,5 процентиля) продемонстрировал не меньшую результативность (критерий non-inferiority trial), чем традиционно используемый ФПУ ИРТ, по отсутствию ложноотрицательных результатов. Внедрение компьютерной авторской программы Floating Level of IRTV[18] по определению ППУ позволяет значительно (примерно в 4 раза) уменьшить число ложноположительных результатов, необходимость проведения ретеста и повысить специфичность теста с 98,4% до 99,6% с сохранением 100%-ной чувствительности.
Использование данной компьютерной программы максимально упрощает задачу гибкой статистической обработки данных (возможность для оператора менять по своему усмотрению размер «окна», изменять уровни процентилей и пр.). Визуализация совокупности данных на гистограмме позволяет провести наглядный контроль результатов, параллельная оцифровка результатов — аккумулировать доступную базу данных для обращений и более подробных расчетов, необходимых по каким-либо причинам в перспективе.
Благодарности: авторы выражают искреннюю благодарность ряду лиц, без которых данная работа была бы невозможна: заведующему Окружной медико-генетической консультацией (г. Сургут) Л.Н. Колбасину за информационную поддержку; врачу клинической лабораторной диагностики Н.В. Кунцевич за неоценимую помощь при оцифровке данных; IT-специалисту СурГУ И.Н. Девицыну за участие в разработке и постоянное совершенствование компьютерной программы flIRT, использованной в исследовании.








