ВВЕДЕНИЕ
Несмотря на быстрый прогресс в данной области медицины, до сих пор сохраняется потребность в ранней верификации развития критического состояния у глубоко недоношенных детей. В научных работах продолжается поиск новых инфекционно-воспалительных маркеров, которые могли бы позволить своевременно определять тяжесть состояния и выявлять развитие полиорганной недостаточности у недоношенных новорожденных детей [1]. Однако исследований, изучающих инфекционно-воспалительные маркеры у глубоко недоношенных детей, крайне мало.
Принято считать, что глубоко недоношенные дети — те, у которых масса тела при рождении менее 1500 г [2]. Процесс лечения глубоко недоношенных детей значительно осложняется тем, что у них очень быстро развивается недостаточность систем организма в ответ на инфекционно-воспалительный процесс. Полиорганная недостаточность обусловлена значительной морфологической незрелостью органов. В частности, у глубоко недоношенных детей при рождении наблюдается выраженная незрелость легких, обусловленная дефицитом сурфактанта, в связи с чем возникает диффузное ателектазирование легких, нарушается кровоснабжение легочных структур, нарастает гипоксия тканей, происходит экссудация белка в интерстициальную легочную ткань, в результате чего развивается вентиляционно-перфузионная недостаточность, которая активирует другие патологические процессы [3].
Вследствие выраженной морфофункциональной незрелости всех органов глубоко недоношенные дети плохо адаптируются к внеутробному существованию, чем и обусловлено частое и быстрое развитие у них критических состояний. В научных работах описана прямая связь неблагоприятных исходов у глубоко недоношенных детей с критическими состояниями раннего неонатального периода [4].
Следует обратить внимание на то, что в настоящее время не предложен универсальный комплекс маркеров, позволяющих своевременно диагностировать развитие критических состояний, а следовательно, и предотвращать неблагоприятные исходы на ранних стадиях патологического процесса у глубоко недоношенных детей.
Цель исследования: выявить взаимосвязь клинических и лабораторных показателей с неблагоприятным исходом у глубоко недоношенных новорожденных.
МАТЕРИАЛЫ И МЕТОДЫ
С письменного согласия родителей (законных представителей) в исследовании участвовали 38 глубоко недоношенных новорожденных детей. Исследование проводилось на базе Пермской краевой клинической больницы в перинатальном центре, в отделении реанимации и интенсивной терапии новорожденных и недоношенных детей. Все дети поступили с диагнозом респираторного дистресс-синдрома.
Критерии включения в исследование:
1) инфекционно-воспалительный процесс;
2) экстремально низкая (ЭНМТ) и очень низкая массая тела (ОНМТ) при рождении.
Критерии исключения:
1) задержка внутриутробного развития тяжелой степени;
2) внутрижелудочковые кровоизлияния III степени;
3) гемолитическая болезнь новорожденных;
4) критические врожденные пороки сердца: врожденные пороки сердца, сопровождающиеся развитием критического состояния, которое требует экстренной медицинской помощи (оперативного лечения или введения простагландинов), при отсутствии необходимой помощи ребенок гибнет в первые недели жизни [5];
5) очевидные хромосомные аномалии;
6) синдром аспирации мекония.
Пациенты были разделены на три группы. В первую группу вошли 16 детей с ЭНМТ, во вторую — 15 детей с ОНМТ, а в третью группу — 7 новорожденных, которые в последующем умерли. Необходимо отметить, что все умершие дети были с ЭНМТ, а непосредственной причиной смерти стала врожденная пневмония.
Данные, полученные при сравнении срока гестации и массы тела детей при рождении, представлены в таблице 1.
Таблица 1
Сроки гестации и масса при рождении исследуемых детей, Ме (xJ–xK) (95%-ный доверительный интервал)
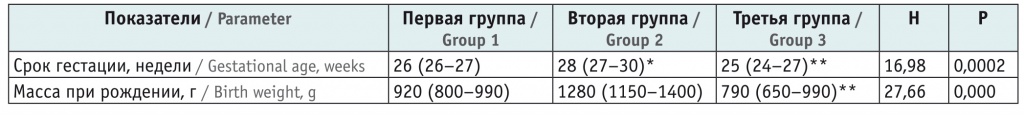
Примечания.
1. Здесь и далее отмеченные в таблицах значения Р приведены для различий между всеми тремя группами.
2. Здесь и далее в таблицах: (*) — отличия от первой группы статистически значимы по U-критерию Манна — Уитни (p < 0,05); (**) — отличия от второй группы статистически значимы по U-критерию Манна — Уитни (p < 0,05).
В исследовании учитывались данные анамнеза: срок гестации, масса тела при рождении, данные шкалы Апгар, оценка по шкале Сильвермана, потребность в ведении сурфактантов.
В 1-е, 3-и и 7-е сутки жизни у детей фиксировались потребность в инотропной поддержке, в инвазивной и неинвазивной вентиляции, тяжесть состояния по шкале Neonatal Multiple Organ Disfunction Score (NEOMOD). Проводили общий анализ крови (эритроциты, гемоглобин, гематокрит, лейкоциты, эозинофилы, миелоциты; юные, палочкоядерные и сегментоядерные нейтрофилы, лимфоциты, моноциты, тромбоциты, индекс ядерного сдвига нейтрофилов). Измеряли также биохимические показатели крови (уровни общего белка и альбумина, глюкозы, мочевины, кратинина, билирубина, АЛТ, АСТ, щелочной фосфатазы, γ-глутамилтрансферазы, СРБ, калия, натрия, кальция, лактата; скорость клубочковой фильтрации (СКФ) по модифицированной формуле Шварца: СКФ (мл/мин/1,73 м2) = 0,33 × рост (см)/креатинин сыворотки (мг%) [6]).
Амплитуду колебаний кожной температуры в эндотелиальном, нейрогенном и миогенном диапазонах регуляции микроциркуляции определяли методом вейвлет-анализа в условиях тепловой пробы.
В связи с высоким риском развития анемии биохимическое исследование крови проводилось только в 1-е и 7-е сутки жизни, однако содержание лактата измеряли на 1-е, 3-и и 7-е сутки при исследовании кислотно-щелочного равновесия организма.
Для изучения дисфункции микрососудов применялся метод, основанный на вейвлет-анализе низкоамплитудных изменений температуры кожи вследствие изменения тонуса микрососудов кожи. С этой целью использовался прибор «Микротест» (РУ № ФСР 2012/14175). С помощью указанной методики можно изучить интенсивность кровотока микрососудов кожи по амплитудам колебания кожной температуры (×103, °С).
Благодаря частотному анализу полученные результаты делятся на следующие диапазоны колебаний: эндотелиальный (0,0095–0,02 Гц), нейрогенный (0,021–0,05 Гц) и миогенный (0,051–0,14 Гц).
Данное сравнительное проспективное поперечное исследование согласовано с этическим комитетом Пермского государственного медицинского университета.
Статистическая обработка данных осуществлялась при помощи встроенного пакета анализа программы Excel 2016 MSO, авторского пакета прикладных электронных таблиц Stat 2015 (Шелудько В.С., 2001–2016). Отдельные расчеты проводились в программе MedCalc 15.8 Portable [7].
Для анализа количественных признаков при отклонении от нормального распределения применялись медиана (Me) и квартили (Q1, Q3). При оценке статистической значимости различий (р) в условиях отсутствия нормального распределения для проверки равенства медиан нескольких выборок использовались Н-критерий Краскела — Уоллиса (Н), U-критерий Манна — Уитни. Различия считались статистически значимыми при уровне значимости р < 0,05.
РЕЗУЛЬТАТЫ
При изучении показателей красной крови в общем анализе крови (табл. 2) выявлено, что пациенты третьей группы значимо отличались от участников первой и второй групп по уровням гемоглобина на 1-е и 3-и сутки и по количеству эритроцитов на 3-и сутки, однако к 7-м суткам показатели красной крови статистических различий не имели.
Таблица 2
Сравнительный анализ показателей красной крови в исследуемых группах, Ме (xJ–xK) (95%-ный доверительный интервал)
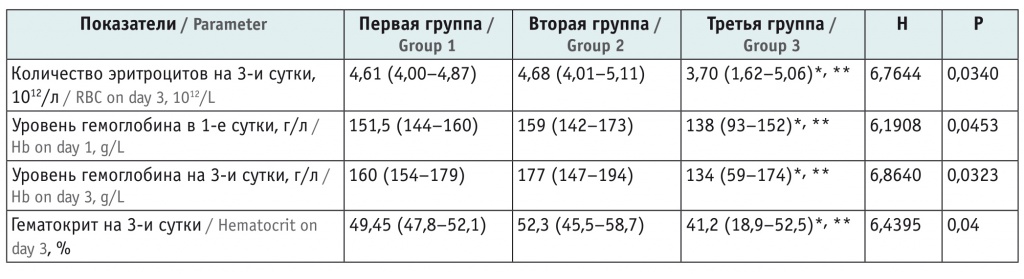
У детей с последующим летальным исходом наблюдались более низкие показатели гемоглобина в 1-е (Н = 6,1908; р = 0,0453) в 3-и (Н = 6,864; р = 0,0323) сутки жизни (для отличия от первой группы U = 24,5; p = 0,0353 и U = 26,0; p = 0,04502 соответственно; для отличия от второй группы U = 20,5; p = 0,0241 и U = 16,0; p = 0,0101). На 3-и сутки жизни в третьей группе отмечены наиболее низкие количество эритроцитов в крови (Н = 6,7644; р = 0,034) (для отличия от первой группы U = 22,0; p = 0,0231; для отличия от второй U = 18,5; p = 0,0165), а также гематокрит (Н = 6,4395; р = 0,04) (для отличия от первой группы U = 25,5; p = 0,0416; для отличия от второй U = 19,5; p = 0,0200).
По показателям красной крови первая и вторая группа значимо не различались.
При сравнении количества лейкоцитов обнаружены различия между группами на 3-и (Н = 6,24; р = 0,0442) и 7-е (Н = 8,6595; р = 0,0132) сутки жизни (табл. 3), а в 1-е сутки полученные значения значимо не различались. В первой группе на 3-и сутки жизни отмечался более выраженный лейкоцитоз, чем во второй (U = 59,0; р = 0,0158), у детей с летальным исходом значимого отличия от первой и второй групп не было.
Таблица 3
Количество лейкоцитов и лейкоцитарная формула в исследуемых группах, Ме (xJ–xK) (95%-ный доверительный интервал)
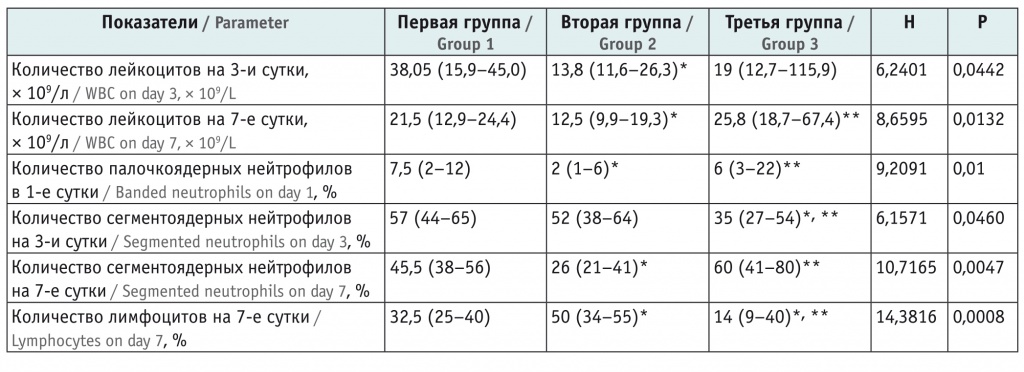
На 7-е сутки наибольшее количество лейкоцитов было в третьей группе. При попарном сравнении различались показатели лейкоцитов в первой и второй (U = 68,5; р = 0,0418), во второй и третьей группах (U = 6; р = 0,006).
В 1-е сутки участники исследуемых групп различались по количеству палочкоядерных нейтрофилов (Н = 9,2091; р = 0,01), однако при парном сравнении существенные различия зафиксированы между первой и второй (U = 57,5; р = 0,0135), второй и третьей (U = 2,65; р = 0,015) группами, а сравнение первой и третьей групп значимой разницы не выявило (U = 42; р = 0,35).
На 3-и сутки группы отличались друг от друга и по количеству сегментоядерных нейтрофилов (Н = 6,157, р = 0,046). При этом попарное сравнение с помощью U-критерия Манна — Уитни показало значимое отличие первой группы от третьей (U = 19,5; р = 0,0147) и второй от третьей (U = 24,5; р = 0,0148).
На 7-е сутки найдены значительные различия между группами по числу сегментоядерных нейтрофилов (Н = 10,7165; р = 0,0047) и лимфоцитов (Н = 14,3816; р = 0,0008). Первая и вторая группы, вторая и третья группы значимо отличались по количеству сегментоядерных нейтрофилов (U = 60; р = 0,0177 и U = 5,5; р = 0,0052) и лимфоцитов (U = 46; р = 0,0034 и U = 4; р = 0,0035), а между первой и третьей группами существенной была только разница в числе лимфоцитов (U = 15,5; р = 0,0431).
Среди биохимических показателей статистически значимые различия между группами обнаружены в содержании общего белка, креатинина, лактата (табл. 4). В 1-е сутки в сравниваемых группах наблюдалось отличие по уровням общего белка (Н = 7,2198, р = 0,0271) и альбумина (Н = 7,0028, р = 0,0302). У пациентов с летальным исходом эти показатели были самыми низкими. Найдены также значительные различия при попарном сравнении второй и третьей группы (U = 15,5; р = 0,0124), первой и третьей группы (U = 23,5; р = 0,0299) по количеству белка в крови.
Таблица 4
Биохимические показатели в исследуемых группах, Ме (xJ–xK) (95%-ный доверительный интервал)
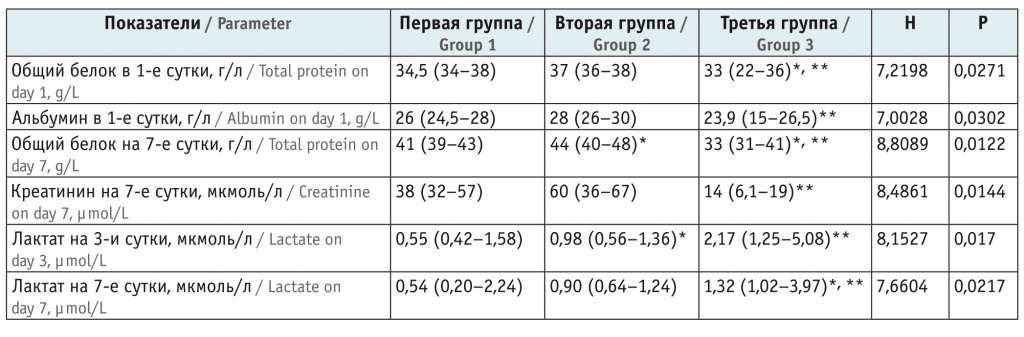
На 7-е сутки группы различались по содержанию общего белка (Н = 8,809, р = 0,0122) и креатинина (Н = 8,4861, р = 0,0144). При попарном сравнении первая и вторая группы существенно не отличались друг от друга, вторая и третья группы различались по уровню общего белка (U = 6,5; р = 0,0068) и креатинина (U = 7,5; р = 0,0109), а первая и третья группы — только по уровню общего белка (U = 12; р = 0,026).
По количеству лактата значительные различия имели место на 3-и (Н = 8,1527, р = 0,017) и 7-е (Н = 7,6604, р = 0,0217) сутки. Наиболее высокие показатели наблюдались в группе пациентов с летальным исходом. При попарном сравнении статистически значимая разница обнаружена между первой и третьей группой (на 3-и сутки: U = 2,0; р = 0,0118; на 7-е сутки: U = 3,0; р = 0,0376) и между второй и третьей (на 3-и сутки: U = 4; р = 0,0192; на 7-е сутки: U = 2,0; р = 0,0233). Группы с ОНМТ и ЭНМТ по количеству лактата значимо не отличались.
В ходе анализа общеклинических данных существенные различия зафиксированы только в тяжести состояния по шкале NEOMOD в 1-е (U = 8,769; р = 0,0125), 3-и (U = 13,348; р = 0,0013) и 7-е (U = 13,6425; р = 0,0011) сутки.
ОБСУЖДЕНИЕ
В 1-е сутки новорожденные с ЭНМТ, ОНМТ и дети с ЭНМТ, которые впоследствии умерли, существенно не различались по сроку гестации, весу при рождении, данным шкалы Апгар, оценке по шкале Сильвермана, потребности во введении сурфактантов, в инотропной поддержке, в инвазивной и неинвазивной вентиляции. Однако при анализе показателей красной крови в 1-е сутки жизни нами обнаружены более низкие показатели гемоглобина в третьей группе.
У наших пациентов не было тяжелой анемии, требующей проведения гемотрансфузии в 1-е сутки жизни. Но выявлено, что склонность к анемии при рождении может быть рассмотрена как один из прогностических маркеров летальности.
Неонатальная анемия многократно становилась объектом исследования. Известно, что в связи со сниженной продукцией эритропоэтина и быстрым увеличением объема циркулирующей крови на фоне увеличения массы тела и активного роста у глубоко недоношенных детей происходит отставание продукции эритроцитов от нарастающей потребности в них [8]. Вследствие влияния неблагоприятных факторов антенатального периода на плод происходят повреждение эритроцитов с последующим гемолизом и истощение адаптационных резервов организма [9].
Короткое время жизни эритроцитов, содержащих фетальный гемоглобин, повреждение эритроцитов неблагоприятными факторами приводят к развитию анемии [10].
Наблюдаемое нами низкое количество эритроцитов у пациентов с летальным исходом и отсутствие различия между детьми с ЭНМТ и ОНМТ может быть обусловлено истощением адаптационной системы плода под влиянием антенатальных факторов, в частности инфекции. Следовательно, у глубоко недоношенных детей анемия на момент рождения без явных признаков кровопотери может косвенно указывать на тяжесть течения инфекционного процесса.
Дети с летальным исходом статистически значимо отличались от выживших детей с ЭНМТ по количеству лейкоцитов только на 3-и и 7-е сутки. Это позволяет предположить, что причина летального исхода у детей с ЭНМТ кроется в особенностях системы адаптации и иммунного ответа.
При сравнении числа лейкоцитов и лейкоцитарной формулы в общем анализе крови в 1-е сутки жизни нами обнаружено различие только в количестве палочкоядерных нейтрофилов. Палочкоядерных нейтрофилов у детей с ЭНМТ значительно больше, чем у младенцев с ОНМТ при рождении. Вероятнее всего, это стрессовая реакция костного мозга детей с ЭНМТ на преждевременные роды.
На 3-и сутки количество лейкоцитов значимо увеличилось в первой группе (до 38,05 (15,9–45,0) × 109/л), а у детей третьей группы лейкоцитоз и лейкопения не наблюдались (19 (12,7–115,9) × 109/л).
Известно, что иммунный ответ на врожденную инфекцию состоит из двух фаз: SIRS (systemic inflammatory response syndrome — синдром системного воспалительного ответа) и CARS (compensatory antiinflammatory response syndrome — компенсаторный антивоспалительный ответ). Первая фаза (SIRS) ассоциируется с избыточной продукцией провоспалительных цитокинов в кровоток. Вторая фаза (CARS) характеризуется секрецией противовоспалительных цитокинов [11]. Отсутствие выраженных воспалительных изменений в общем анализе крови на 3-и сутки у детей с летальным исходом на фоне нарастающего уровня лактата в крови может быть обусловлено выраженным влиянием CARS.
Выраженность иммуносупрессии при врожденной инфекции в современных работах рассматривается как один из важнейших факторов летальности у новорожденных в ранний неонатальный период [12]. Чрезмерная активация противовоспалительного ответа у детей с врожденной инфекцией является одной из главных причин, приводящих к генерализации инфекции [13]. Нарастание лейкоцитоза и нейтрофилеза на 7-е сутки у детей с летальным исходом, возможно, обусловлено прогрессированием инфекционных процессов.
Между исследуемыми группами обнаружена статистически значимая разница в содержании общего белка и альбумина в 1-е сутки жизни. Наиболее низкое количество общего белка (U = 39; р = 0,01) и альбумина (U = 41,5; р = 0,04) отмечалось у новорожденных с летальным исходом, что также может свидетельствовать о влиянии неблагоприятных антенатальных факторов на плод.
Прогностическое значение гипопротеинемии и гипоальбуминемии в 1-е сутки жизни в отношении неблагоприятного исхода неоднократно подтверждалось в современных исследованиях [14, 16]. Выявить причину снижения уровня белка в крови проблематично, однако известно, что тяжелая врожденная инфекция приводит к гипопротеинемии и гипоальбуминемии [17].
Наше исследование подтверждает необходимость дальнейшего изучения взаимосвязи и влияния концентраций белка и альбумина в плазме крови в 1-е сутки жизни на другие инфекционные показатели у глубоко недоношенных новорожденных.
Значимо более низкое содержание креатинина у детей с ЭНМТ, особенно в группе детей с ЭНМТ с летальным исходом, на 7-е сутки может быть объяснено высокой потребностью и недостаточной дотацией протеина. Необходимо отметить, что все дети получали энтеральное и парентеральное питание согласно принятым действующим протоколам энтерального и парентерального питания в РФ.
В своей работе В.А. Анзоров и С.В. Морякина (2017) обнаружили статистически значимую взаимосвязь низкого уровня креатинина с низкой концентрацией белка в крови [18]. Одной из возможных причин развития гипопротеинемии на фоне адекватной дотации белка может стать дисфункция ЖКТ, вследствие которой снижается поступление протеинов из ЖКТ.
Однако увеличение белковой нагрузки способно негативно повлиять на работу незрелых почек [19]. Повреждение и дисфункция почек, сопровождающиеся протеинурией, — частое проявление полиорганной недостаточности вследствие чрезмерной активации SIRS, однако показатели СКФ и электролитов в сравниваемых группах значительно не отличалась.
В нашей работе не удалось выявить существенную разницу в регуляции микроциркуляции посредством изучения колебания кожной температуры в эндотелиальном, нейрогенном и миогенном диапазонах методом вейвлет-анализа. Возможно, диагностическую ценность данная методика имеет у здоровых и более зрелых детей [20], и это связано с незрелостью системы терморегуляции на всех регуляторных уровнях организма.
ЗАКЛЮЧЕНИЕ
На фоне тяжелого инфекционного процесса общеклинические и лабораторные маркеры системного воспалительного ответа у глубоко недоношенных детей в критическом состоянии могут оставаться в пределах нормы за счет чрезмерной активации противовоспалительных цитокинов. Врожденные гипопротеинемия, гипоальбуминемия и анемия являются наиболее перспективными маркерами неблагоприятного исхода у глубоко недоношенных детей с экстремально низкой массой тела при рождении.
Гипокреатининемия совместно с гипопротеинемией может свидетельствовать о белковой недостаточности, вызванной дисфункцией ЖКТ.
Амплитуды изменения кожной температуры в эндотелиальном, нейрогенном и миогенном диапазонах регуляции микроциркуляции малоинформативны у глубоко недоношенных детей.
Поступила: 16.07.2020
Принята к публикации: 02.09.2020








