ВВЕДЕНИЕ
Проблема нефрологической патологии у детей раннего возраста занимает особое положение в педиатрии. Это связано с высокой частотой регистрации инфекции мочевыводящих путей (ИМВП) в детской популяции, составляющей 18 случаев на 1000 детей, при этом заболевание чаще дебютирует в первые годы жизни1 [1, 2]. Существуют данные о росте удельного веса ИМВП до 36–100 случаев на 1000 детей [3]. Преобладание латентных и маломанифестных форм в раннем возрасте в дальнейшем может привести к рубцовым изменениям почечной ткани с формированием хронической болезни почек2. Прогрессирование медицинских аспектов проблемы определяет и ее социальную значимость.
После старта заболевания у 35% детей ИМВП принимает рецидивирующее течение. Среди факторов, провоцирующих рецидивы болезни, приоритетное значение имеют обструктивные уропатии и врожденные аномалии органов мочевой системы [4]. Данная патология часто встречается у недоношенных детей [5]. В нашем исследовании 6,6% детей, рожденных на 34–36-й неделях гестации, дебютировали заболеванием почек в младенчестве.
Есть мнение, что у мальчиков симптомы ИМВП обнаруживаются в первые 6 месяцев жизни, однако ситуация радикально меняется после 12 месяцев, когда заболевание проявляется у девочек3 [2, 6]. Инфекционный агент может вызывать воспаление верхних мочевыводящих путей и протекать с клиникой пиелонефрита. При вовлечении нижних мочевыводящих путей клиницист, как правило, наблюдает картину цистита.
У новорожденных основными симптомами дебюта заболевания являются лихорадка, чаще до фебрильных цифр, и рвота4 [2]. Из неспецифичных проявлений ИМВП у младенца могут быть плохое сосание, частые срыгивания, диарея, недостаточный набор массы тела. В тяжелых случаях отмечают формирование гнойных метастатических очагов в различных органах и признаки сепсиса, проявляющиеся симптомами инфекционного токсикоза в виде лихорадки, вялости, диспепсии, землистой окраски кожи [5, 7].
У детей грудного возраста симптомы обычно остаются неспецифичными: раздражительность, отсутствие аппетита, рвота, бледность, отставание в физическом развитии. И только необъяснимая лихорадка является наиболее частым признаком вялотекущей инфекции у детей первых двух лет жизни5 [5].
Специфические симптомы включают поллакиурию либо олигурию, которые можно определить по увеличению или уменьшению количества мокрых подгузников, неприятному запаху мочи и проявлению дискомфорта у ребенка при акте мочеиспускания [8, 9]. На третьем году жизни стартовые маркеры дебюта ИМВП становятся более отчетливыми и локализованными: дизурия, задержка мочеиспускания, энурез, болезненное мочеиспускание, боли в животе, и зачастую все эти симптомы проявляются на фоне лихорадки6 [1].
В отечественных клинических рекомендациях диагноз ИМВП может считаться наиболее вероятным при обнаружении лейкоцитурии более 25 клеток в 1 мкл или более 10–15 лейкоцитов в поле зрения или при обнаружении бактериурии более 100000 микробных единиц/мл при посеве мочи на стерильность7. По данным Американской академии педиатрии (American Academy of Pediatrics), ставить диагноз ИМВП детям в возрасте от 2 до 24 месяцев рекомендуется в случае положительного теста на лейкоцитарную эстеразу и при наличии в клиническом анализе мочи пиурии и/или бактериурии.
При проведении катетеризации мочевого пузыря принимают во внимание более 50000 микробных единиц в 1 мл мочи [10]. Эксперты Европейской ассоциации урологии (European Association of Urology) и Европейского общества детской урологии (European Society for Paediatric Urology) утверждают, что рост числа микробных единиц до 1000 в 1 мл катетеризованного образца мочи является достаточным критерием для подтверждения диагноза ИМВП [11].
Таким образом, своевременная диагностика заболеваний органов мочевой системы с учетом собранного анамнеза и данных проведенного комплексного обследования дает возможность прогнозировать тяжелые повреждения почек в раннем возрасте, добиваться клинико-лабораторной ремиссии и контролировать течение болезни.
Цель исследования: представить особенности современной картины течения ИМВП у детей первых двух лет жизни и систематизировать диагностические критерии.
МАТЕРИАЛЫ И МЕТОДЫ
В настоящей работе представлен анализ материалов 45 историй болезни детей в возрасте от месяца до 2 лет, госпитализированных за период 2018–2020 гг. в нефрологическое отделение ГАУЗ СО ДГКБ № 9 г. Екатеринбурга с ИМВП.
Критериями исключения стали дети с гломерулонефритом и мочекаменной болезнью. Авторы анализировали комплекс жалоб, данные анамнеза, динамику клинических симптомов и лабораторных параметров. Общеклинические исследования мочи, крови, биохимический анализ крови, выделение возбудителей в посевах мочи выполняли в лабораториях ДГКБ № 9.
Статистический анализ проводили с использованием пакета программ IBM SPSS Statistics, 20178. Результаты обследования были обработаны методами описательной статистики с вычислением средних величин, стандартных отклонений и медиан (25-й и 75-й перцентили). Анализ качественных признаков в двух независимых группах выполняли с помощью критерия χ2 с поправкой Йейтса. Сравнение количественных переменных проводили с помощью U-критерия Манна — Уитни. Сравнительную оценку эффективности протокола лечения осуществляли с помощью t-критерия Стьюдента. Для определения корреляционных связей была использована методика расчета коэффициента Пирсона. Различия считались статистически значимыми при p < 0,05.
РЕЗУЛЬТАТЫ
Характеристика выборки
В нозологической структуре ИМВП были диагностированы хронический пиелонефрит у 40% (n = 18) больных, острый пиелонефрит — у 33,3% (n = 15), ИМВП — у 26,7% (n = 12). Средний возраст пациентов составил 8,5 ± 0,6 месяца, из них мальчиков было 55,5% (n = 25), девочек — 44,4% (n = 20). Средний возраст мальчиков в момент первой госпитализации — 7,8 ± 0,8 месяца, а возраст девочек — 10,1 ± 1,0 месяца.
Сопутствующая патология
По данным анамнеза, проведенного обследования методом УЗИ, по материалам микционной цистоуретрографии и экскреторной урографии у 91,1% (n = 41) детей были выявлены структурные аномалии мочевыводящих путей, в перечне которых представлены следующие нозологии: пиелоэктазия — у 65,8% (n = 27) пациентов, гидронефроз — у 31,7% (n = 13), пузырно-мочеточниковый рефлюкс — у 31,7% (n = 13), при этом у 3 детей диагностировали активный пузырно-мочеточниковый рефлюкс и у 10 — пассивный, со степенью заброса от 2 до 5. Агенезию, аплазию одной почки и подковообразную почку наблюдали у 9,7% (n = 4) больных. Врожденные пороки развития мочевой системы определили в антенатальном периоде у 11 детей.
Отягощенность семейного анамнеза по нефрологическим заболеваниям отмечали у 35,5% (n = 16) пациентов. Родители подтверждали, что страдают хроническим пиелонефритом (20%), имеют хронический цистит и мочекаменную болезнь (8,8%), односторонний нефроптоз (2,2%), патологическую подвижность одной почки (2,2%), расщепление чашечно-лоханочной системы (2,2%).
ИМВП у детей дебютировала на фоне респираторной инфекции в 44,4% (n = 20) случаев. У 25% девочек диагностировали вульвит, подтвержденный детским гинекологом. Известно, что попадание бактериальной флоры из влагалища в мочевыводящие пути может спровоцировать начало инфекционного процесса.
Клинические особенности течения инфекции мочевыводящих путей у детей в первые два года жизни
При госпитализации в нефрологический стационар у 28,9% (n = 13) больных структурные изменения регистрировали впервые при проведении УЗИ-обследования на амбулаторном этапе наблюдения. Повышение температуры тела как моносимптом дебюта болезни отмечали у 11,1% (n = 5) детей, лихорадка была у 55,5% (n = 25) пациентов. При остром течении ИМВП температурная реакция достигала фебрильных показателей 38,5°С (37,5 : 39,1), в то время как при рецидивирующем течении заболевания температурный профиль не превышал субфебрильных значений 37,1°С (36,6 : 37,9), где p = 0,008.
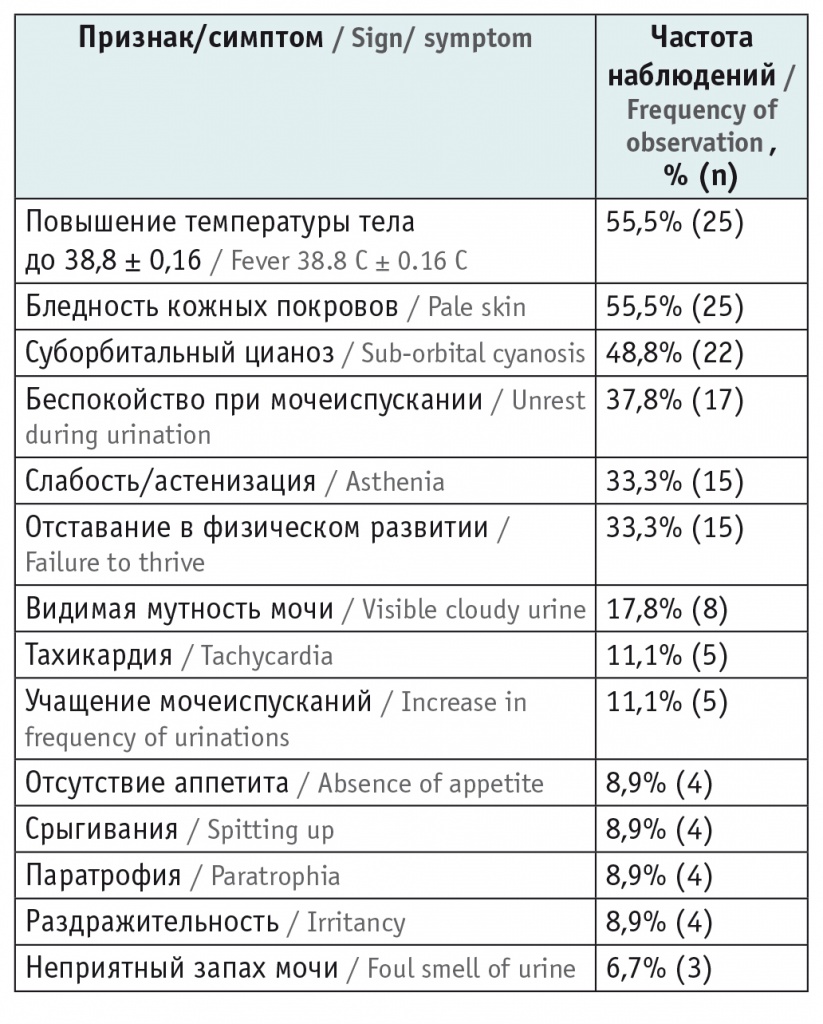
Наряду с лихорадкой, ведущими признаками заболевания стали бледность кожных покровов, астенизация, суборбитальный цианоз, а 37,8% (n = 17) детей проявляли беспокойство при акте мочеиспускания. Суборбитальный цианоз статистически значимо чаще наблюдали при хроническом течении ИМВП (p = 0,044), данный симптом был описан исследователями как маркер длительной интоксикации, часто встречающийся при хроническом пиелонефрите9. Болезненную реакцию при пальпации живота в околопупочной области мы отмечали лишь у 2 (4,4%) пациентов. Результаты анализа о частоте встречаемости клинических маркеров ИМВП представлены в таблице 1.
Таблица 1
Клинические маркеры дебюта инфекции мочевыводящих путей у детей первых двух лет жизни
Лабораторные особенности инфекции мочевыводящих путей у детей первых двух лет жизни
По данным общего анализа крови у 40% (n = 18) пациентов была выявлена анемия I–II степени, при этом у 33,3% (n = 15) — гипохромная, а у остальных — нормохромная. В 28,9% (n = 13) случаев анемия была диагностирована у больных с острыми формами ИМВП, а у 11,2% (n = 5) детей — при хроническом течении болезни (p = 0,019). Известно, что течение заболеваний мочевыделительной системы приводит к опосредованным цитокинами нарушениям в системе эритропоэза, что ведет к формированию анемии [12].
У 22,2% больных наблюдали лейкоцитоз — 21,1 (18,3 : 23,1) × 109/л со сдвигом лейкоцитарной формулы влево. У детей с острыми формами ИМВП уровень лейкоцитов в клиническом анализе крови был статистически значимо выше, чем при обострении хронического процесса, а именно 11,3 (9,6 : 19,3) × 109/л против 9,3 (7,8 : 10,5) × 109/л соответственно (p = 0,009).
Повышение показателей СОЭ до 35 мм/ч (21,5 : 39) зарегистрировали у 42,2% (n = 19) больных, поскольку нарастание уровня белков острой фазы воспаления СРБ закономерно приводит к увеличению СОЭ (r = 0,57) [13]. У 84,1% (n = 37) детей исследовали концентрацию СРБ в крови, повышение его значений в пределах 59,5 мг/л (29,2 : 74,1) отмечали у 51,3% (n = 19) пациентов. Известно, что уровень СРБ возрастает при воспалительном процессе, являясь наиболее специфичным и чувствительным лабораторным индикатором воспаления [14].
Мочевой синдром у обследованных детей являлся отражением основного заболевания. В общем анализе мочи у 86,6% (n = 39) больных мочевой осадок был представлен в виде лейкоцитурии до 42,9 (14,9 : 95,1) в поле зрения. Значимая бактериурия до 100 (30 : 200) микробных единиц в поле зрения зафиксирована у 46,6% (n = 21) детей. Повышение относительной плотности мочи наблюдали в 20% (n = 9) случаев. Обнаруживали также изменения в виде микрогематурии у 28,9% (n = 13) пациентов и в виде микропротеинурии у 22,2% (n = 10).
Этиология инфекции мочевыводящих путей у детей в первые два года жизни
Нефрологи единодушны в том, что у детей частота положительных результатов посева мочи на бактериальную флору не превышает 55% [1]. В нашем исследовании лишь в 33,4% случаев удалось обнаружить возбудителей условно-патогенной флоры, в совокупности это были бактерии Escherichia coli (45%), Klebsiella pneumoniaе (28%), Enterococcus faecalis (17%), Klebsiella oxytoca (5%), Proteus mirabilis (5%).
Результаты лечения
Руководствуясь клиническими рекомендациями, антибактериальную терапию препаратами защищенных пенициллинов либо цефалоспоринов III поколения провели 82,2% (n = 37) больных с ИМВП10. На втором этапе реабилитации 73,3% (n = 33) пациентам в качестве противомикробных средств назначали нитрофураны. С целью профилактики дисбаланса микробиоценоза кишечника 42,2% детей принимали пробиотики [7]. На фоне комплексной противомикробной терапии лабораторные показатели имели положительную динамику (табл. 2). Критерием выписки пациента из стационара было достижение позитивной динамики клинико-лабораторных маркеров воспаления на фоне нормализации общего статуса ребенка.
Таблица 2
Динамика лабораторных показателей на фоне противомикробной терапии инфекции мочевыводящих путей
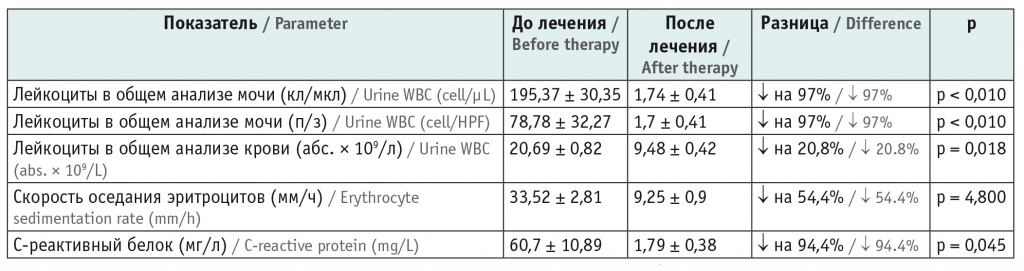
Примечания: ↓ ― уровень снижения показателя в процентах (%); п/з ― в поле зрения микроскопа.
Сравнительная характеристика
Мы провели сравнительный анализ диагностических маркеров ИМВП у детей первых двух лет жизни и обнаружили признаки, отличные от представленных в действующих клинических рекомендациях. В таблице 3 они выделены курсивом [3].
Таблица 3
Сравнительный анализ клинико-лабораторных признаков, перечисленных в клинических рекомендациях и описанных в проведенном исследовании, при инфекции мочевыводящих путей у детей
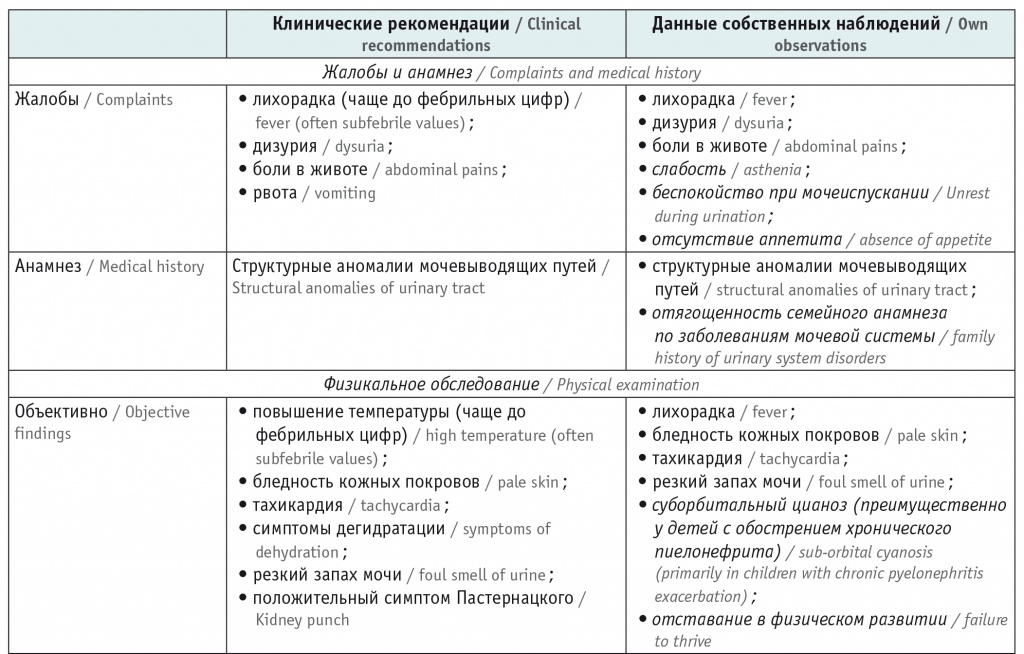
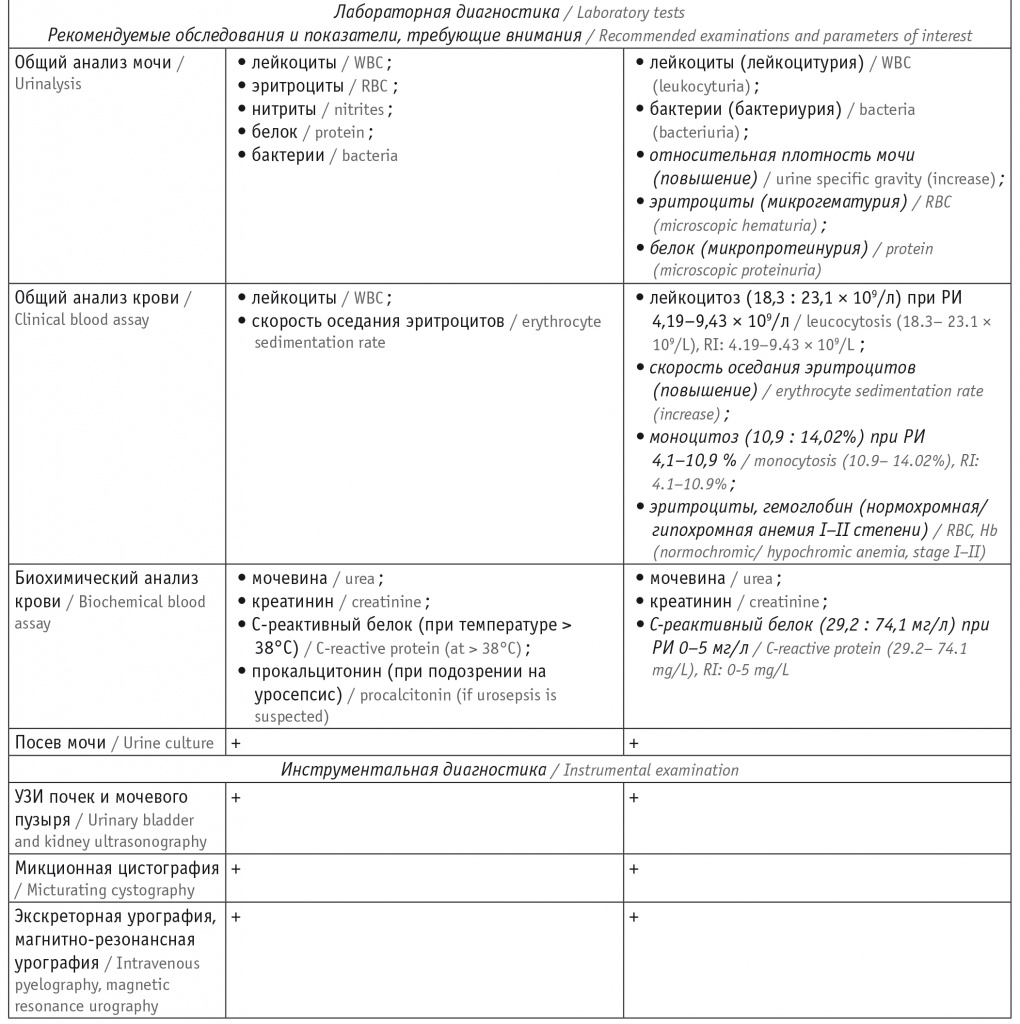
Примечание: РИ ― референсный интервал нормальных значений.
Согласно клиническим рекомендациям, диагноз ИМВП следует считать наиболее вероятным при лейкоцитурии более 25 в 1 мкл мочи либо в случае обнаружения более 10–15 микробных единиц в поле зрения при посеве мочи на стерильность. Для современной клинической картины ИМВП у детей первых двух лет жизни характерны неспецифические симптомы: лихорадка неясного генеза, бледность кожных покровов, беспокойство при мочеиспускании, слабость, отставание в физическом развитии. При выявлении данной симптоматики следует подробно собрать семейный анамнез, поскольку в трети случаев он оказывается отягощенным, а инструментальные методы обследования позволяют обнаружить у детей признаки обструктивных уропатий и пороки развития почек.
Триггером, запускающим клиническую картину ИМВП, в большинстве случаев является бактериальный агент11 [1]. Но не стоит забывать о вирусной природе заболевания у детей раннего возраста, в частности, вызывает интерес цитомегаловирусная инфекция (ЦМВИ), которая может протекать под маской мононуклеозоподобного синдрома [15-17].
Анализируя материалы исследования, мы обнаружили, что у 33,3% (n = 15) детей формировалось рецидивирующее течение ИМВП после эпизода острого респираторного заболевания, а в клинической картине болезни на фоне длительной лихорадки неясного генеза были выявлены гепатомегалия, нормохромная анемия и моноцитоз до 13% (10,9 : 14,02), где p < 0,05. Описанный синдромокомплекс характерен для течения герпесвирусной инфекции 5-го типа.
По данным авторов, ЦМВИ может протекать либо латентно, либо дебютировать под маской острого респираторного заболевания у детей раннего возраста [15, 16]. Поскольку воспаление в мочевыделительной системе может рецидивировать на фоне инфекции, были бы своевременными рекомендации по выполнению процедуры обследования больного
ребенка с помощью методов ПЦР-диагностики для обнаружения ДНК цитомегаловируса в различных биологических средах, а также с помощью методов ИФА для определения серологических маркеров вируса.
Цитомегаловирус, или вирус герпеса 5-го типа, обладая тропизмом к эндотелию сосудов почек и чашечно-лоханочной системы, может спровоцировать дебют либо обострение пиелонефрита, обеспечивая попутно реактивацию условно-патогенной микрофлоры, присутствующую в мочевых путях [16, 17]. Показано также, что цитомегаловирус играет важную роль в дебюте врожденного нефротического синдрома, а при внутриутробном инфицировании плода он приводит к формированию аномалий развития органов мочевыделительной системы, дисплазии почек [18].
К сожалению, в действующих клинических рекомендациях ни один пациент не подлежит обследованию на маркеры ЦМВИ. По нашему мнению, больные с рецидивирующим течением ИМВП при наличии косвенных клинико-лабораторных признаков ЦМВИ имеют право получить персонифицированную программу обследования с целью обоснования и проведения эффективного индивидуального протокола лечения с использованием современных противовирусных и иммуномодулирующих препаратов направленного действия [18, 19].
ЗАКЛЮЧЕНИЕ
По результатам собственного исследования мы констатируем факт того, что ИМВП у 91,1% детей первых двух лет жизни дебютировала на фоне структурных аномалий мочевыводящих путей, при этом у 35,5% пациентов — на фоне отягощенного семейного анамнеза. В клинической картине болезни преобладали неспецифические симптомы в виде лихорадки, бледности кожных покровов, суборбитального цианоза, беспокойства при акте мочеиспускания, слабости, отставания в физическом развитии. На фоне вышеизложенных нарушений обнаруживались классические изменения в общеклинических анализах крови (лейкоцитоз, повышение уровня СОЭ) и мочи (лейкоцитурия, бактериурия).
По нашему мнению, возможными этиологическими факторами, запускающими воспалительный процесс при ИМВП, могут быть не только возбудители бактериальной флоры. Вероятно, в рецидив заболевания большой вклад вносит вирус герпеса 5-го типа, или ЦМВИ. Следует обратить внимание на проявления моноцитоза и нормохромной анемии у больных с ИМВП, у которых мы наблюдали гепатомегалию по данным объективного осмотра и УЗИ органов брюшной полости.
С целью расширения спектра диагностических критериев вероятной этиологии ИМВП мы рекомендуем включить в протокол обследования современные методы в виде проведения ПЦР-тестирования ДНК цитомегаловируса из биологических сред (крови, мочи, слюны) и исследования серологических ИФА-маркеров (antiCMV IgM/IgG, antiCMV EA IgG/IgM, antiCMV IgG низкоавидных). В случае обнаружения маркеров активной репликации ЦМВИ можно предложить адекватный протокол этиотропной противовирусной терапии. Это и есть расширение горизонтов персонифицированной медицины с реализацией индивидуального протокола обследования и лечения.
Поступила: 13.10.2021
Принята к публикации: 20.10.2021
________
1 Клинические рекомендации «Инфекция мочевыводящих путей у детей». Союз педиатров России; 2018. URL: https://www.pediatr-russia.ru/information/klin-rek/deystvuyushchie-klinicheskie rekomendatsii/ИМВП%20дети%20СПР.v2%20испр_2018.pdf (дата обращения — 15.09.2020).
2 Там же.
3 Там же.
4 Там же.
5 Там же.
6 Там же.
7 Там же.
8 IBM. URL: https://www.ibm.com/ru-ru/analytics/spss-statistics-software (дата обращения — 15.09.2020).
9 Клинические рекомендации «Инфекция мочевыводящих путей у детей». Союз педиатров России; 2018. URL: https://www.pediatr-russia.ru/information/klin-rek/deystvuyushchie-klinicheskie rekomendatsii/ИМВП%20дети%20СПР.v2%20испр_2018.pdf (дата обращения — 15.09.2020).
10 Клинические рекомендации «Инфекция мочевыводящих путей у детей». Союз педиатров России; 2018. URL: https://www.pediatr-russia.ru/information/klin-rek/deystvuyushchie-klinicheskie rekomendatsii/ИМВП%20дети%20СПР.v2%20испр_2018.pdf (дата обращения — 15.09.2020).
11 Там же.








