ВВЕДЕНИЕ
Ротовая полость — это уникальная экосистема с множеством различных биотопов микроорганизмов[1]. Микробиом полости рта чрезвычайно разнообразен и включает вирусы, простейшие, грибы, археи и бактерии[2]. Идентифицировано более 1000 бактериальных филотипов, большая их часть являются комменсальными[3]. Многочисленные исследования показали связь между колонизацией патогенами и астмой, особенно в раннем детстве[4–10]. Нормальный микробиом ротовой полости выполняет защитную роль, препятствуя колонизации патогенами, что существенно для поддержания здоровья человека[11]. Для изучения роли бактерий при различных заболеваниях необходимо определить весь спектр микроорганизмов. С этих позиций метод секвенирования является самым точным, поскольку обнаруживает почти все сигнатуры ДНК микроорганизмов[12].
Десневая борозда — это пространство между эмалью коронки зуба и эпителием видимой десны, которое складывается, образуя выстланную эпителием складку вокруг зуба. Борозда открывается в полость рта, а основание желоба ограничено тонким соединительный эпителием, который заканчивается в месте прикрепления к цементной поверхности корня[13]. В микробиоме здоровой десневой борозды (глубиной до 4 мм) преобладают филотип Proteobacteria, рода: Acinetobacter, Haemophilus, Moraxella и филотип Firmicutes, рода Streptococcus, Granulicatella и Gemella, которые являются симбионтами и в большинстве случаев возвращаются в пародонтальные карманы после лечения пародонтоза[14].
Ранее установлено обогащение бронхиального микробиома взрослых с астмой родами Haemophilus, Neisseria, Fusobacterium, Porphyromonas и Sphingomonodaceae[15]. Выделенные микроорганизмы Campylobacter, Capnocytophaga, Haemophilus, Porphyromonas из нижних дыхательных путей детей с астмой (вне обострения и с обострением), были связаны с воспалительными цитокинами[16]. Колонизация ротоглотки новорожденных от матерей с астмой видами S. pneumoniae, M. catarrhalis, H. influenzae приводила к увеличению количества эозинофилов в крови и уровня общего иммуноглобулина Е (IgE) у детей в возрасте 4 лет в сравнении с детьми от матерей без астмы, при этом общая распространенность астмы в возрасте 5 лет в этой группе детей составила 33%[17]. Ранее нами был исследован микробиом зубной поверхности детей с астмой, кариесом и без него и установлено, что род Veillonella (Veillonellaceae, Selenomonadales, Negativicutes) преобладал у детей с кариесом, а относительное обилие Neisseria было значительно выше у детей без кариеса с бронхиальной астмой (p < 0,05)[18]. Исследования фактического состояния микробиома при различных заболеваниях важны, т. к. именно устойчивые комбинации микроорганизмов, а не отдельные виды бактерий могут являться триггерами заболеваний[12].
Таким образом, многочисленные исследования констатируют связь между астмой и кариесом как результат персистенции патогенов ротовой полости. Астма и кариес в большинстве случаев манифестируют в детском возрасте, когда патогены колонизируют биотопы и формируется микробиом. Информация об исследованиях микробиома десневой борозды у детей с астмой нами не обнаружена. Изучение состава микробиома на всех таксономических уровнях в данной группе детей приоритетно для понимания взаимосвязи между микробными сообществами и биотопами с установлением роли микробиома в поддержании экологического баланса.
МАТЕРИАЛЫ И МЕТОДЫ
Образцы материала десневой борозды были получены от 19 детей с обострением астмы в возрасте 3–6 лет, при наличие информированного согласия родителей или законных представителей ребенка.
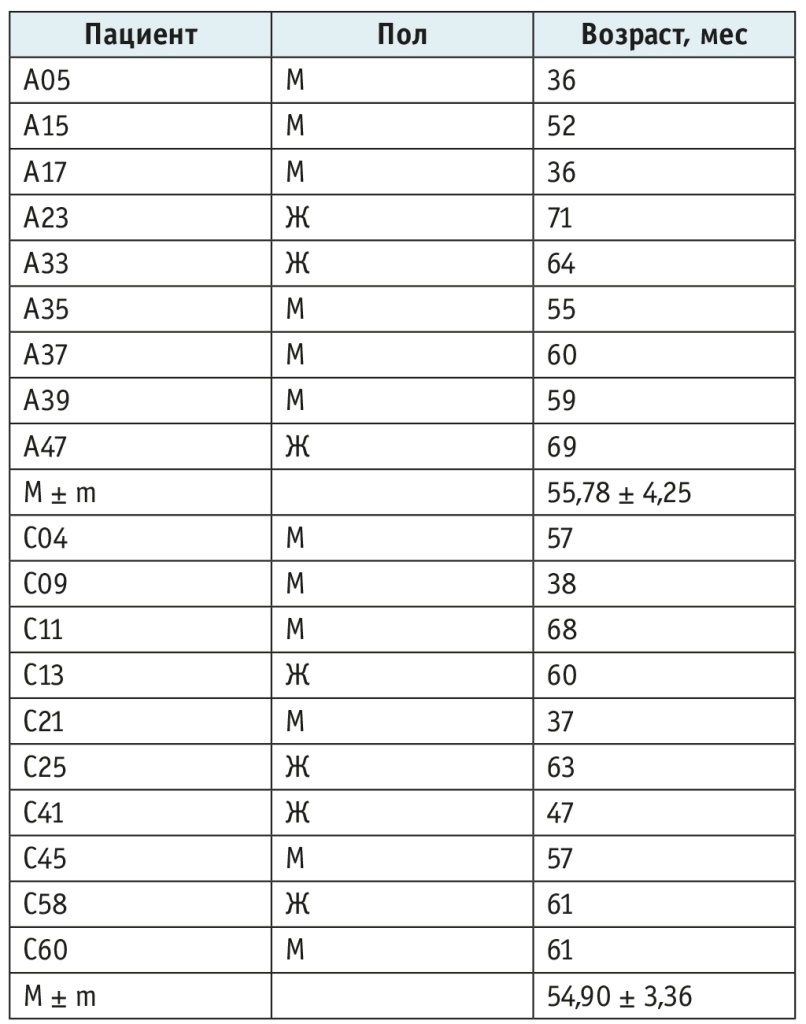
Все дети проходили обследование и лечение на базе ГАУЗ «ООКБ № 2» г. Оренбурга, Россия). Распределение по группам (табл. 1) выполнено по состоянию полости рта: в группу «А — asthma» вошли дети с астмой без кариеса зубов (n = 9; 6 мальчиков и 3 девочки; возраст 36–71 мес), группа «С — caries» — состояла из детей с астмой и кариесом (n = 10; 6 мальчиков и 4 девочки; возраст 37–68 мес). Диагноз астмы и оценка ее тяжести были основаны на критериях GINA, 2022 г.1 Все дети имели обострение средней степени тяжести, 1 ребенок — тяжелое. Только у 1 ребенка из группы с кариесом и 2 пациентов из группы без кариеса стаж астмы был более 1 года, остальные дети были с впервые установленной астмой.
Таблица 1. Характеристика обследуемых групп
Обследование детей включало осмотр специалистами: педиатром, аллергологом-иммунологом, стоматологом и пульмонологом, стандартные лабораторные показатели, в том числе IgЕ. На момент забора материала пациенты не принимали антибиотики. Лечение детей обеих групп с бронхиальной астмой в период обострения включало будесонид, ипратропия бромид/фенотерол и цетиризин. Пациент с тяжелым обострением получал преднизолон и аминофиллин.
Диагностика кариеса зубов была основана на критериях ВОЗ. Состояние здоровья полости рта и наличие кариеса пациентов было оценено при стоматологическом осмотре. Индекс интенсивности кариеса зубов измеряли путем вычисления количества кариозных, отсутствующих и запломбированных зубов. Оценка индекса интенсивности кариеса зубов включала все кариозные поражения на окклюзионных, межпроксимальных, щечных и язычных гладких поверхностях. Критерием начального кариеса было наличие белого (матового) пятна на поверхности эмали. Случаи кариеса зубов были закодированы, как 1 = присутствие, 0 = отсутствие кариеса. Индекс гигиены (ИГ) = Ки/n, где Ки — сумма индексов очистки всех исследуемых зубов; n — количество зубов, участвующих в тестировании (n = 6). ИГ: 1,1–1,5 балла — хороший; 1,6–2,0 балла – удовлетворительный; 2,1–2,5 балла — неудовлетворительный; 2,6–3,4 балла — плохой; 3,5–5,0 балла — очень плохой.
Вычислены достоверные различия концентрации IgЕ у детей с астмой (табл. 2) в зависимости от наличия кариеса. Уровень IgE был достоверно выше в группе детей с кариесом в сравнении с показателем у детей без кариеса.
Таблица 2. Концентрация иммуноглобулина Е (IgE) в зависимости от состояния ротовой полости обследованных детей
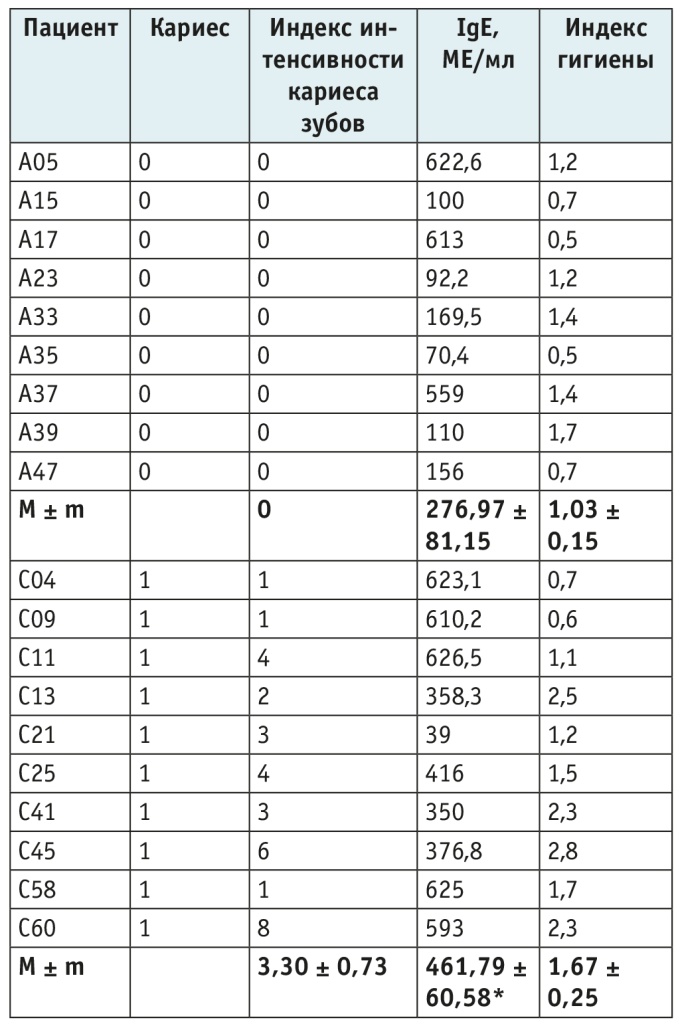
Примечание. *р < 0,05 по сравнению с детьми без кариеса.
Забор образцов десневого субстрата проводили с использованием индивидуальных стерильных кюреток утром, после пробуждения, через 12 ч после вечерней чистки зубов и последнего приема пищи у детей без кариеса — из мезобуккальных участков левого моляра (7.5), у детей с кариесом — из мезобуккальных участков наиболее пораженного молочного зуба. Материал помещали в стерильные пробирки Эппендорфа с 0,2 мл буферного раствора ДНК-Экспресс («Литех»), до выделения ДНК хранили при –20°C. Обработку и последующий анализ образцов проводили в Институте клеточного и внутриклеточного симбиоза УрО РАН. Процедура включала извлечение ДНК, подготовку библиотеки ДНК, высокопроизводительное секвенирование и биоинформационный анализ. Библиотеки были секвенированы на платформе MiSeq (Illumina). Таксономическую классификацию последовательностей проводили с использованием эталонных баз данных RDP и NCBI.
Методы математической обработки
Сообщества микробиома десневой борозды проанализированы на уровне операционно-таксономических единиц (ОТЕ), микробное богатство десневой борозды оценивали по показателям глубины охвата (Good's coverage) и индекса разнообразия Chao1. Сравнение индексов разнообразия между группами проводили с использованием U–критерий Манна — Уитни.
Суммарное богатство бактериальных сообществ оценивали с помощью анализа кривых разрежения, график построен с использованием ресурса QIIME2. Бактериальные сообщества сравнивали с помощью метода главных компонент (PCoA) на основе расстояний Брея — Кертиса, двумерный график на уровне ОТЕ построен с помощью MicrobiomeAnalyst[19, 20]. Различия бактериальных сообществ оценивали на основании построения филогенетического дерева (UniFrac). Различия между таксонами проводили с помощью статистических методов Манна — Уитни и Краскала — Уоллиса.
РЕЗУЛЬТАТЫ
Полученные ОТЕ сгруппированы на уровне сходства 97%; микробное богатство десневой борозды (Good's coverage) и индекс разнообразия Chao1 были высокими, что указывает на достаточное разнообразие видов в группах. Сравнение индексов разнообразия не выявило статистически значимых различий между группами.
Таблица 3. Характеристика образцов
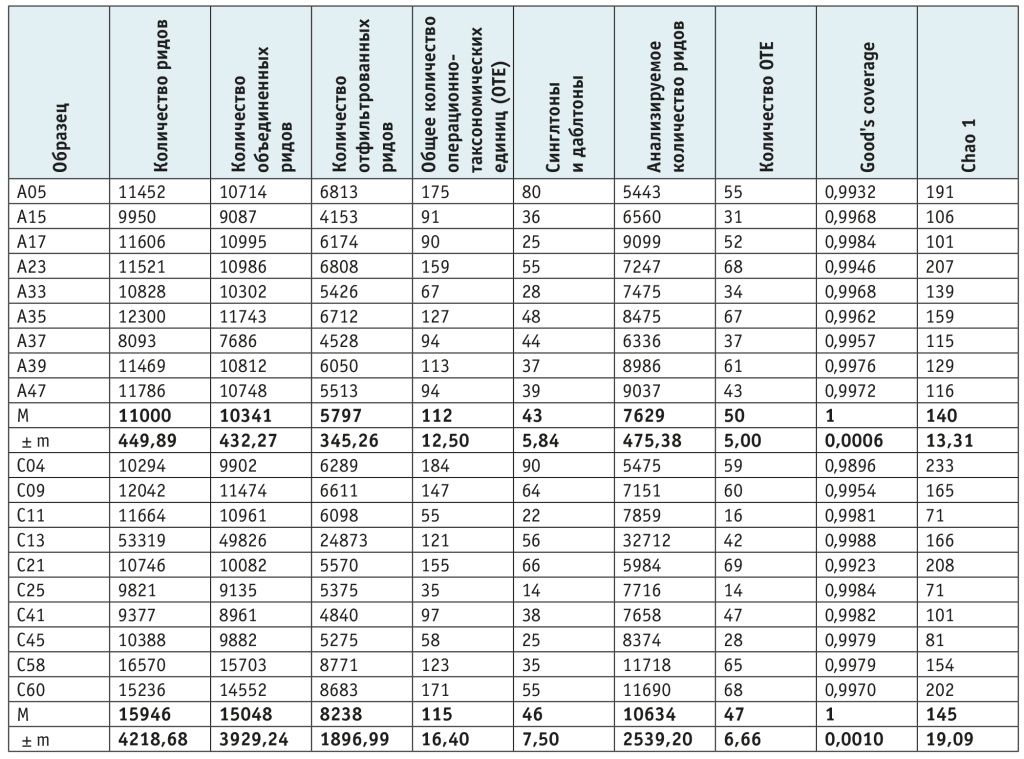
Примечание. M — среднее; m — стандартная ошибка выборочного среднего; U-критерий Манна — Уитни показал отсутствие достоверных различий между группами по всем показателям.
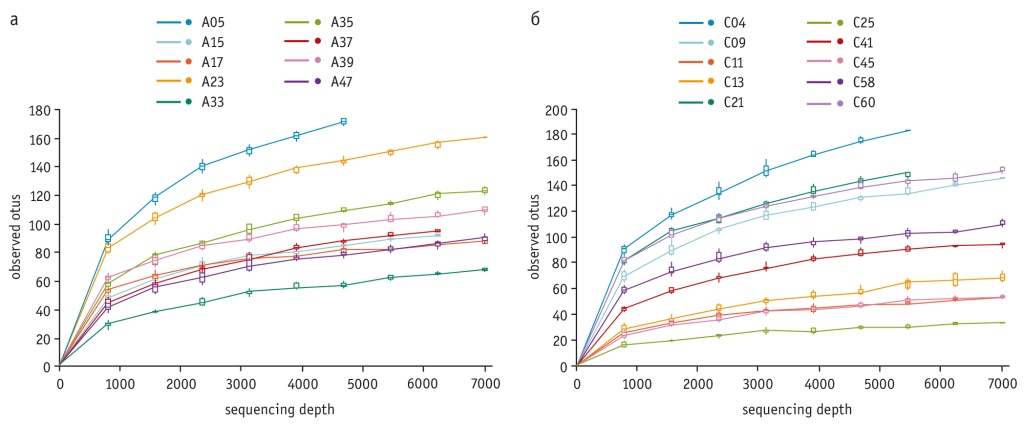
Проведенная оценка суммарного богатства бактериальных сообществ для групп А и С показала, что глубина секвенирования была достаточной (рис. 1), учтено практически все разнообразие в исследуемых образцах (выход на плато).
Рис. 1. Кривые разрежения: а — для группы А (астма без кариеса); б — для группы С (кариес с астмой). По осям абсцисс — количество ридов, по осям ординат — количество операционных таксономических единиц
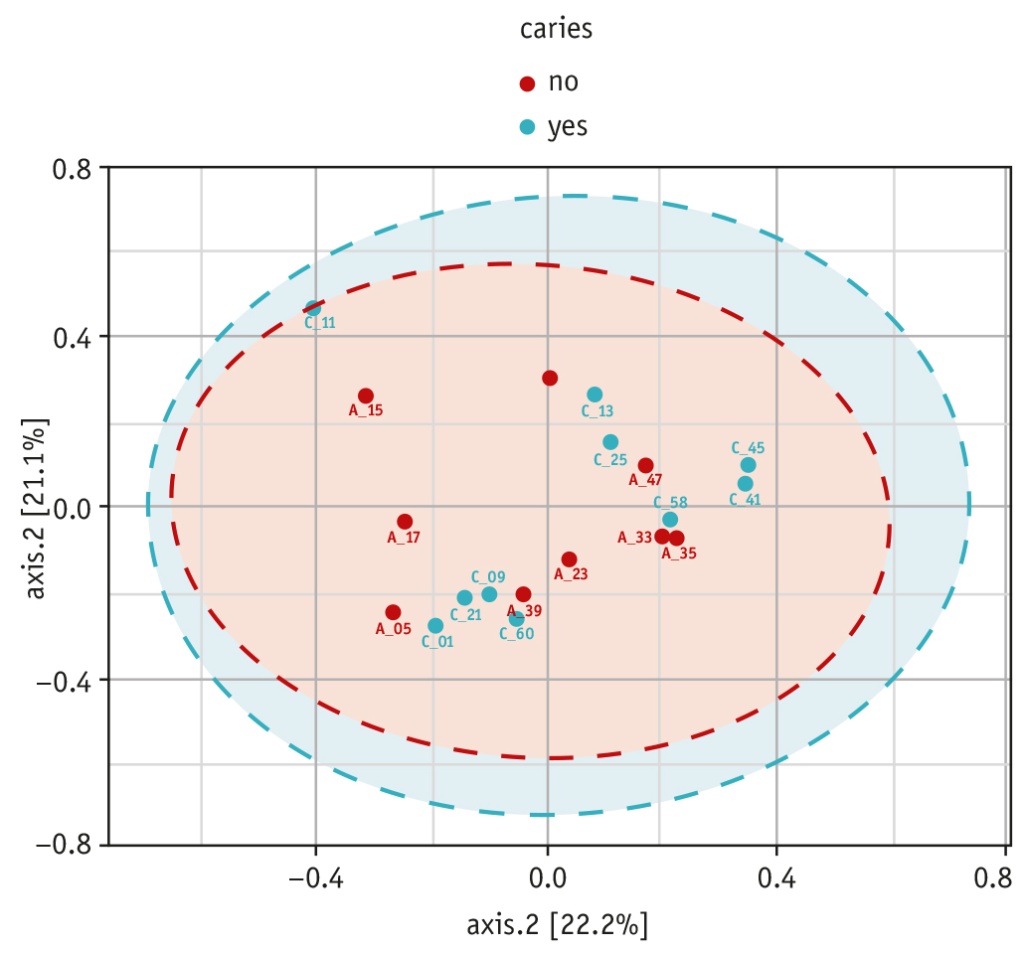
Метод главных компонент показал значительное перекрытие между образцами групп А и С (все образцы расположились в проекции малого круга, что свидетельствует об их сходности по составу ОТЕ, но при этом объединения образцов по кариесу не обнаружено (рис. 2). Два образца — С_11 и А_15 — расположились отдельно от других (эти образцы имели небольшое количество ОТЕ, но клинические данные детей существенно не различались).
Рис. 2. Двумерный график десневых сообществ.
Красным обозначены образцы группы А, голубым — группы С. Подпись включает идентификационный номер образца
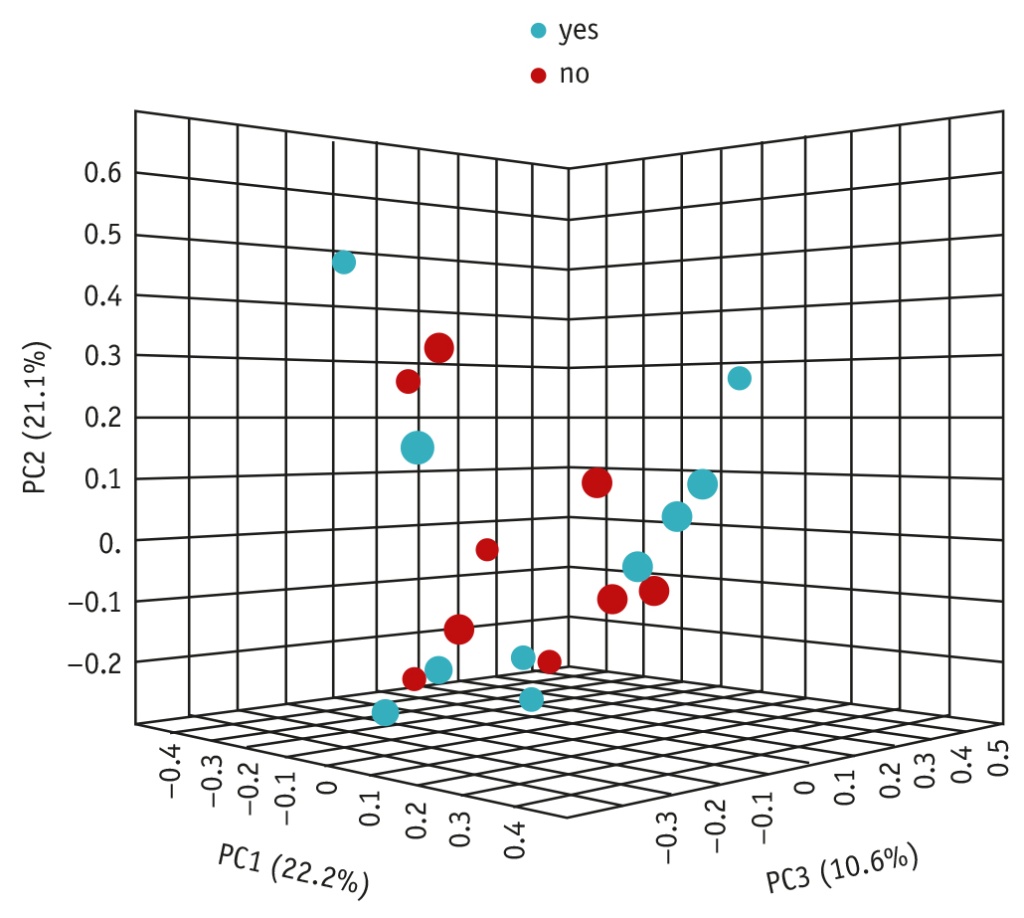
Согласно полученным данным, на трехмерном графике микробных сообществ десневой борозды четких различий между сравниваемыми группами по составу и общему разнообразию бактериальных ОТЕ также не установлено (рис. 3).
Рис. 3. Трехмерный график микробных сообществ десневой борозды.
Красным обозначены образцы группы А, голубым — группы С
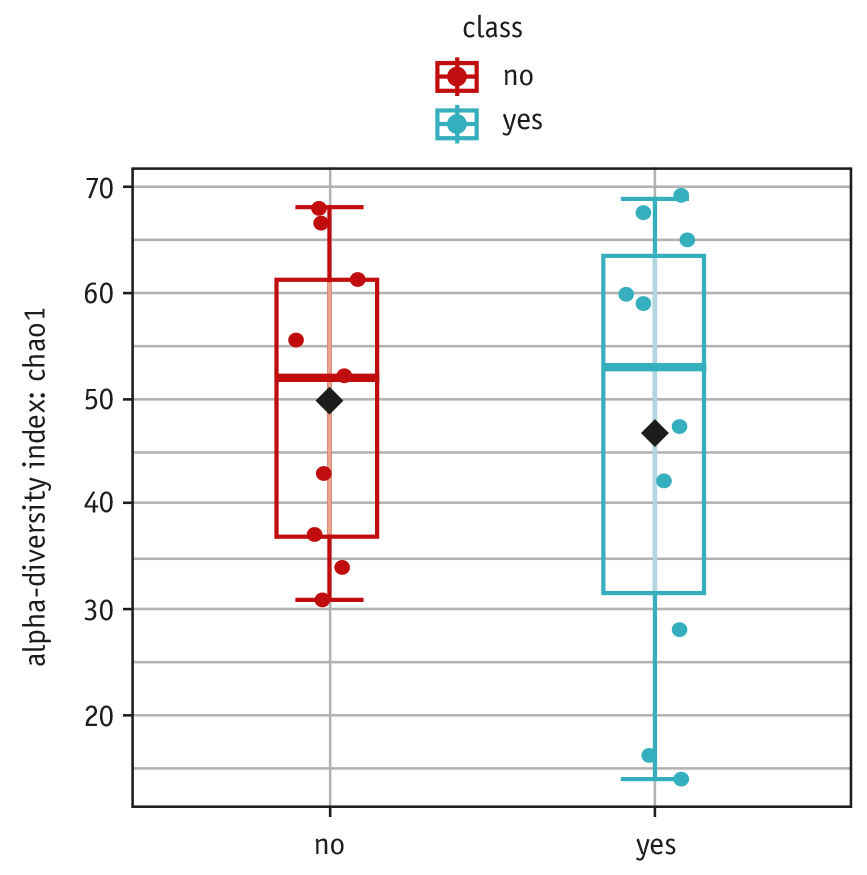
Анализ альфа-разнообразия не выявил существенных различий между образцами групп (рис. 4). При этом практически одинаковое количество образцов расположено в центре, что свидетельствует о том, что бо́льшая часть образцов имеет сходный состав, несмотря на отсутствие или наличие кариеса.
Рис. 4. Альфа-разнообразие микробных сообществ десневой борозды.
Красным обозначены образцы группы А, голубым — группы С
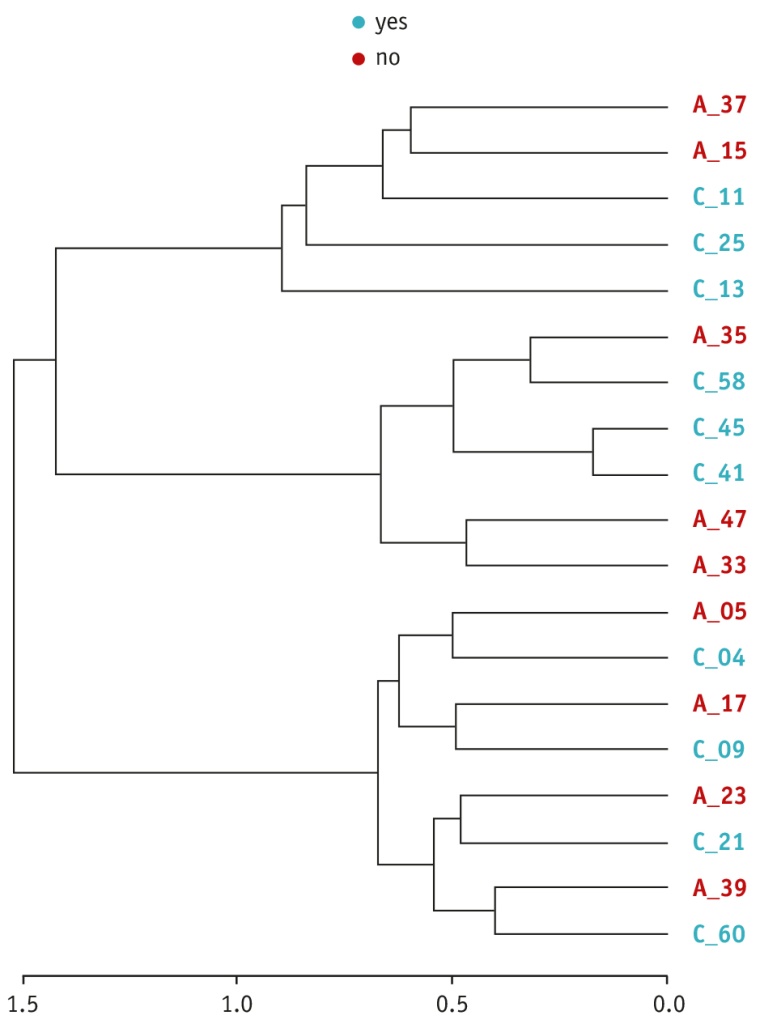
Филогенетическое дерево показало разделение бактериального сообщества на три основные ветви, в которые вошли образцы обеих групп (рис. 5).
Рис. 5. Распределение бактериальных сообществ по составу.
Красным обозначены образцы группы А, голубым — группы С
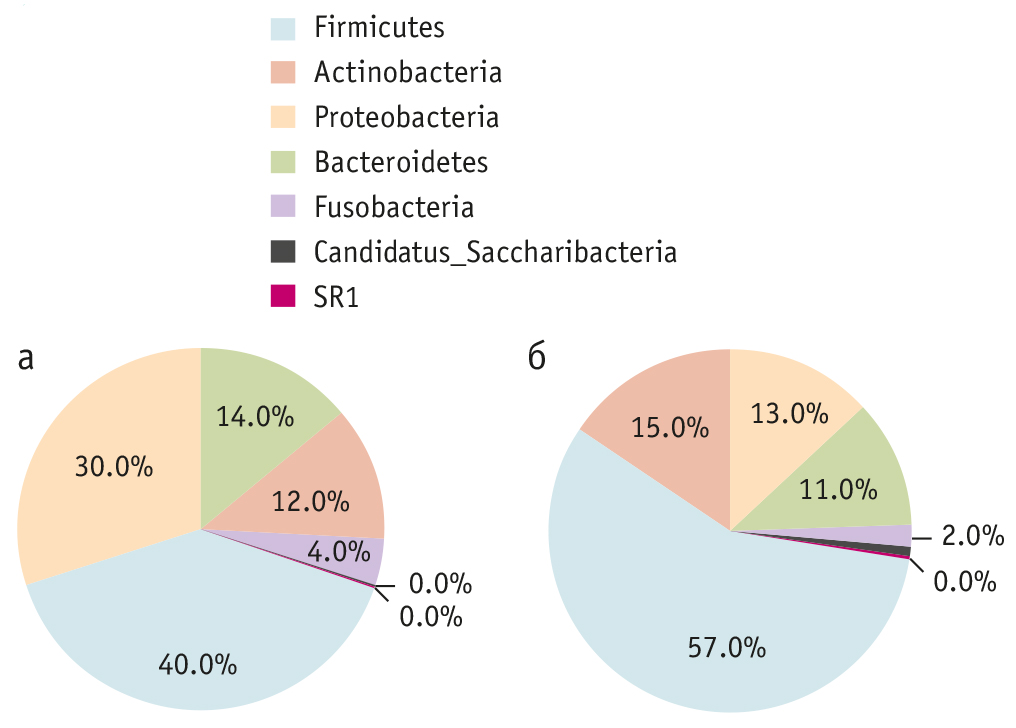
Оценка таксономии образцов десны установила 7 бактериальных типов, 12 классов бактерий, 18 порядков бактерий, 26 семейств бактерий. Большинство последовательностей в группах были отнесены к 5 бактериальным филумам (первые четыре выявлены у всех детей). В группе С выявлены Firmicutes, Actinobacteria, Proteobacteria, Bacteroidetes, Fusobacteria (частота встречаемости филумов в образце более 1%, записано по убыванию). В группе А последовательность бактериальных филумов иная: Firmicutes, Proteobacteria, Bacteroidetes, Actinobacteria, Fusobacteria, достоверных различий на уровне филума межу группами А и С не установлено. Филумы Candidatus Saccharibacteria и SR1 встречались менее чем в 1% проанализированных ридов в образцах (рис. 6).
Рис. 6. Распределение бактериальных филумов.
а — группа А; б — группа С
Достоверные различия выявлены на уровне порядка — Burkhoideriles, семейства — Burkholderiaceae (достоверно преобладает у детей с астмой; p = 0,053), на уровне рода — Lautropia (p = 0,05), различия на уровне вида представлены на рис. 7.
Рис. 7. Численность видов бактерий в группах.
Голубые — группа C; красные — группа A. *p < 0,05 между таксонами
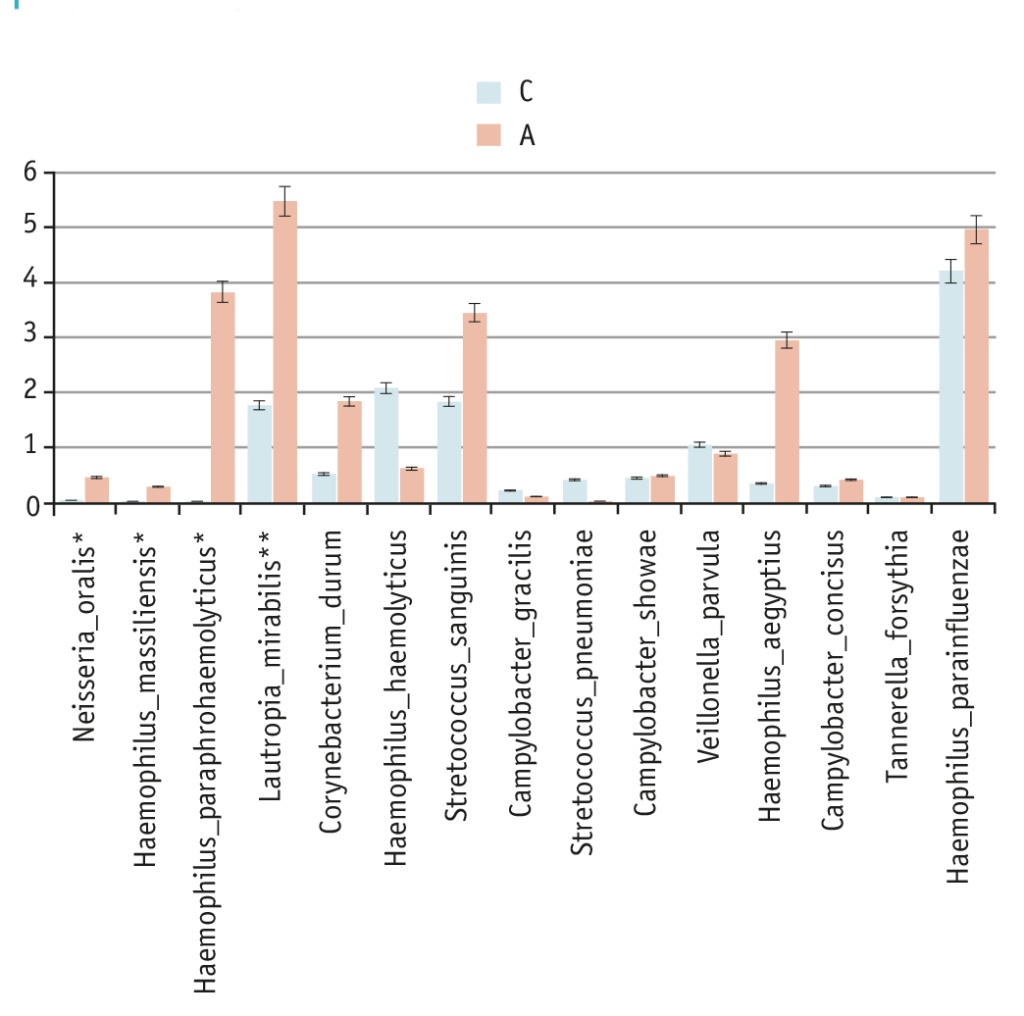
На уровне вида также в группе детей с астмой достоверно более значимо было превышение OUT для Neisseria oralis (p = 0,0073), Haemophilus massiliensis (p = 0,046), Haemophilus paraphrohaemolyticus (p = 0,05) и Lautropia mirabilis (p = 0,05).
ЗАКЛЮЧЕНИЕ
В результате проведенных исследований установлено, что у детей с бронхиальной астмой микробиом десневой борозды состоит из 5 основных филумов: Firmicutes, Proteobacteria, Actinobacteria, Fusobacterium и Bacteroidetes. Доминирующим родом микробиома десневой борозды у детей с астмой является Streptococcus, что согласуется с предыдущими исследованием.
Определено, что представленность «основных» родов десневой борозды отличалась в зависимости от наличия кариеса. В топ-10 родов вошли 7 общих для 2 групп: Streptococcus, Veillonella, Rothia, Haemophilus, Neisseria, Actinomyces, Capnocytophaga. Состав «основного микробиома» детей со здоровой ротовой полостью отличался присутствием в нем родов Lautropia, Gemella, Corynebacterium, в то время как у пациентов с кариесом — Porphyromonas, Granulicatella и Prevotella.
Установлены достоверные различия между относительной распространенностью отдельных видов микробиома десневой борозды детей с астмой. Достоверное превышение относительной численности видов «здоровой» микробиоты десневой борозды детей с астмой и здоровой полостью рта, относящихся к филуму Proteobacteria (N. oralis, L. mirabilis), подтверждает ее защитные свойства, а достоверное преобладание условно-патогенной микробиоты (H. paraphrohaemolyticus, H. massiliensis) может являться признаком дисбиоза ротовой полости при астме.
Проведенное исследование показало, что полученная комбинация микробов может рассматриваться в качестве биомаркера (предиктора) астмы, что косвенно подтверждается достоверным увеличением уровня IgЕ в группе детей с астмой в сочетании с кариесом. Гиперпродукция IgЕ у детей, страдающих астмой и кариесом, возможно, связана с кариесогенной флорой, что требует дальнейшего изучения.
Поступила: 30.05.2023
Принята к публикации: 29.09.2023
________
1 Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention, 2022. URL: https://ginasthma.org









