ВВЕДЕНИЕ
Хотя иммунный компонент патогенеза психических заболеваний эндогенного круга (шизофрении, шизоаффективного психоза) установлен, роль и участие иммунных механизмов в развитии заболеваний остаются недостаточно ясными. Дальнейшее расширение наших знаний возможно в связи с появлением новых технологий, позволяющих более дифференцированно выявлять иммунометаболические аномалии, свойственные различным, в том числе психическим, болезням. К таким технологиям относятся методы ИФА «ЭЛИ-Тест» (разработчик — медицинский исследовательский центр «Иммункулус»).
Эти технологии базируются на относительно новых взглядах на роль иммунной системы, которая заключается в поддержании постоянства молекулярного состава организма и гомеостатической регуляции самых разных молекулярно-клеточных процессов в изменяющихся условиях внешней и внутренней среды.
Рассматриваемые сложные функции иммунной системы обеспечиваются всепроникающей мультикомпонентной системой естественных аутоантител (ауто-АТ), живо откликающейся количественными изменениями на различные функционально-метаболические перестройки в обособленных популяциях клеток, органах и организме в целом[1]. Множество естественных ауто-АТ, специфичных для самых разных аутоантигенов, постоянно синтезируются и присутствуют в сыворотке крови и иных биологических средах каждого здорового человека. Совокупность ауто-АТ, направленных к различным мембранным, цитоплазматическим и ядерным антигенам клеток организма и межклеточного матрикса, а также секреторным продуктам клеток, формирует динамический «иммунологический гомункулус», или «иммункулус»[1].
Иммункулус организован по голографическому принципу, где каждая часть целого отражает это целое. Поэтому содержание ауто-АТ одной и той же антигенной специфичности у индивида практически одинаково в разных участках кровотока. По изменениям в содержании ауто-АТ определенной органоспецифичности оказывается возможным получать информацию о состоянии популяций специализированных клеток разной анатомической локализации, о повреждениях различных органов, об изменениях экспрессии/продукции/секреции определенных рецепторов, биорегуляторов, дифференцировочных антигенов и т. д., причем диагностическое и/или прогностическое значение заключения, основанного на одновременном определении уровней ауто-АТ разной специфичности, существенно повышается.
Это диктует необходимость давать мультикомпонентную оценку содержания ауто-АТ, что позволяет проводить системный анализ для уточнения роли и участия патоиммунных механизмов в развитии психических заболеваний. Ранее такой анализ (на основании «ЭЛИ-Нейро-Теста» из 12 ауто-АТ) был нами проведен у больных шизофренией и позволил выявить множественные аномалии уровней ауто-АТ к антигенам нервной ткани при этом заболевании[2].
Так, у больных шизофренией найдены аномалии профилей ауто-АТ к глиальному фибриллярному кислому белку (glial fibrillary acidic protein, GFAP), основному белку миелина (myelin basic protein, MBP), специфическому белку аксонов NF-200, отражающие деструктивные и воспалительные процессы в тканях нервной системы[2].
Аналогичный анализ является актуальным в исследованиях природы шизоаффективного психоза. Кроме того, для понимания основ этиопатогенеза данных заболеваний необходимо установление причины выявленных аномалий. В связи с накопленными в настоящее время данными о значимости вирусов группы герпеса в патогенезе эндогенных психозов[3–6] целесообразно изучение их сопряженности с иммунометаболическими аномалиями, в частности при шизоаффективном психозе.
Цель исследования — мультипараметрическая оценка иммунохимических аномалий (отклонений содержания ауто-АТ), отражающих состояние микроструктур нервной системы, при шизоаффективном психозе и установление их возможной связи с герпетической инфекцией.
МАТЕРИАЛЫ И МЕТОДЫ
Были обследованы 56 больных (24 мужчины, 32 женщины) шизоаффективным психозом (F-25 по МКБ-10, шизоаффективная приступообразная шизофрения по отечественной классификации), проходивших стационарное лечение по поводу острых психотических состояний в клинике «Психическое здоровье» (руководитель — профессор В.Л. Минутко, г. Москва) в 2018–2019 гг. Ведущими синдромами были аффективно-параноидный (n = 42, 75%) и аффективно-бредовой (n = 14, 25%). Аффект у 37 (66,1%) пациентов был смешанным, у 15 (26,8%) — депрессивным и у 4 (7,1%) — маниакальным. Возраст больных варьировал от 17 до 50 лет (в среднем 29,4 ± 8,6 года). Средняя продолжительность болезни с момента манифестных проявлений составляла 5,1 ± 4,8 года.
В контрольную группу вошли 100 психически здоровых людей (43 мужчины и 57 женщин), проходивших профилактическое обследование в МИЦ «Иммункулус». Их средний возраст — 32,9 ± 9 лет (р > 0,05 при сравнении с основной группой).
Иммунохимическое обследование проводили при поступлении больных в стационар — до начала лечения. Профили иммунореактивности естественных регуляторных ауто-АТ, наиболее информативно отражающих количественные изменения (содержание) их отдельных вариантов[1], оценивали в сыворотке крови с помощью тест-наборов «ЭЛИ-Н-Комплекс-12» (МИЦ «Иммункулус», г. Москва) согласно инструкции производителя. При этом c помощью твердофазного ИФА определяли изменения содержания ауто-АТ класса G, взаимодействующих с антигенами микроструктур нервной ткани, а также отражающих общую реактивность иммунной системы (всего 12 ауто-АТ — см. таблицу).
Таблица
Частота выявления аномальных показателей сывороточных аутоантител (ауто-АТ) у обследованных больных шизоаффективным психозом и в контрольной группе здоровых лиц, n (%)
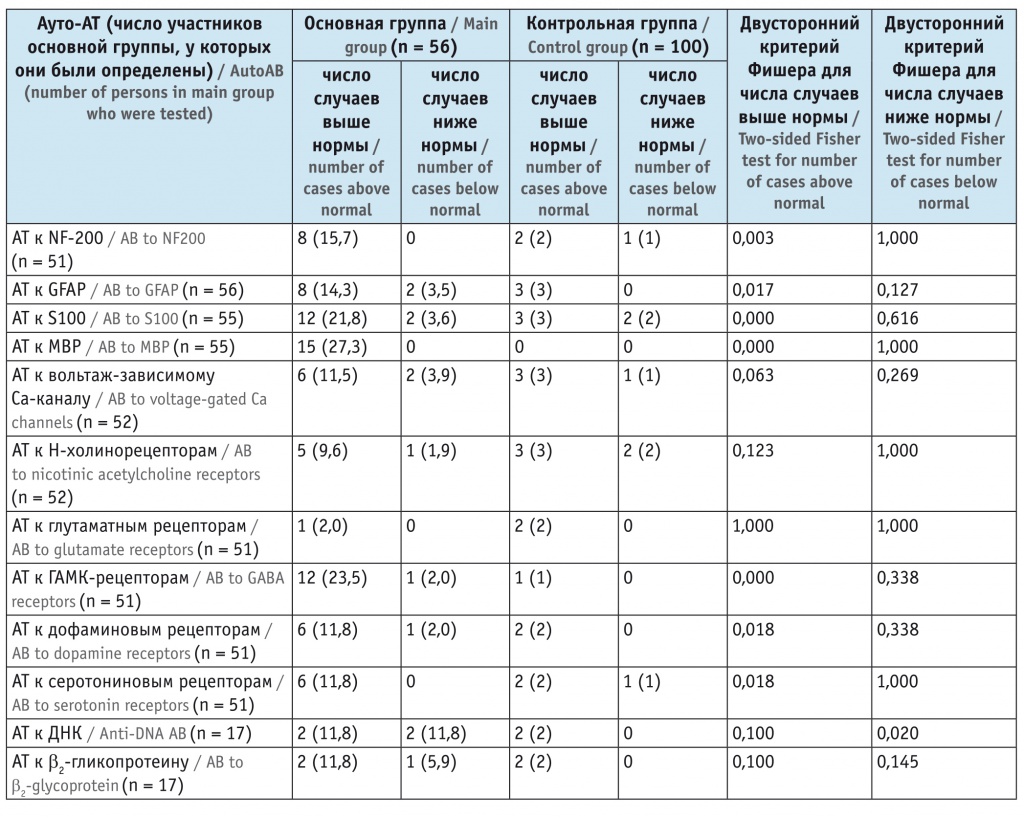
В зависимости от амплитуды пиков индивидуальных ауто-АТ разной антигенной специфичности их иммунореактивность оценивали как нормальную при амплитуде пика, не выходящей за физиологически допустимый разброс (у здоровых лиц уровни АТ колеблются от –20 до +10 относительных единиц, отн. ед.), сниженную (менее –20 отн. ед.) или повышенную (более +10 отн. ед.). Следует заметить, что с помощью технологии «ЭЛИ-Тест» не проводится оценка абсолютного содержания ауто-АТ в сыворотке крови обследуемого. Результаты «ЭЛИ-тестов» демонстрируют более информативные нарушения, такие как соотношение ауто-АТ, определяемое у пациента по отношению к нормальным показателям (относительное содержание ауто-АТ).
Уровни IgM и IgG к герпес-вирусам: вирусу простого герпеса 1-го типа (ВПГ-1), ВПГ-2, ВПГ-6, цитомегаловирусу (ЦМВ), вирусу Эпштейна — Барр (ЭБВ) — в сыворотке крови определяли методом твердофазного ИФА.
Статистическая обработка данных проводилась в программе Statistica 6.0 для Windows (StatSoft, США). Для статистической обработки использованы вычисления двустороннего (точного) критерия Фишера и коэффициента ранговой корреляции Спирмена при p < 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Аномалии профилей сывороточной иммунореактивности, обусловленные исследованными ауто-АТ, обнаружены у большинства пациентов основной группы (94,6%) и только у 3% обследованных контрольной группы. Превалирующим был рост амплитуды пиков (10,6% от общего количества показателей без учета пограничных значений), реже встречалось их аномальное снижение (1,5%), что существенно отличалось от соответствующих показателей контрольной группы (2,5% и 0,7% соответственно). В данном исследовании анализируется аномальное увеличение уровней ауто-АТ (см. таблицу). Повышенные значения отражают активные патологические процессы относительно небольшой давности, аномальное же снижение пиков иммунореактивности характерно для патологических процессов большей давности и тяжести.
Как видно из таблицы, рост амплитуды пиков ауто-АТ к MBP, являющемуся специфическим белком миелиновых оболочек аксонов, выявлялся наиболее часто и только в основной группе. Рост уровней АТ к MBP может указывать на демиелинизирующие процессы в нервных волокнах[1]. Эти данные подтверждаются и обнаруженным у 15,7% больных повышением уровней ауто-АТ к специфическому белку аксонов NF-200 (против 2% лиц контрольной группы, p = 0,003). Рост содержания ауто-АТ к MBP и NF-200 с высокой долей вероятности указывает на дегенеративные изменения в аксонах, включая их миелиновые оболочки (демиелинизацию)[1].
У 23,5% больных выявлялось повышение содержания ауто-АТ к ГАМК-рецепторам. Аналогичные аномалии обнаруживались только у 1% участников контрольной группы (p = 0,000). Они могут указывать на изменения в ГАМКергической системе нейронов.
У 21,8% пациентов основной группы и лишь у 3% в контрольной группе (р = 0,000) отмечалось повышение содержания ауто-АТ к белкам группы S100 — кальций-зависимым регуляторам целого ряда клеточных ролей, обеспечивающих функциональный гомеостаз клеток мозга путем сопряжения и интеграции разноплановых метаболических процессов[7]. Увеличение содержания ауто-АТ к такому представителю белков группы S100, как S-100В, по-видимому, отражает деструктивные изменения нервной ткани и ее вовлеченность в воспалительную реакцию, часто связанную с вирусной инфекцией (за счет сходства эпитопов белков S100 с эпитопами некоторых вирусов, например ВПЧ).
Кроме того, поскольку S100-белки во внеклеточном секторе проявляют свойства цитокинов и взаимодействуют с RAGE-рецепторами[8], которые экспрессируются в нервной системе не только нейронами, микроглией и астроцитами, но и клетками сосудистой стенки, можно предположить вовлеченность в воспалительную реакцию и сосудистой сети.
Рост уровней ауто-АТ к S-100В может свидетельствовать о патологических процессах в астроцитарной глие (их активации)[9]. Это положение подтверждается анализом уровней ауто-АТ к белку GFAP у изученных пациентов. В 14,3% случаев (против 3% в контрольной группе) отмечалось повышение уровня ауто-АТ к этому белку, что может указывать на пролиферативные процессы в астроцитарной глие (глиоз)[1], спектр проявлений которых варьирует при эндогенных психических расстройствах от обратимой активации до формирования глиального рубца[10].
Как известно, процессы активации астроцитарной глии запускаются в тканях мозга в ответ на повреждение нейронов различного, в том числе инфекционно-воспалительного, генеза. Можно также предположить, что длительное повышение содержания ауто-АТ к GFAP будет сопряжено с дистрофическими процессами в астроцитах. Увеличение концентрации ауто-АТ может свидетельствовать и о нарушении барьерной функции гематоэнцефалического барьера (ГЭБ)[11].
Остальные отклонения в уровнях ауто-АТ встречались реже. Так, рост содержания ауто-АТ к дофаминовым, серотониновым и Н-холинорецепторам наблюдался у 11,8%, 11,8% и 9,6% пациентов основной группы соответственно (в контрольной группе — у 2%, 2% и 3% участников соответственно). Отмеченные аномалии могут говорить об изменениях в соответствующих системах нейронов.
Повышение уровня ауто-АТ к вольтаж-зависимому кальциевому каналу (VGCC) (идентифицирован в мембране нейронов, эндокринных и мышечных клеток) установлено у 11,5% больных основной и у 3% лиц контрольной группы. Аномалии содержания ауто-АТ к антигенам VGCC могут указывать на широкий спектр расстройств с нарушениями водно-электролитного баланса и энергетического метаболизма нейронов, на изменение соотношений между возбуждающими и тормозными процессами в нервной системе, на нарушение функций межнейронных и нервно-мышечных контактов[12] и эндокринный дисбаланс[13], а также на вовлечение в патологические процессы спинного мозга и мозжечка[14].
Увеличение уровней ауто-АТ к двуспиральной ДНК и β2-гликопротеину в основной группе, возможно, говорит о взаимосвязи описанных изменений в нервной системе этих пациентов с неспецифической иммунной активацией (системным воспалением, включая воспаление в сосудистой сети). Чаще всего такие отклонения в содержании ауто-АТ бывают обусловлены активно реплицирующимися внутриклеточными инфектами (обычно вирусными)[1].
Рост уровней ауто-АТ к β2-гликопротеину может отражать интенсификацию их взаимодействия с белково-фосфолипидными комплексами клеточных мембран, а также процессы, связанные с возможным повреждением эндотелия сосудистых стенок (васкулопатия) и повышением свертываемости крови (антифосфолипидный синдром)[1]. Указанные процессы у пациентов с повышенным содержанием ауто-АТ к β2-гликопротеину, таким образом, могут иметь распространенный характер. Есть вероятность, что увеличение уровней ауто-АТ к β2-гликопротеину индуцировано инфекционным процессом[1].
Следует отметить, что, помимо пациентов с повышенным содержанием ауто-АТ к β2-гликопротеину, с той же частотой (11,8%) выявлялись больные с пограничными (между нормальным и повышенным) уровнями.
Показатели специфического (противогерпетического) иммунитета исследованы у 25 из 56 больных. Рост содержания тех или иных противогерпетических АТ отмечался во всех случаях. Наиболее часто встречалось повышение уровня IgG к ВПГ-1 (84% случаев), IgG к капсидному (86,7%) и ядерному (71,4%) антигенам ЭБВ, IgG к ЦМВ (54,2%). Повышение уровня IgG к тому или иному вирусу в настоящее время рассматривается как признак присутствия вируса в организме[15], в связи с чем полученные результаты говорят об инфицированности больных герпесом.
Как показали результаты корреляционного анализа, содержание ауто-АТ к MBP коррелирует с уровнем IgM к ЦМВ (r = 0,34) и IgG к капсидному антигену ЭБВ (r = 0,55), ауто-АТ к NF-200 — с содержанием IgM к ВПГ-1 (r = –0,33) и к ЭБВ (r = –0,68), ауто-АТ к GFAP — с содержанием IgM к ВПГ-2 (r = –0,31). Уровни ауто-АТ к дофаминовым рецепторам коррелировали с содержанием IgG к капсидному (r = –0,6) и к ядерному антигенам ЭБВ (r = –0,49), ауто-АТ к глутаматным рецепторам — с содержанием IgM к ЭБВ (r = –0,5) и IgG к ВПГ-6 (r = –0,51) (p < 0,05 для всех корреляций).
Таким образом, проведенное исследование выявило у обследованных больных шизоаффективным психозом аномалии профилей ауто-АТ (преимущественно повышение уровней), которые могут отражать деструктивные и воспалительные процессы в тканях центральной и периферической нервной системы (MBP, S-100, NF-200, GFAP), а также нарушение проницаемости ГЭБ.
Деструктивные процессы в нервной системе обнаруживались у больных эндогенными психическими заболеваниями (шизофренией) ранее и с помощью других методов исследования. В частности, некоторые катамнестические МРТ-исследования[16, 17] показали прогрессирующую редукцию структур мозга у таких пациентов.
Найденные иммунохимические признаки, предполагающие процессы демиелинизации у исследованных больных шизоаффективным психозом (повышение уровней ауто-АТ к МBP и NF-200), подтверждают данные посмертных патоморфологических исследований[18] о том, что поражение миелиновых оболочек нервов характерно для эндогенных психических заболеваний (шизофрении).
Полученные нами результаты становятся также важным подтверждением данных многочисленных исследований, в ходе которых при эндогенных психических заболеваниях найдены биохимические маркеры воспалительных реакций в периферической крови и спинномозговой жидкости[19–21], в мозговой ткани (посмертный материал)[22, 23]. В некоторых из них воспалительный процесс рассматривается в качестве основного патогенетического фактора[24] и ставятся вопросы о необходимости изучения его связи с микробиотой[25].
Обнаруженные патологические процессы, связанные с активацией астроцитарной глии (повышенные уровни ауто-АТ к белкам GFAP и S-100В), подтверждают соответствующие данные патоморфологов[10]. Следует отметить, что традиционно подчеркивалась ареактивность глии при эндогенных психических заболеваниях (шизофрении), и это в свое время явилось отправной точкой для квалификации структурных аномалий мозга при данном заболевании в качестве аномалий развития. Однако впоследствии были установлены изменения ультраструктуры астроцитов и экспрессии их маркеров, что свидетельствует об активном вовлечении этих клеток в патологический процесс[10].
Кроме того, патоморфологические данные говорят о том, что дисфункция астроцитов при шизофрении прогрессирует по мере увеличения длительности заболевания[26]. Высказано также предположение, что патологические процессы в астроцитах при этом заболевании связаны с иммунными изменениями, что подтверждается результатами настоящего исследования. Как известно и отмечено ранее, процессы активации астроцитарной глии запускаются в тканях мозга в ответ на повреждение нейронов различного, в том числе инфекционно-воспалительного, генеза.
Повышение уровней ауто-АТ к белку S-100 у обследованных больных, а в ряде случаев и к двуспиральной ДНК и β2-гликопротеину, может свидетельствовать о вовлечении в патологический процесс сосудистой сети, что подтверждают сведения, полученные с использованием МР-ангиографии, морфометрических исследований на посмертном материале и в ходе биохимических исследований. Они говорят о патологии в системе мозговых коллекторов, крупных сосудов и капиллярной сети (расширении периваскулярных пространств, периваскулярных кистах, очагах дистрофии в белом веществе мозга)[27], о повреждении эндотелия капилляров и неспецифических изменениях их ультраструктуры[23, 28] при эндогенных психозах (шизофрении).
Следует также отметить, что с учетом изменений в содержании ауто-АТ к MBP, NF-200, VGCC психиатрическая симптоматика (в частности, связанная с расстройствами мышечного тонуса) может иметь как центральный, так и периферический генез.
Как известно, аномально избыточная продукция ауто-АТ, будучи в большинстве случаев вторичным явлением, отражает первичные аномалии со стороны соответствующих антигенов (например, при развитии локальных воспалительных процессов, аномалиях экспрессии и секреции соответствующих продуктов). При этом повышенная продукция ауто-АТ направлена на активацию клиренса и утилизацию избытка таких продуктов и является саногенной.
Существенно реже наблюдается первичная аутоиммунная патология, для которой характерно не обусловленное нуждами организма патогенное повышение продукции определенных ауто-АТ, выступающих инструментами иммунометаболических нарушений разной степени выраженности, вплоть до аутодеструктивных реакций[1].
Таким образом, аномалии профилей сывороточной иммунореактивности, обусловленной теми или иными ауто-АТ, чаще всего отражают избыточное поступление соответствующих антигенов в межклеточные пространства, например при патологической активации их продукции и/или избыточной гибели клеток, их продуцирующих. Имеются данные о том, что повышенные уровни ауто-АТ к антигенам тех или иных органов и систем могут быть связаны с наличием вирусного (внутриклеточного) инфекционного процесса. Так, избыток ауто-АТ к двуспиральной ДНК чаще всего обусловлен активацией процессов апоптоза, вызванной активно реплицирующимися внутриклеточными инфектами (обычно вирусными)[1]. Патологическое увеличение продукции ауто-АТ к белкам S100 могут вызывать многие варианты вирусов папилломы (по механизмам молекулярной мимикрии).
По данным иммунологических исследований[1, 29], аутоиммунным процессам, сопровождающимся выраженной органной деструкцией, предшествуют десятилетиями протекающие инфекционно-воспалительные повреждения, часто вызываемые вирусами герпеса. Результаты проведенной работы, выявившие корреляции уровней изученных ауто-АТ с содержанием АТ к вирусам группы герпеса, могут рассматриваться как подтверждающие эти сведения.
В целом наши результаты поддерживают вирусную концепцию этиологии демиелинизирующих заболеваний, основанную на данных о наличии общих антигенных детерминант между энцефалитогенной областью MBP и некоторыми вирусами (ЭБВ, ЦМВ, ВПГ, корью, краснухой)[30].
Они также подтверждают наши прежние данные об этиопатогенетической роли герпетической инфекции при эндогенных психических заболеваниях (шизофрении, шизоаффективном психозе)[3–6, 27].
ЗАКЛЮЧЕНИЕ
Аномально избыточная продукция аутоантител (ауто-АТ), выявленная у большинства изученных пациентов, представляется вторичным явлением при развитии локальных, а у некоторых пациентов (случаи с повышением уровней ауто-АТ к двуспиральной ДНК и β2-гликопротеину) и распространенных инфекционно-воспалительных процессов, сопряженных с вирусами группы герпеса. В свою очередь, эти процессы выступают в качестве триггера стойких аутодеструктивных реакций в нервной ткани.
Вышесказанное диктует необходимость проведения тщательного соматического обследования пациентов с последующей санацией выявленных очагов инфекции и купированием воспалительных проявлений наряду с использованием комплексных подходов, направленных на коррекцию состояния сосудов, иммунных и метаболических нарушений.
Поступила: 14.10.2019
Принята к публикации: 30.11.2019








