Прогрессивное увеличение распространенности заболеваний шейки матки у женщин молодого фертильного возраста — одна из тревожных тенденций современности[3, 5]. В свете сегодняшних представлений важнейшим фактором канцерогенеза шейки матки является инфицирование ВПЧ: ВПЧ различных типов были найдены в 99,7% биоптатов, взятых у больных раком шейки матки по всему миру[2, 3, 5]. Наиболее часто встречаются ВПЧ 16, 18, 31, 33 и 45-го типов: они обнаружены у 80% пациенток с плоскоклеточным раком и у 94% с аденокарциномой шейки матки[5, 8, 9]. В цервикальном секрете найдены 35 типов ВПЧ, при этом в большинстве стран ВПЧ-16 был выявлен в 50–60% случаев рака шейки матки; ВПЧ-18 — в 10–20%, ВПЧ-45 — в 4–8% и ВПЧ-31 — в 1–5% случаев[6].
Известно, что микробиота влагалища оказывает существенное влияние на женское здоровье и может быть коморбидным фоном развития ряда заболеваний[12]. Бактериальный вагиноз — наиболее распространенный вариант нарушения биоценоза влагалища у женщин репродуктивного возраста[3, 14, 18]. Неблагоприятными последствиями бактериального вагиноза могут стать цервицит[3]Neisseria gonorrhoeae, Chlamydia trachomatis, Trichomonas vaginalis и ВПГ-2[4, 20].
С другой стороны, генитальные инфекции значительно повышают вероятность трансмиссии ВПЧ и способны привести к плоскоклеточным интраэпителиальным поражениям шейки матки (squamous intraepithelial lesion — SIL)[1–3, 10].
Хорошо известны эпидемиологические факторы, связанные с большей распространенностью ВПЧ-инфекции: молодой возраст женщин, раннее начало половой жизни, большое число половых партнеров, курение[5, 17]. Однако существует также мнение о взаимосвязи между контаминацией ВПЧ и другими генитальными микроорганизмами[15].
Цель исследования: оценить ассоциативную связь между генитальными инфекциями и диспластическими поражениями шейки матки у ВПЧ-позитивных и ВПЧ-негативных молодых женщин.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование было одобрено этическим комитетом Читинской государственной медицинской академии (протокол № 64 от 23 июня 2014 г.). В одномоментное исследование были включены две группы сексуально активных женщин в возрасте 18–35 лет: 141 пациентка с ВПЧ высокого риска (основная группа) и 145 ВПЧ-негативных женщин (группа сравнения). Средний возраст женщин обеих групп был сопоставим и составил в основной группе 30,0 ± 4,6 года, в группе сравнения — 31,1 ± 3,8 года (р > 0,05).
Для достижения цели исследования в вагинальных и цервикальных мазках, окрашенных по Граму, определяли наличие Gardnerella vaginalis, Candida albicans, Tr. vaginalis, N. gonorrhoeae. Для идентификации возбудителей ИППП в цервикальном секрете применяли метод ПЦР с детекцией продукта амплификации в режиме реального времени. Определяли пять типов ВПЧ высокоонкогенного риска (ВПЧ 16, 18, 31, 33, 45-го типов), Ureaplasma urealyticum, Ch. trachomatis, наличие цитомегаловирусной инфекции и ВПГ. Образцы, положительные на ВПГ, были представлены для повторной ПЦР в целях выявления ДНК ВПГ-2 (система «Фемофлор Скрин», Москва). Лабораторные исследования проводили в специализированных лабораториях Забайкальского краевого кожно-венерологического диспансера, Забайкальского краевого консультативно-диагностического центра, НИИ молекулярной генетики Читинской государственной медицинской академии. Каждый биологический образец был надлежащим образом маркирован и упакован. Риск перекрестного загрязнения во время транспортировки и хранения до обработки был расценен как низкий.
Образцы крови для исследования на ВИЧ и сифилис доставляли в иммунологическую лабораторию Забайкальского краевого центра профилактики ВИЧ и инфекционных заболеваний г. Читы. Для выявления сифилиса использовали серологический тест (диагностическая система IFA-fynb-LUES, Нижний Новгород); ВИЧ — ELISA-метод (DS-EIA-HIV-AGAB-SCREEN, Нижний Новгород).
Эксфолиативные цервикальные мазки готовили в соответствии с общепринятой методикой, высушивали на воздухе и окрашивали азур-эозином. Результаты цитологического исследования ранжировали по системе Bethesda 2001 (SIL: high-grade squamous intraepithelial lesion (HSIL) — плоскоклеточные интраэпителиальные поражения шейки матки высокой степени; low-grade squamous intraepithelial lesion (LSIL) — низкой степени)[3].
Статистический анализ данных был осуществлен с использованием пакета программ Statistica 6.1. Проводили проверку нормальности распределения показателей в группах по критерию Колмогорова — Смирнова. При анализе взаимосвязи качественных признаков использовали анализ таблиц сопряженности нескольких признаков с вычислением значения χ2, при малом числе наблюдений применяли точный критерий Фишера. Об ассоциативной связи ВПЧ с другими генитальными инфекциями и внутриэпителиальной неоплазией шейки матки судили по относительному риску (ОР) при 95%-м доверительном интервале. При p ≤ 0,05 результаты рассматривали как статистически значимые.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Сифилис и ВИЧ не были обнаружены ни у одной пациентки, включенной в исследование.
Исследуемые условно-патогенные микроорганизмы в диагностически значимом титре в целом выявляли в 4,6 раза чаще у ВПЧ-инфицированных женщин (41,1 против 9,0% в группе сравнения; р = 0,0002). Генитальный тракт ВПЧ-позитивных пациенток был чаще колонизирован C. albicans (23,4 против 2,1% в группе сравнения; p = 0,0000) и G. vaginalis (14,2 против 2,8% в группе сравнения; p = 0,0005). Среди женщин обеих групп, у которых в цервикальном секрете были выявлены Ur. urealyticum, в большинстве случаев уреаплазмы обнаружены в диагностически значимом титре (> 104). При этом частота встречаемости Ur. urealyticum (> 104) у ВПЧ-положительных пациенток была в 3,6 раза выше, чем у женщин без ВПЧ: 14,9 и 4,1% соответственно (p = 0,0019).
Общая частота выявления патогенных микроорганизмов была в 2,4 раза выше в группе носительниц ВПЧ, чем в группе сравнения: 14,9 и 6,2% соответственно (p = 0,0165). У носительниц ВПЧ в 3,1 раза чаще выявляли положительные результаты на Ch. trachomatis: 6,4 против 2,1% случаев в группе сравнения (p = 0,0689). Генитальная цитомегаловирусная инфекция была обнаружена у 4,3% ВПЧ-инфицированных и у 1,4% женщин в группе сравнения (p = 0,1403); ВПГ-2 — в 4,3 и 0,7% случаев соответственно (p = 0,0511). Tr. vaginalis присутствовала в вагинальных мазках только трех (2,1%) ВПЧ-негативных женщин. Ни в одном случае не зарегистрирована N. gonorrhoeae, что, возможно, обусловлено методикой, примененной в данном исследовании (табл.).
Таблица
Частота встречаемости условно-патогенных и патогенных микроорганизмов и относительный риск развития интраэпителиальных поражений шейки матки у обследованных пациенток
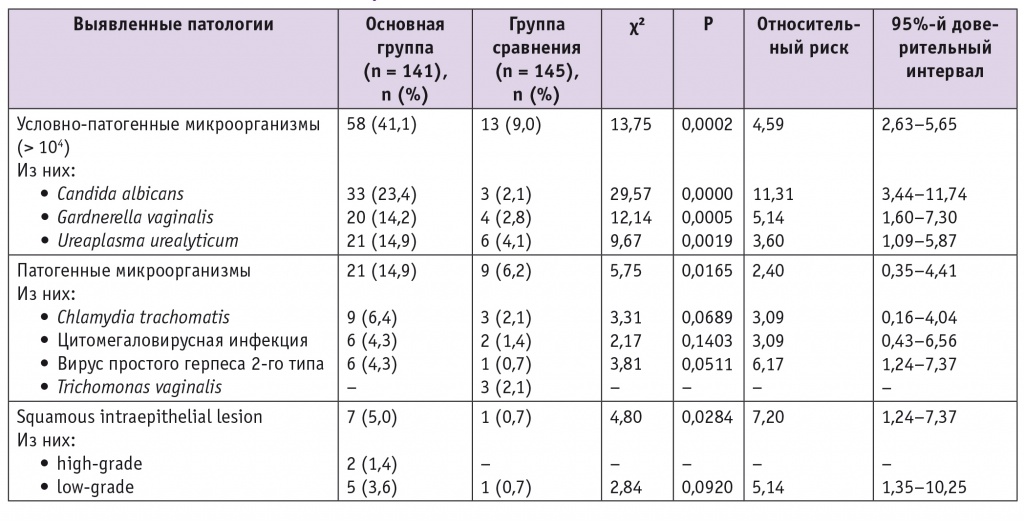
У пациенток, инфицированных ВПЧ высокоонкогенных типов, отмечена более высокая частота аномальных цервикальных мазков. У них в 7,1 раза чаще обнаруживали SIL (5,0 против 0,7% в группе сравнения; p = 0,0284). HSIL были выявлены только в группе ВПЧ-положительных женщин (n = 2; 1,4%). В обоих случаях HSIL ассоциировались с ВПЧ 16, 18, 33-го типов, цитомегаловирусом и Ch. trachomatis. LSIL были найдены у 5 (3,6%) ВПЧ-положительных пациенток и у одной (0,7%) женщины в группе сравнения (p = 0,0920).
E. F. Murta и соавт. (2000) обнаружили C. albicans у 23,9% и G. vaginalis у 17,4% здоровых женщин, в то время как в группе ВПЧ-инфицированных показатели составили 13,8 и 23,6% соответственно. Согласно этому исследованию, альтерация влагалищного эпителия G. vaginalis может предрасполагать к ВПЧ-инфицированию[15]. Другие источники свидетельствуют о том, что G. vaginalis повышает восприимчивость к различным патогенным микроорганизмам, таким как N. gonorrhoeae, Ch. trachomatis, Tr. vaginalis и ВПГ-2[4, 6, 20], которые значительно увеличивают риск передачи ВПЧ[1, 3, 7, 10].
Наши сведения о высокой колонизации C. albicans у ВПЧ-позитивных пациенток совпадают с результатами, полученными E. Voog и соавт. (1995), на основании которых авторы высказали предположение, что кандидозная коинфекция может активировать латентную ВПЧ-инфекцию[19].
L. Mendoza и соавт. (2013) не выявили статистически значимой связи между ВПЧ и Ur. urealyticum, Tr. vaginalis, G. vaginalis или кандидозной инфекцией[13]. Данные нашего исследования согласуются с результатами этих авторов только относительно патогенного микроорганизма Tr. vaginalis, который не был обнаружен у ВПЧ-положительных женщин. Что касается других инфекционных агентов, то мы, напротив, выявили ассоциативную связь между инфицированием высокоонкогенными типами ВПЧ и контаминацией Ur. urealyticum (титр > 104, ОР = 3,60), G. vaginalis (ОР = 5,14), C. albicans (ОР = 11,31).
Роль ВПЧ в этиологии цервикальной неоплазии несомненна, однако имеются сообщения об участии в канцерогенезе и других микробных агентов, например ВПГ и Ch. trachomatis[1, 10, 11, 16].
L. Mendoza и соавт. (2013) сделали вывод, что существует ассоциация между инфицированием Ch. trachomatis и ВПЧ, которую следует учитывать при диагностике и лечении цервикальной интраэпителиальной неоплазии[13]. Мы выявили высокий риск сочетания высокоонкогенных типов ВПЧ с хламидийной инфекцией (OР = 3,09) и ВПГ-2 (OР = 6,17).
Следует отметить, что среди обследованных нами женщин ни в одном случае не был идентифицирован патогенный микроорганизм N. gonorrhoeae. L. Mendoza и соавт. (2013) также не обнаружили его ни у ВПЧ-положительных, ни у ВПЧ-отрицательных пациенток[13]. Такие результаты, возможно, обусловлены методикой бактериоскопии, примененной в обоих исследованиях, и позволяют сделать вывод о необходимости совершенствования методов тестирования и диагностики N. gonorrhoeae в целях повышения качества ее выявления, особенно в популяциях с высокой частотой встречаемости других ИППП.
Мы не обнаружили у обследованных женщин сифилис и ВИЧ-инфекцию. В то же время многие исследователи отмечают более высокую частоту их встречаемости у ВПЧ-инфицированных пациенток и делают заключение о необходимости периодического скрининга на эти инфекции, поскольку они являются факторами риска патологической трансформации цервикального эпителия [3, 5].
Роль Ch. trachomatis и ВПЧ-коинфекции как факторов риска развития цервикального интраэпителиального поражения широко обсуждается в литературе[10, 11]. Мы обнаружили, что все случаи HSIL у носительниц высокоонкогенных типов ВПЧ ассоциировались с Ch. trachomatis и генитальной цитомегаловирусной инфекцией. Коинфекция Ch. trachomatis и ВПЧ является значимым фактором риска развития цервикальных интраэпителиальных неоплазий за счет развития хронического воспаления и влияния на иммунитет хозяина[1, 16].
Нами выявлена статистически значимая ассоциативная связь между ВПЧ высокого онкогенного риска и частотой SIL (ОР = 7,2). ОР развития LSIL у ВПЧ-положительных женщин составил 5,14, а HSIL зарегистрированы только в группе носительниц ВПЧ высокоонкогенных типов.
ЗАКЛЮЧЕНИЕ
Частота колонизации генитального тракта условно-патогенными и патогенными микроорганизмами значительно выше у носительниц высокоонкогенных типов ВПЧ по сравнению с неинфицированными ВПЧ женщинами. Коинфекция ВПЧ 16, 18, 33-го типов, цитомегаловирусом и хламидиями является конфаундинг-фактором развития плоскоклеточных интраэпителиальных поражений шейки матки высокой степени. В целом, основываясь на результатах нашего исследования и современных научных данных, можно заключить, что ассоциация ВПЧ с другими генитальными инфекциями существенно увеличивает риск развития цервикальных плоскоклеточных интраэпителиальных поражений.








