ВВЕДЕНИЕ
Системная красная волчанка (СКВ) — хроническое мультисистемное аутоиммунное заболевание неизвестной этиологии с широким спектром клинических проявлений и непредсказуемым течением[1]. Поражение сердца встречается более чем у 50% пациентов с СКВ, оно является одной из основных причин летальности. При СКВ могут вовлекаться все анатомические структуры: перикард, эндокард, сосуды сердца, миокард с развитием сердечной недостаточности (СН) как финала сердечно-сосудистого континуума[2].
Считается, что в основе патогенеза поражения сердца при СКВ лежит совместное или независимое влияние аутоиммунного хронического воспаления, ускоренного развития атеросклероза и применения некоторых противоревматических препаратов[2]. По данным эпидемиологического исследования (США, 1999–2016 гг., n = 45 млн чел), у пациентов с СКВ (n = 95 тыс., 0,21%) поражение сердца регистрировалось гораздо чаще, чем в контрольной группе[2]: нарушения ритма и проводимости — у 22% и 6%, ИБС — у 13% и 4%, значимое поражение клапанов — у 11% и 2%, инфаркт миокарда (ИМ) — у 6% и 2%, легочная гипертензия — у 2,2% и 0,2%, СН — у 1,0% и 0,2% больных соответственно.
Цель данного исследования — определение структуры и частоты поражения сердца у пациентов с СКВ, оценка связи с активностью, длительностью заболевания и противоревматической терапией.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование включены 87 пациентов (79 (90,8%) женщин и 8 (9,2%) мужчин), медиана возраста составила 32 [28; 41] года. Все больные соответствовали классификационным критериям СКВ Американской коллегии ревматологов (American College of Rheumatology, ACR) 1997 г.[3, 4] и критериям Systemic Lupus International Collaborating Clinics (SLICC)/ACR 2012 г.[5], наблюдались в клинике ФГБНУ НИИР им. В.А. Насоновой с января 2019 года по декабрь 2020 года и подписали информированное согласие на участие в исследовании в рамках поисковой темы «Разработка персонализированного подхода к диагностике и профилактике нарушений углеводного обмена и сердечно-сосудистых осложнений при ревматоидном артрите и системной красной волчанке» АААА-А20-120051490038-7. Проведение исследования одобрено локальным этическим комитетом.
Критерии исключения: возраст моложе 18 лет или старше 65 лет, наличие тяжелой сопутствующей патологии (инфекции, злокачественных новообразований) или беременности, участие в клинических испытаниях. Проводилось общепринятое клиническое, лабораторное и инструментальное обследование с использованием стандартных методов. Активность СКВ определяли с помощью индекса Systemic Lupus Erythematosus Disease Activity Index в модификации 2К (SLEDAI-2K)[6]. Для оценки необратимых изменений применяли индекс Systemic Lupus International Collaborating Clinics Damage Index (SLICC/DI)[7].
Все пациенты осмотрены кардиологом, у них определялись традиционные факторы риска (ТФР) сердечно-сосудистых заболеваний (ССЗ) (АГ, дислипидемия, курение, избыточная масса тела, СД, отягощенная наследственность по ССЗ, менопауза, гиподинамия), выполнена трансторакальная ЭхоКГ, по показаниям — суточное мониторирование ЭКГ и АД. Оценивались следующие параметры ЭхоКГ: диастолическая и систолическая функции ЛЖ, фракция выброса (ФВ), толщина миокарда ЛЖ, размеры камер сердца, систолическое давление в легочной артерии (СДЛА), состояние перикарда, сердечных клапанов.
Концентрацию N-концевого фрагмента предшественника мозгового натрийуретического пептида (NT-proBNP) определяли в сыворотке крови методом электрохемилюминесценции на анализаторе Cobas e 411 с использованием тест-системы Elecsys proBNP II (Roche Diagnostics, Швейцария). В норме уровень NT-proBNP составляет ≤ 125,0 пг/мл, согласно инструкции фирмы-изготовителя и рекомендациям Европейского общества кардиологов по диагностике и лечению острой и хронической СН[8].
Статистическая обработка проведена с использованием методов параметрической и непараметрической статистики прикладных программ Statistica 8.0 (StatSoft. Inc., США). Переменные представлены в виде медианы (Ме) с указанием в скобках верхнего и нижнего квартилей [25-й; 75-й перцентили]. Достоверность различий между двумя несвязанными группами оценивали с помощью критерия Манна — Уитни, между тремя — Краскела — Уоллеса. Качественные показатели в двух несвязанных группах сравнивались в таблице сопряженности 2 × 2 при помощи теста χ2, при количестве наблюдений менее 5 применялся точный критерий Фишера. Уровень статистической значимости принимался p < 0,05[9].
РЕЗУЛЬТАТЫ
Медиана длительности СКВ составила 6 [1; 10] лет, активность заболевания соответствовала умеренной (SLEDAI-2K — 9 [4; 16] баллов), индекс повреждения SLICC/DI — 0 [0; 1] баллов. Основные клинические проявления болезни: гематологические нарушения (48,2%), нефрит (44,8%), артрит (36,8%), поражение кожи (33,3%) и серозит (32,2%). Восемьдесят пять (97,7%) пациентов имели иммунологические нарушения: повышенный уровень антинуклеарного фактора (АНФ) выявлен у 94,3%, антител к двуспиральной ДНК (анти-дс-ДНК) — у 77% больных СКВ. Сопутствующие антифосфолипидный синдром (АФС)[10] и синдром Шёгрена[11] обнаружены у 8 (9,2%) и 9 (10,3%) пациентов соответственно.
Самым частым поражением сердца при СКВ оказалась недостаточность клапанов с разной степенью регургитации (от незначительной до умеренной, не требующей хирургического лечения), выявленная у 80 (92%) пациентов: у 77 (88,5%) — недостаточность трикуспидального, у 71 (81,6%) — митрального, у 55 (6,23%) — клапана легочной артерии и у 12 (13,8%) — аортального клапана. При этом эндокардит (утолщение створок, вегетации) обнаружен у 26 (30%), пролапс створок митрального или трикуспидального клапанов — у 29 (33,3%) пациентов. Самым редким вариантом был стеноз митрального, трикуспидального и аортального клапанов — по 1 (1,2%) человеку.
Патология перикарда найдена у 39 (44,8%) пациентов: у 24 (61,5%) из них отмечался адгезивный (утолщение, уплотнение, сепарация листков) перикардит, у 15 (38,5%) — экссудативный.
Диагноз миокардита установлен у 4 (4,6%) больных СКВ на основании клинических диагностических критериев острого миокардита (New York Heart Association, 1998).
ИБС верифицирована у 5 (5,7%), СН — у 10 (11,5%), инфаркт миокарда (ИМ) — у 2 (2,3%), нарушения ритма и проводимости сердца — у 16 (18,4%) и 2 (2,3%) пациентов с СКВ соответственно.
Дислипидемия и АГ выявлены у 44 (50,6%) и 40 (46%) участников исследования.
Медиана ФВ ЛЖ составила 64 [60; 68]%, конечного систолического размера ЛЖ — 30 [26; 32] мм, конечного диастолического размера ЛЖ — 48 [44; 50] мм, толщины межжелудочковой перегородки — 9 [8; 9] мм, задней стенки миокарда ЛЖ — 8,5 [8,0; 9,5] мм, передне-заднего размера левого предсердия (ЛП) — 34 [31; 37] мм, СДЛА — 26 [22; 31] мм рт. ст. Диастолическая дисфункция миокарда ЛЖ (ДДЛЖ) выявлена у 21 (24,1%), систолическая дисфункция — у 7 (8%), гипертрофия миокарда ЛЖ — у 13 (14,9%), дилатация ЛП — у 14 (16%), увеличение размеров правого предсердия — у 9 (10,3%), повышение СДЛА ≥ 35 мм рт. ст. — у 8 (9,2%) больных.
Медиана концентрации NT-proBNP составила 91,8 [27,1–331,2] пг/мл, повышенный уровень NT-proBNP (> 125,0 пг/мл) обнаружен у 27 (31%) человек.
Для оценки возможной связи патологии сердца с терапией, применяемой при СКВ, пациенты были разделены на две группы. В 1-ю группу включены больные, которые на момент обследования не получали глюкокортикоиды (ГК), иммуносупрессанты и генно-инженерные биологические препараты (ГИБП). Пациенты 2-й группы принимали разнообразные комбинации этих препаратов. В 1-ю группу вошли 42 пациента (39 женщин и 3 мужчины) с медианой возраста 31 [27; 40] год, 4 (9,5%) из них принимали только гидроксихлорохин в дозе 200 мг/сут. Среди них были как впервые заболевшие, так и длительно болеющие СКВ, но отменившие назначенную ранее терапию.
Во 2-ю группу включили 45 больных (40 женщин и 5 мужчин), медиана возраста — 34 [28; 45] года. ГК получали 44 (97,8%) из них, медиана дозы — 10 [8; 15] мг/сут при расчете на преднизолон. За весь период болезни у 22 (48,9%) больных применялся циклофосфамид, у 17 (37,8%) — азатиоприн, у 16 (35,5%) — микофенолата мофетил, у 9 (20%) — метотрексат, у 43 (95,5%) — гидроксихлорохин и у 9 (20%) — ГИБП (ритуксимаб, белимумаб).
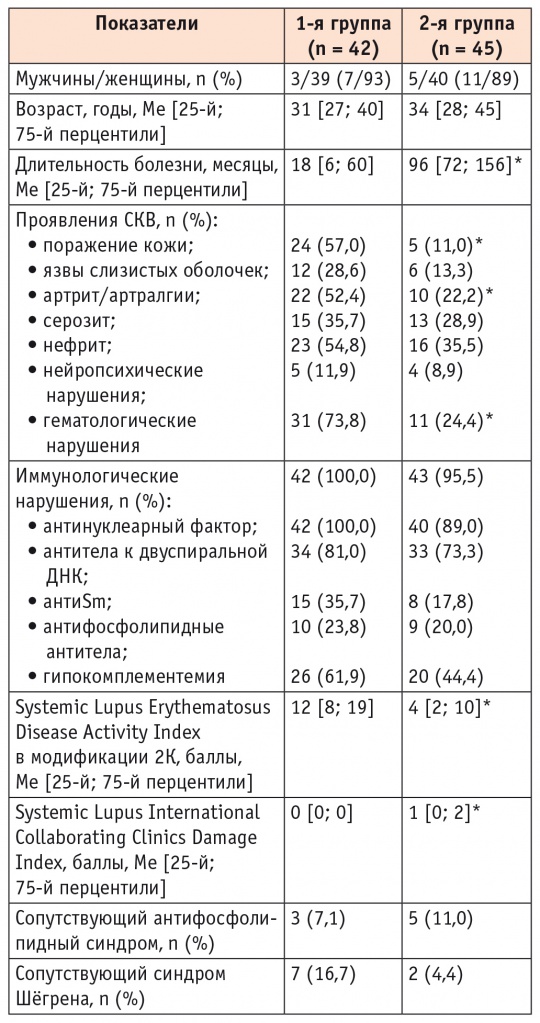
Сравнительная клинико-лабораторная характеристика пациентов обеих групп представлена в таблице 1. Группы были сопоставимы по возрасту и полу, преобладали женщины (93% и 89%). Пациенты 2-й группы имели бо́льшую длительность болезни, чем участники 1-й группы (96 и 18 мес, р < 0,00001), меньшую активность (SLEDAI-2K — 4 и 12 баллов, р < 0,001), более высокий индекс повреждения (SLICC/DI — 1 и 0 баллов, p < 0,001), у них реже встречались на момент исследования поражения кожи (11% и 57%, p < 0,0001), суставов (22,2% и 52,4%, p < 0,05) и гематологические нарушения (24,4% и 73,8%, p < 0,0001).
Таблица 1
Сравнительная характеристика больных системной красной волчанкой (СКВ)
* Здесь и в таблице 2: отличия от 1-й группы статистически значимы (p < 0,05).
Основными клиническими проявлениями СКВ у пациентов 1-й группы были гематологические нарушения (73,8%), поражения кожи (57%), почек (54,8%) и суставов (52,4%), у всех выявлены также иммунологические нарушения: повышение уровня АНФ — у 100%, анти-дс-ДНК — у 81% больных.
Во 2-й группе преобладали нефрит (35,5%), серозит (28,9%), гематологические нарушения (24,4%) и артрит (22,2%), у 95,5% пациентов найдены иммунологические нарушения. По частоте сопутствующего АФС и синдрома Шёгрена различия отсутствовали.
Таким образом, наше разделение больных СКВ на группы по факту приема антиревматической терапии (ГК, иммуносупрессантов, ГИБП) позволило оценить ее связь с активностью и длительностью СКВ, поскольку группы по этим показателям значимо различались.
Нелеченые пациенты с СКВ с высокой активностью и больные, получавшие антиревматическую терапию, но с низкой активностью и большей длительностью СКВ не различались по частоте недостаточности клапанов (86,7% и 97,6%), эндокардита (26,2% и 33,3%), перикардита (42,9% и 46,7%) (как экссудативного, так и адгезивного), нарушений ритма (19% и 17,8%) и проводимости сердца (2,4% и 2,2%), ИБС (2,4% и 8,9%), СН (7% и 15,5%); p > 0,05 во всех случаях (табл. 2). ИМ и миокардит диагностированы только у пациентов 1-й группы (4,4% и 9,5% соответственно), но эти различия между группами не были статистически значимыми (p = 0,05).
Таблица 2
Частота поражения сердца и традиционные факторы риска (ТФР) у больных системной красной волчанкой
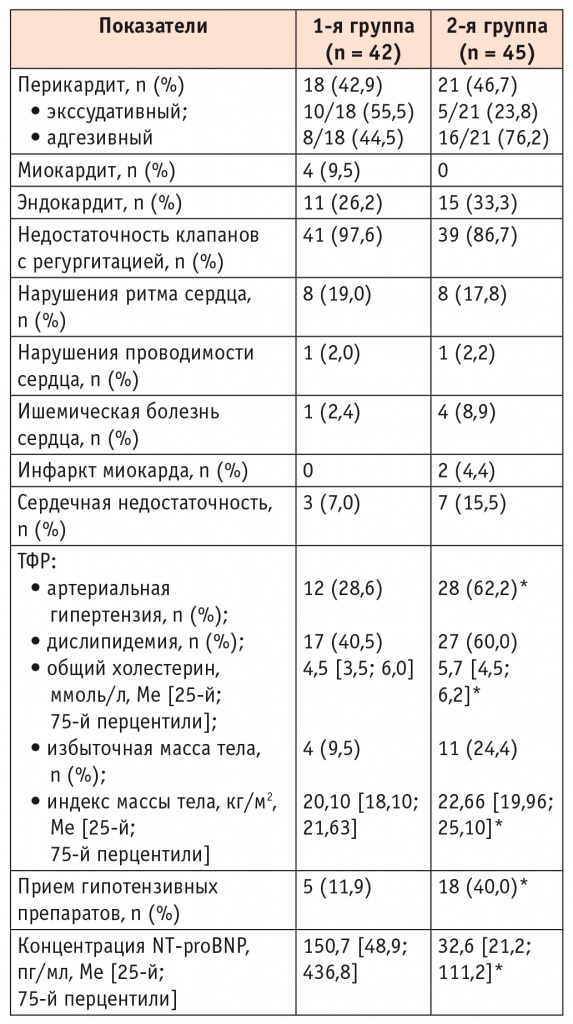
У участников 2-й группы чаще, чем в 1-й группе, встречалась АГ (62,2% и 28,6% соответственно, р < 0,01), по частоте других ТФР различия не обнаружены, но концентрация общего холестерина и значение ИМТ во 2-й группе были выше, чем у пациентов 1-й: 5,7 и 4,5 ммоль/л (р < 0,05); 22,66 и 22,10 кг/м2 (р < 0,01) (см. табл. 2).
Концентрация NT-proBNP у нелеченых больных оказалась больше, чем во 2-й группе (150,7 и 32,6 пг/мл соответственно, р < 0,01), превышая при этом нормальные значения (см. табл. 2).
ОБСУЖДЕНИЕ
По данным метанализа 20 исследований по применению ЭхоКГ у пациентов с СКВ, не имеющих диагностированного поражения сердца на момент включения (всего 1117 пациентов и 901 здоровый участник контрольной группы), самыми частыми проявлениями были изменения клапанов (регургитация, утолщение створок, реже — вегетации и стеноз) и перикардит: 34,4% и 25,4% соответственно[12]. Аналогичные результаты получены и в нашей работе.
Несмотря на то что характерным классическим поражением клапанов при СКВ является небактериальный тромботический эндокардит Либмана — Сакса[13], большинство исследователей сходятся во мнении, что самое частое изменение сердечных клапанов — это недостаточность с разной степенью регургитации[14]. Некоторые указывают на бо́льшую частоту недостаточности аортального клапана[14], другие — митрального[15].
В нашем исследовании чаще встречалась недостаточность трикуспидального и митрального клапанов, реже — аортального; изменения не были клинически значимыми и не требовали хирургической коррекции.
В качестве возможных причин данных изменений обсуждаются влияние аутоиммунного воспаления в эндокарде, клапанах, расслоение аорты, АГ[16] и терапия ГК[17]. Применение ГК может приводить к быстрому «заживлению» вальвулита/эндокардита с последующим рубцеванием и укорочением клапанных створок и хорд, которые нарушают состоятельность клапана.
По результатам аутопсии, эндокардит Либмана — Сакса встречается у 13–74% пациентов с СКВ, при применении ГК его частота снизилась до 35%[14]. Вегетации могут быть на любом клапане (или нескольких), чаще — митральном и трикуспидальном. Хорды, папиллярные мышцы, эндокард предсердий и желудочков поражаются редко. Вегетации состоят из мононуклеаров, отложений иммунных комплексов, фибрина, тромботических масс; их наличие, по некоторым данным, ассоциировано с позитивностью по антифосфолипидным антителам и сопутствующим АФС[18–21].
В большинстве своем изменения на клапанах у пациентов с СКВ бессимптомны, в редких случаях определяются шумы при аускультации, по результатам некоторых исследований, они ассоциируются с большей длительностью болезни, но не с ее активностью[22–25].
По нашим данным, структурные (утолщение створок, вегетации) и функциональные (недостаточность с регургитацией) нарушения сердечных клапанов с одинаковой частотой встречались как у нелеченых больных с высокой активностью заболевания, так и у длительно болеющих пациентов, получающих терапию, с низкой активностью СКВ, что позволяет сделать вывод об отсутствии влияния данных параметров на частоту и вид поражения клапанов.
Частота перикардита при СКВ варьирует от 12% (по данным клинического исследования и ЭхоКГ) до 62% (по результатам аутопсии). В среднем он встречается у каждого четвертого пациента[14]. В 76% случаев перикардит ассоциирован с плевритом и крайне редко (1%) является первым признаком СКВ[14, 26]. Перикардиальная жидкость по составу —преимущественно экссудат (повышенное содержание белка с нормальным или низким уровнем глюкозы), количество лейкоцитов и полиморфноядерных клеток увеличено, в ткани перикарда могут определяться депозиты иммуноглобулина и С3 компонента комплемента как следствие иммунокомплексного воспаления. Такие осложнения, как констриктивный перикардит или тампонада сердца, встречаются крайне редко (< 1%), тампонада — в основном у пациентов с лекарственно-индуцированной волчанкой[14].
По нашим данным, перикардит выявлен у 44,8% больных СКВ, среди нелеченых пациентов преобладал экссудативный, среди леченых — адгезивный, но различия не были статически значимыми (p = 0,05).
Миокардит может протекать бессимптомно (в большинстве случаев) или с разнообразными неспецифическими клиническими проявлениями (лихорадкой, одышкой, болью в грудной клетке, сердцебиением, аритмией, отеками). Клинически проявляющийся миокардит, ассоциированный с дисфункцией (систолической и/или диастолической) миокарда ЛЖ, носит название воспалительной кардиомиопатии[27]. Воспалительная кардиомиопатия, ассоциированная с СКВ, может быть обнаружена у 10% пациентов. При аутопсии частота его выявления возрастает до 40–57%[28].
Повышение уровня натрийуретического пептида (BNP или NT-proBNP) не специфично для миокардита, но позволяет оценить выраженность изменений внутрисердечной гемодинамики, степень изменения давления в ЛЖ. Нарастание концентрации свидетельствует о дебюте СН и дает возможность определить ее выраженность и прогрессирование у больного миокардитом. По динамике уровня NT-proBNP проводится оценка эффективности лечения и делается прогноз. При сохранении его высокой концентрации можно предположить наличие активного воспаления, его хронизации. Поэтому, согласно рекомендациям кардиологов, следует всем пациентам с клиническим подозрением на миокардит проводить исследование исходного уровня NT-proBNP и его динамики[27].
Среди инструментальных методов диагностики миокардита применяют ЭКГ (чувствительность — всего 47%), ЭхоКГ (позволяет исключить другие причины воспалительной кардиомиопатии — пороки сердца, рестриктивную и гипертрофическую кардиомиопатию, оценить систолическую и диастолическую функции желудочков, величину ФВ, размеры камер сердца, толщину их стенок, давление заполнения ЛЖ и давление в легочной артерии, влияющие на прогноз и эффективность терапии), МРТ с парамагнитным контрастным усилением, биопсию миокарда («золотой стандарт» диагностики)[27].
МРТ с парамагнитным контрастным усилением — на сегодняшний день самый информативный метод визуализации очагов воспаления в миокарде, повреждения и некроза миоцитов, оптимизирующий диагностику острого миокардита. Здоровый миокард, не аккумулирующий контраст-парамагнетик, визуализируется низкоинтенсивным сигналом, высокоинтенсивные области аккумуляции контраста отражают фиброз и некроз в миокарде, при этом отсроченное МРТ-сканирование спустя 12–25 мин после введения контраста позволяет визуализировать уже необратимые повреждения миокарда[29].
Данный метод рекомендован и для определения участков миокарда, из которых целесообразно осуществить забор биоптата. Исходная мозаичность поражения миокарда снижает чувствительность и ценность эндомиокардиальной биопсии, которая зависит от количества биоптатов и их размеров: при получении и последующем анализе 4–5 образцов чувствительность метода составляет 50%, а при анализе 17 биоптатов — 79%[30], поэтому формулировать диагностическое заключение следует при наличии не менее 3 образцов размером 1–2 мм[31], обязательно с использованием иммунногистохимического метода и ПЦР в образцах ткани миокарда и периферической крови для исключения инфекционной причины.
Согласно рекомендациям, для первичного выявления воспаления миокарда радионуклидные методы визуализации, в том числе и позитронно-эмиссионная томография с применением фтордезоксиглюкозы 18, не применяются, так как обладают низкой специфичностью[32, 33].
В нашем исследовании миокардит (преимущественно воспалительная кардиомиопатия) был выявлен только у нелеченых больных с высокой степенью активности СКВ.
Нарушения ритма и проводимости у больных СКВ встречаются довольно редко: их частота варьирует от 10%[34] до 22%[2]. Они не имеют каких-либо особенных черт, ассоциации со специфическими для СКВ аутоантителами и терапией также не обнаружены. В настоящем исследовании нарушения ритма выявлены у 18,4% больных СКВ, проводимости сердца — у 2,3%, различий между группами не было.
Частой причиной поражения коронарных артерий при СКВ является ускоренное развитие атеросклероза, реже — тромбоз, эмболизм, вазоспазм, коронариит. У больных СКВ вдвое больше атеросклеротических бляшек в коронарных и бедренных артериях, чем у людей, страдающих ревматоидным артритом и СД — заболеваниями с высоким кардиоваскулярным риском[35]. По сравнению с общей популяцией относительный риск развития ИМ и инсульта при СКВ повышен в 3 раза, СН и сердечной смерти — в 4 раза[36]. Пик распространения ССЗ, связанных с атеросклерозом, у пациентов с СКВ приходится на возраст 40–50 лет, в то время как в общей популяции — на 65–74 года[37].
Прогрессирование атеросклероза при СКВ обусловлено не только повышенной частотой всех ТФР, но и влиянием специфических факторов, связанных с самой болезнью: высокой активностью, наличием необратимых изменений, нефрита, нейропсихических нарушений, позитивностью по антифосфолипидным антителам, большой кумулятивной дозой ГК[38, 39]. В разные периоды болезни наибольшее влияние на развитие ССЗ, обусловленных атеросклерозом, оказывают разные факторы риска. Так, в проспективном наблюдении (2000–2007) за женщинами с СКВ и здоровыми участницами группы контроля (n = 250 в каждой группе, средний возраст — 44 года) с исходно низким кардиоваскулярным риском, рассчитанным по Фрамингемской шкале, главными предикторами ССЗ являлись собственно СКВ, увеличение возраста, концентрация триглицеридов > 2,8 ммоль/л[39]. Продолжение наблюдения (2008–2015 гг., средний возраст — 51 год) выявило, помимо увеличения возраста, больший вклад ТФР (АГ, СД, дислипидемии, высоких значений ИМТ), наличия необратимых органных повреждений (по индексу SLICC/DI) и высокой кумулятивной дозы ГК.
Авторы предполагают, что в первой декаде заболевания ведущую роль в развитии ССЗ играют факторы, связанные с СКВ, в последующие годы — ТФР, возможно, усиленные длительным приемом ГК[39].
В нашем исследовании различия по частоте ИБС, ИМ, СН у пациентов, получавших и не получавших ГК, иммуносупрессанты и ГИБП, отсутствовали. Вероятно, это обусловлено молодым возрастом — 31 и 34 года соответственно. Но на фоне указанной терапии (в 97,8% случаев использовались ГК) чаще наблюдались АГ, увеличение уровня общего холестерина и значения ИМТ, что подтверждает мнение о влиянии ГК на частоту ТФР.
Согласно данным M. Petri и соавт.[40], повышение дозы преднизолона на каждые 10 мг ассоциировано с увеличением массы на 2,5 кг, концентрации общего холестерина на 0,19 моль/л и АД на 1,1 мм рт. ст.
В настоящее время определение концентрации NT-proBNP используют для скрининга СН, оценки ее тяжести и прогноза, а также мониторинга эффективности проводимой терапии. Кроме того, высокий уровень NT-proBNP является независимым фактором риска не только СН, но и фибрилляции предсердий, инсульта/транзиторной ишемической атаки, смерти в общей популяции даже при введении поправки на ТФР развития ССЗ[41–43].
Существуют единичные работы, посвященные изучению концентрации BNP/NT-proBNP при аутоиммунных воспалительных заболеваниях. При СКВ уровень данного биомаркера определялся только у больных, получающих патогенетическую терапию[44–46]. Концентрация BNP/NT-proBNP у больных СКВ была выше, чем в контрольной группе, это повышение ассоциировалось прежде всего с миокардиальной дисфункцией, но не было связано с поражением сосудов, в том числе и атеросклеротическим, с маркерами воспаления, активностью СКВ.
Ранее мы впервые определили уровень NT-proBNP у пациентов с СКВ, не получающих специфическую антиревматическую терапию[47], и обнаружили корреляцию концентрации биомаркера с иммунологическими показателями активности СКВ (повышением уровней антител IgG к кардиолипину, анти-дc-ДНК, антинуклеарных антител, гипокомплементемией по С4 компоненту) и показателями, отражающими нарушение функции почек (увеличением содержания креатинина, мочевой кислоты, снижением скорости клубочковой фильтрации).
В настоящем исследовании наблюдалась аналогичная картина — повышение концентрации NT-proBNP у пациентов без лечения и с высокой активностью заболевания по сравнению с таковой у леченых больных СКВ с низкой активностью. Вероятно, при СКВ в отсутствие терапии имеет место аутоиммунное поражение собственно кардиомиоцитов и/или опосредованное снижение функции миокарда, обусловленное поражением почек.
В целом иммуносупрессивная терапия при СКВ, подавляя активность болезни, потенциально должна снижать кардиоваскулярный риск. Гидроксихлорохин эффективен в профилактике обострений СКВ и повышении выживаемости пациентов, при этом он уменьшает риск атеросклероза[48], тромбозов[49] и ГК-индуцированной гиперхолестеринемии[50, 51], снижая в итоге кардиоваскулярный риск у больных СКВ, несмотря на единичные сообщения о его кардиотоксичности[52].
ГК оказывают двойственный эффект: с одной стороны, снижают активность СКВ, с другой — приводят к повышенной частоте АГ, гиперхолестеринемии, ожирению[53], но все негативное воздействие связано с большой длительностью приема и высокой кумулятивной дозой[54–56]. Терапия азатиоприном ассоциирована с сосудистыми событиями[57, 58], влияние метотрексата, циклофосфамида и микофенолата мофетила на кардиоваскулярный риск у пациентов с СКВ до конца не ясно[59, 60].
ЗАКЛЮЧЕНИЕ
По результатам нашего исследования, самым частым вариантом поражения сердца у пациентов с системной красной волчанкой (СКВ) являются функциональные нарушения клапанов (недостаточность с разной степенью регургитации), преимущественно трикуспидального и митрального, перикардит, эндокардит (утолщение створок клапанов и вегетации), нарушения ритма и сердечная недостаточность (СН). Кроме того, по данным ЭхоКГ, нередко определялись субклинические предикторы СН: диастолическая дисфункция миокарда ЛЖ (24,1%), дилатация левого предсердия (16%), гипертрофия миокарда ЛЖ (14,9%).
Несмотря на молодой возраст пациентов, терапия (в первую очередь глюкокортикоидами, ГК) и большая длительность СКВ ассоциированы с нарастанием частоты традиционных факторов риска (ТФР) (АГ, гиперхолестеринемии, избыточной массы тела), а миокардит и превышение нормального значения концентрации N-концевого фрагмента предшественника мозгового натрийуретического пептида, напротив, характерны для нелеченых больных с высокой активностью СКВ. Практикующему ревматологу следует обратить внимание на необходимость совместного с кардиологом ведения больных СКВ, оценки доклинических маркеров СН как потенциально смертельного осложнения, особенно у пациентов с высокой активностью болезни, и контроля ТФР с использованием минимальной дозы ГК в период ремиссии/низкой активности.
Поступила: 26.01.2022
Принята к публикации: 05.03.2022







