Современная клиническая практика претерпевает ряд видимых и значимых метаморфоз. Все чаще ряд отдельных нозологических единиц международные эксперты обозначают термином «континуум» (сердечно-сосудистый, онкологический, болевой и пр.) или объединяют в одну патофизиологически значимую группу, характеризуя синдромность единого патофизиологического и анатомического поражения (например, метаболический синдром и др.). Привычный для русского врача термин «коморбидность» (сосуществование двух и более патологических процессов) все чаще стал заменяться понятием «полиморбидность» (имеет то же значение, но является словом англоязычной конструкции), а в международной литературе (в особенности в специализированных поисковых системах) большее число работ можно найти, используя термин «мультиморбидность» [5].
Все вышеперечисленное отражает основную картину клинической метаморфозы — частое наличие двух и более патологических процессов у одного больного. Эта проблема является самой обсуждаемой на медицинских форумах мира и России. Прогрессирующее увеличение числа лиц пожилого возраста, гериатрический патоморфоз известных заболеваний, одновременное возникновение ряда инволютивных патологических изменений влияют и на клиническое мышление современного врача. Коморбидность у пациентов в начале нового века создает предпосылки возникновения иного взгляда на танатогенез человеческого организма. Сегодня нам уже недостаточно лишь представлений о сердечно-сосудистом континууме и о терминальном поражении сердца, поскольку они не отражают концептуальный коморбидный статус больного.
Наибольшее значение имеет клиническое понимание описанного патогенеза развития и прогрессирования сахарного диабета 2 типа (СД2) и его осложнений, составляющих, по разным данным, от 20% до 40% случаев коморбидности [8, 15].
Основной причиной высокой инвалидизации и смертности больных СД2 являются кардиоваскулярные нарушения — инфаркт миокарда, сердечная недостаточность, инсульт [22]. Именно поэтому сегодня СД относят к сердечно-сосудистым заболеваниям (ССЗ) [24]. При СД2 частота развития сердечно-сосудистой патологии в 3-4 раза выше по сравнению с таковой у пациентов, им не страдающих. Риск сердечно-сосудистой смертности у больных СД2 без ИБС идентичен таковому у лиц, перенесших инфаркт миокарда, но не имеющих нарушений углеводного обмена. По данным Государственного регистра больных СД в Российской Федерации, смертность среди них от инфаркта миокарда и сердечной недостаточности составляет около 60% [9].
Почему при СД столь высока заболеваемость и смертность от ССЗ? Дело в том, что при нем, наряду с неспецифическими факторами риска развития ССЗ (АГ, дислипидемией, ожирением, курением, гиподинамией, пожилым возрастом, мужским полом, менопаузой, наследственной отягощенностью по ИБС), свое патогенное влияние оказывают и специфические факторы (гипергликемия, гиперинсулинемия, инсулинорезистентность), приводящие к метаболическим сдвигам, запуску воспалительных, цитокиновых, иммунных реакций [1, 2]. К специфическим факторам формирования ССЗ при СД следует также отнести прогрессирующую денервацию как периферических тканей, так и сердца и сосудов — диабетическую нейропатию (ДН).
ДН — термин, обозначающий патологию нервной системы в клинической или субклинической стадии, которая наблюдается при СД в отсутствие других причин ее развития. ДН — наиболее распространенное осложнение СД, это комплекс клинических и субклинических синдромов, каждый из которых характеризуется диффузным или очаговым поражением периферических и/или автономных нервных волокон в результате СД [4].
ДН классифицируется в зависимости от преимущественного вовлечения в процесс спинномозговых нервов (периферическая нейропатия) и/или вегетативной нервной системы (автономная нейропатия) [3, 7].
Генерализованные симметричные полинейропатии:
Фокальные или мультифокальные нейропатии (мононейропатии):
Клиническими проявлениями хронической сенсорно-моторной диабетической полинейропатии являются:
При этом следует подчеркнуть, что жалобы, характерные для нейропатии, отмечаются только у половины пациентов, а у остальных больных она протекает бессимптомно [14].
Диагноз ДН ставится при исключении других причин поражения нервной системы (прежде всего недостаточности витамина В12, гипотиреоза, почечной недостаточности).
Хотя СД часто приводит к развитию нейропатии, она может быть не только следствием диабета. Как и в среднем в популяции, до 5% пациентов с нейропатией недиабетического характера будут иметь еще и СД. Признаки, которые указывают на нейропатии другой этиологии:
Патогенез нейропатии — результат сложного взаимодействия метаболических, сосудистых и генетических факторов [12]. Эти факторы находятся в сложной взаимосвязи и взаимозависимости (рис.).
Рис. Патогенез поражения нервных волокон при диабетической нейропатии (А. М. Мкртумян, 2015)
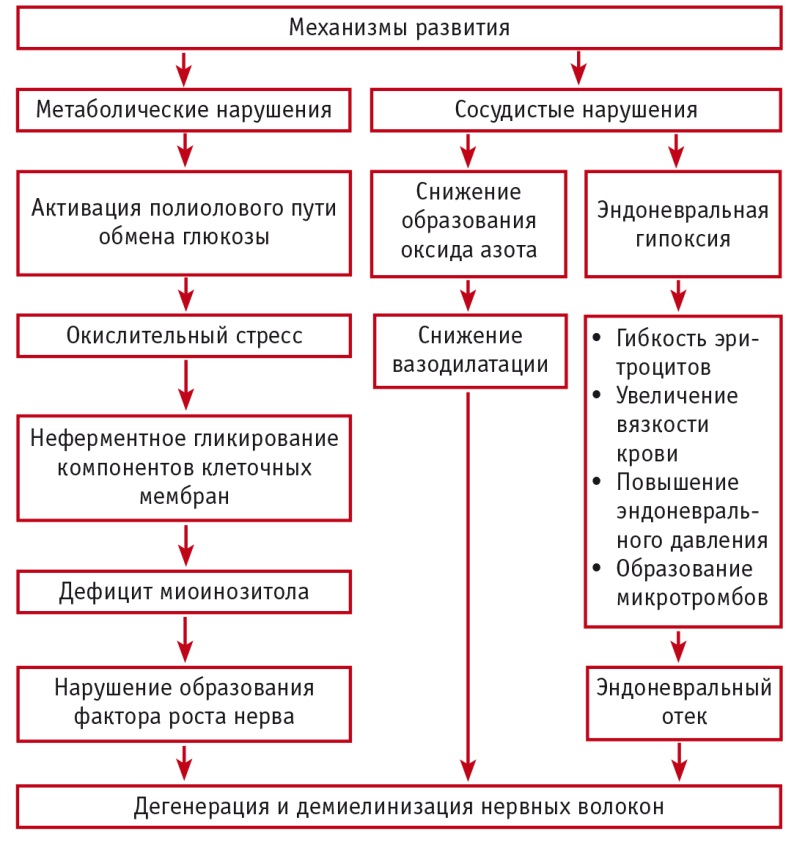
Механизмы реакции периферической нервной системы на повреждение бывают нескольких типов: валлеровское перерождение (реакция на пересечение нерва), атрофия и дегенерация аксона (аксонопатия), сегментарная демиелинизация (миелинопатия) при сохранности аксонов, первичное поражение тел нервных клеток (нейронопатия) [3].
Наиболее существенное функциональное проявление демиелинизации — блокада проводимости. В основе аксонопатии лежат метаболические нарушения в нейронах, ведущие к дистальному распаду аксонов. Клинически это проявляется дистальной симметричной полинейропатией.
Ведущими являются метаболические нарушения. Роль гипергликемии подтверждена в нескольких проспективных мультицентровых исследованиях: DCCT (1993-1995), DEKAN (1995), ALADIN-1, ALADIN-2, ALADIN-3 (1995-2000) и более поздних [23, 25, 30-33].
На значение гипергликемии указывает то, что частота нейропатии у больных СД1 и СД2 одинакова, хотя патогенез этих форм диабета различен.
Клинически выраженная нейропатия чаще встречается у лиц с плохо контролируемым СД. Длительная компенсация СД улучшает течение нейропатии и способствует уменьшению числа случаев этого осложнения [2, 14].
При периферической ДН пациенты предъявляют весьма характерные жалобы, в том числе на чувство онемения кончиков пальцев рук и ног, парестезии — так называемые «мурашки», покалывания, чувство холода, нарушение всех видов чувствительности по типу «носков» и «перчаток». Некоторые больные отмечают и выраженный болевой синдром в дистальных отделах конечностей. В основном боли носят тупой, тянущий характер, однако могут быть очень интенсивными, особенно по ночам и в покое. Далее пациент утрачивает чувствительность дистальных отделов конечностей, а в тканях прогрессивно нарастают метаболические и дистрофические изменения.
Выраженность нейропатии может быть измерена в баллах, что помогает терапевту в уточнении диагноза и прогноза заболевания (табл. 1).
Таблица 1
Оценка выраженности диабетической нейропатии [13]
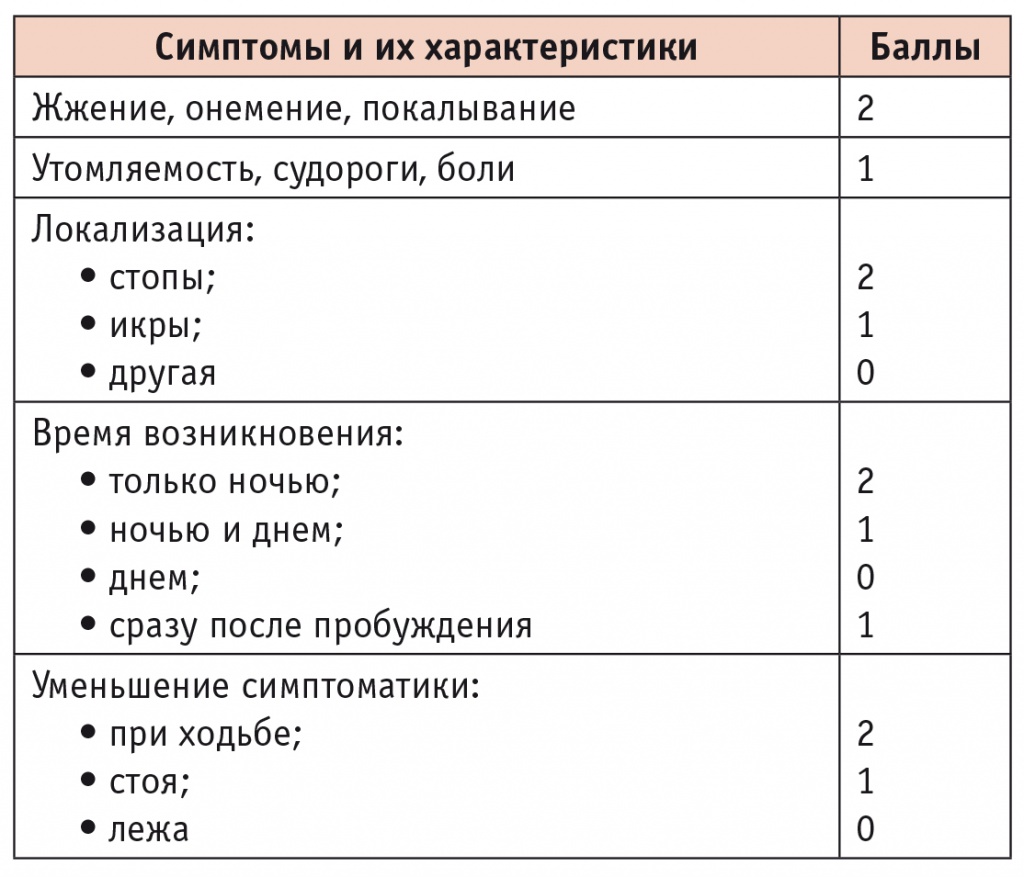
Интерпретация результатов: 3-4 балла ― умеренная, 5-6 баллов ― выраженная, 7-9 баллов ― тяжелая нейропатия.
Лечение ДН, в соответствии с современными представлениями, должно отвечать следующим требованиям [29]:
Коррекция гликемии считается важнейшим фактором сдерживания и даже обратного развития ДН [20]. Исследования UKPDS и DCCT доказали зависимость возникновения осложнений СД от длительности заболевания и компенсации углеводного обмена [21, 27]. В исследовании DCCT адекватный контроль гликемии позволил снизить прогрессирование ретинопатии на 54%, микроальбуминурии — на 39%, нейропатии — на 60%, а риск развития ретинопатии — на 76%. Снижение уровня гликированного гемоглобина всего на 1%, согласно данным исследования UKPDS, способствовало уменьшению риска развития микроангиопатии — на 37%, смертности от СД — на 21%, частоты ОКС — на 14%, нарушения периферического кровообращения — на 43% [28].
Вторым направлением терапии ДН является патогенетическое, цель которого — восстановление анатомической и функциональной целостности нервного волокна. Из внедренных в клиническую практику препаратов активно используется α-липоевая кислота, механизм ее действия заключается в подавлении оксидативного стресса [21, 30].
α-липоевая кислота усиливает эндоневральный кровоток, предотвращая ингибирование NO-синтетазы, и, таким образом, предупреждает ишемическое повреждение нервной ткани [16, 17]. α-липоевая кислота ускоряет процесс проведения импульса по нерву и нормализует содержание глютатиона. Известно, что при оксидативном стрессе происходит активация фактора транскрипции NF-kB, который стимулирует выработку эндотеллина 1 и тканевого эндотелиального фактора (важных составляющих патогенеза ДН) [19]. Таким образом, α-липоевая кислота играет важную роль в предупреждении развития ДН посредством своего защитного влияния на эндотелиальную функцию, а также вносит вклад в предотвращение повреждения нервов при оксидативном стрессе, увеличивая уровень поглощения глюкозы в эндоневрии, повышая активность супероксиддисмутазы и супероксидкаталазы. Было показано, что назначение α-липоевой кислоты больным СД2 увеличивает уровень инсулинзависимой утилизации глюкозы и снижает периферическую резистентность к инсулину [26].
Дополнительные перспективы в лечении ДН связаны с разработкой новых лекарственных форм витаминов группы В и их комбинаций с внутриклеточными коферментами [10, 18]. Ключевой задачей такой терапии является длительное стимулирование ремиелинизации и нивелирование метаболических нарушений. Одним из новых препаратов, удовлетворяющим приведенным требованиям, стал Кокарнит.
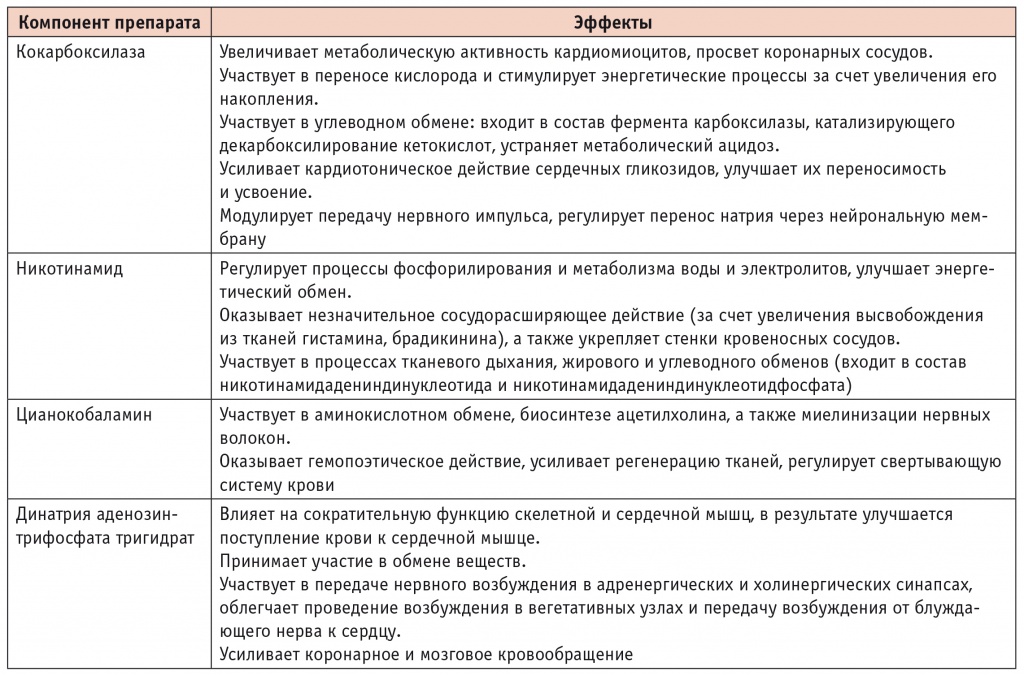
Никотинамид, кокарбоксилаза, цианокобаламин, динатрия аденозинтрифосфата тригидрат, входящие в состав Кокарнита, оказывают активирующее действие на процессы аэробного окисления глюкозы, а также регулирующее влияние на процессы β-окисления жирных кислот (табл. 2).
Таблица 2
Действие препарата Кокарнит
Согласно исследованиям, плазменная концентрация пиридоксальфосфата (активной формы витамина В6) у пациентов с СД статистически значимо ниже по сравнению таковой у лиц без диабета [11, 18]. При наличии микроальбуминурии этот показатель снижается еще более выраженно.
Дефицит витамина В12 по результатам измерения концентраций голотранскобаламина и метилмалоновой кислоты в плазме крови отмечался реже, чем дефицит витаминов В1 и В6. Он выявлялся у 6,8% больных с СД, при наличии микроальбуминурии — у 8,7% [8].
По данным других исследований, распространенность дефицита витамина В12 среди лиц пожилого возраста составляет от 5% до 40% [8]. У пациентов с СД, особенно пожилых, имеет место высокая частота атрофического гастрита и ассоциированной с ним мальабсорбции кобаламина. Высокий уровень гомоцистеина, обусловленный дефицитом витамина В12, приводит к прогрессированию атеросклероза.
Согласно результатам многоцентрового рандомизированного плацебо-контролируемого исследования (2010), длительное лечение СД2 метформином ведет к дефициту витамина В12 [15]. При этом снижение его уровня носит прогрессирующий характер.
В исследовании Л. Вуду и соавт. антидиабетическая терапия в сочетании с метаболическим препаратом Кокарнит в виде 9-10 внутримышечных инъекций ежедневно по сравнению со стандартной терапией СД в контрольной группе показала более высокую эффективность и быстроту в лечении нейропатии [6]. У пациентов из основной группы улучшение клинической картины было более явным по сравнению с контролем. Быстрее уменьшились клинические симптомы у пациентов с наименьшей длительностью СД (2,3 ± 0,7 года). Наблюдался более выраженный и быстрый регресс (уже на 6-й день лечения) чувства онемения и покалывания нижних конечностей. Несколько дольше регрессировали мышечные судороги и ощущение жжения (симптомы сохранялись и на 14-й день лечения).
Комплексная терапия пациентов основной группы привела к более выраженному уменьшению интенсивности боли по сравнению с участниками контрольной группы. Неврологический осмотр показал также более быстрое восстановление тактильной и болевой чувствительности в основной группе. У 11 (24,4%) больных восстановилась мышечная сила и оживился ахиллов рефлекс.
Прием Кокарнита способствует улучшению проведения возбуждения по периферическим нервам, повышению функциональной активности иннервируемых ими мышц. На фоне приема препарата наступает стабилизация состояния в нервно-мышечном аппарате нижних конечностей как наиболее чувствительных к метаболическим расстройствам при СД в силу их повышенных физиологических функций. Кокарнит оказывает положительное влияние на функциональное состояние вегетативных волокон периферических нервов, что, по-видимому, обусловлено его разнонаправленным нормализующим действием на энергетический метаболизм и способностью усиливать репаративные процессы [6].
ЗАКЛЮЧЕНИЕ
Диабетическая полинейропатия является частым осложнением сахарного диабета, которое приводит к значительной заболеваемости и нарушению качества жизни больных. Постановка диагноза основана на сборе соответствующего анамнеза и данных неврологического обследования, в ходе которого обнаруживают дистальную симметричную сенсорную и/или моторную нейропатию.
Ранняя диагностика диабетической нейропатии важна для предупреждения таких осложнений, как образование хронических язв и ампутация ног, и должна проводиться терапевтом на амбулаторном этапе оказания медицинской помощи. Единственным видом терапии, для которой подтверждена способность снижать частоту и замедлять прогрессирование диабетической полинейропатии, является установление хорошего контроля над уровнем сахара в крови. Симптоматическое лечение нейропатической боли может во многом улучшить качество жизни пациентов с диабетической полинейропатией и включает в себя компоненты, действующие на разные этапы метаболизма, трофику нервной ткани, способствующие ремиелинизации поврежденных нервных волокон.








