Лекарственные поражения печени (ЛПП) остаются в ряду наиболее важных нежелательных эффектов лекарственных средств. Непрерывное поступление сведений о гепатотоксических реакциях как на хорошо изученные, так и на недавно появившиеся на рынке препараты выдвигает ЛПП в ряд актуальнейших проблем гепатологии.
Цель обзора: осветить основные вопросы эпидемиологии, классификации, диагностики и лечения ЛПП.
ЭПИДЕМИОЛОГИЯ И ЭТИОЛОГИЯ
Истинная распространенность ЛПП остается и, видимо, останется неизвестной, что обусловлено как объективными, так и субъективными причинами. Гепатотоксические реакции документированы более чем для 1000 препаратов [1, 13, 31, 45, 55]. При этом за 32-летний период только 11 лекарств, в частности троглитазон, были отозваны с рынка в связи с гепатотоксичностью. Значительно чаще в инструкции вносится предупреждающая информация или ограничиваются показания к применению [54].
Частота ЛПП составляет, согласно различным источникам, 13,9-19,1 на 100 тыс. [9, 20, 22, 28, 45]. В странах Европы и США побочные эффекты лекарственных средств становятся причиной желтухи у 2-5% госпитализированных больных, 40% острых гепатитов у пациентов старше 40 лет и 13-25% случаев фульминантной печеночной недостаточности (ФПН). Общая частота летальных исходов и случаев выполнения трансплантации печени достигает 9% [10].
В США причиной ФПН в 40-50% случаев выступает парацетамол, еще 11-12% случаев приходится на другие лекарственные препараты (включая биологически активные добавки — БАД), что эквивалентно частоте ФПН вследствие острых вирусных гепатитов и превышает таковую вследствие других этиологических факторов [29, 40].
По данным C. Y. Chang и T. D. Schiano, наиболее часто ЛПП как у госпитальных, так и у амбулаторных пациентов обусловливает применение НПВП и антибиотиков, в частности амоксициллина/клавуланата [13]. Вполне понятно, что это связано не с низким уровнем их «печеночной» безопасности, а с высокой частотой назначения и длительными курсами.
Особого внимания заслуживает нарастающее количество ЛПП в результате употребления БАД, оно возросло на 20% за последние 10 лет [36]. N. Chalasani и соавт. полагают, что применение БАД служит причиной 16-72% всех случаев ЛПП с существенной вариабельностью с преобладанием в Азии [12, 47]. Относительная частота развития ФПН на фоне приема БАД достигает 10% среди всех случаев ЛПП-ассоциированной ФПН [40]. В последние годы повышенное внимание привлекают БАД, используемые для коррекции веса [21, 41], а также экстракты зеленого чая [9].
Следует учитывать, что широкий спектр клинических и гистологических проявлений ЛПП затрудняет дифференциальную диагностику с другой патологией печени, а биохимические параметры у амбулаторных больных нередко не определяют. Поэтому данные о распространенности ЛПП могут быть значительно занижены по сравнению с реальными цифрами. Исследование, выполненное во Франции, установило, что истинная частота ЛПП в 16 раз выше официальных статистических данных [45].
КТО В ГРУППЕ РИСКА?
Женщины. Большинство исследователей называют женский пол важным фактором риска ЛПП. Вместе с тем это положение дискутабельно, так как потенциально гепатотоксические лекарственные средства у женщин применяются чаще [55]; с другой стороны, относительная частота ЛПП у них также превышает таковую у мужчин [24]. Согласно некоторым данным, частота ЛПП выше у мужчин в раннем возрасте, а у женщин — в позднем [33].
Лица старших возрастных групп. Риск ЛПП возрастает, по разным оценкам, у лиц старше 55 или старше 65 лет [12, 17]. Согласно статистике ВОЗ, в общей структуре ЛПП лица от 0 до 17 лет составляют 6%, от 18 до 64 лет — 62%, старше 65 лет — 32% [25]. Для некоторых лекарственных средств, таких как амоксициллин/клавуланат, нитрофурантоин, галотан, изониазид, доказана роль возраста в увеличении частоты ЛПП [8].
Фармакологические свойства лекарственных препаратов. Наибольшее значение имеют такие характеристики лекарственных средств, как липофильность, степень печеночного метаболизма, суточная и курсовая дозы [14, 34, 52]. На основании большого количества наблюдений M. Chen и соавт. вывели «правило двух» (rule-of-two), согласно которому препараты с высокой липофильностью и назначаемые в дозах более 100 мг являются более гепатотоксичными [14].
Преимущественный (более 50%) метаболизм лекарственного препарата в печени также коррелирует с частотой (но не с тяжестью) ЛПП [52].
Связь частоты развития ЛПП с длительностью курса установлена для сульфасалазина и диклофенака; зависимость частоты ЛПП от дозировки выявлена для диклофенака, амоксициллина/клавуланата, флуклоксациллина [18].
Полипрагмазия. При одновременном приеме менее 5 лекарств вероятность развития побочных эффектов составляет около 4%, 5-10 препаратов — 10%, 10-16 — 28%, 16-20 — 54% [33]. Риск ЛПП возрастает при назначении любых двух потенциально гепатотоксических препаратов; в частности, это правило актуально для противотуберкулезных средств [18].
Фоновая патология печени. В подавляющем большинстве случаев сопутствующее хроническое заболевание печени не увеличивает риск ЛПП [23].
Однако из этого правила есть исключения. Так, у больных с хронической патологией печени возрастает риск гепатотоксичности азитромицина (6,7% vs 1,5%) [12]. Схожие данные получены для ацетилсалициловой кислоты, метотрексата, изониазида, средств для лечения ВИЧ-инфекции [20, 23, 48].
Генетический полиморфизм. Геномные исследования позволили выявить специфические гаплотипы главного комплекса гистосовместимости человека (HLA), ассоциированные с повышенным риском ЛПП, например HLA-B*5701 [4, 39, 49]. Для однонуклеотидного полиморфизма HLA II класса rs9274407 установлена сильная ассоциация с проявлением гепатотоксичности флуклоксациллина и амоксициллина/клавуланата [34].
В качестве потенциальных индикаторов ЛПП, вызванных тровафлоксацином и кларитромицином, повышение уровней которых может предшествовать гипертрансаминаземии, рассматривают ИФН-γ, ИЛ-1α и ИЛ-6 [15].
Протеомные биомаркеры, такие как аполипопротеин Е, относящийся к белкам острой фазы, также идентифицированы в качестве потенциальных маркеров риска развития ЛПП, в том числе вызванного антибиотиками [6]. Однако данный биомаркер, впрочем, как и другие, не позволяет определить этиологический агент при приеме пациентом нескольких препаратов. При этом клиническая значимость выявления названных биомаркеров остается предметом дискуссии; возникают сомнения, что их обнаружение может служить основанием для отказа от проведения лечения [45].
В роли дополнительных факторов риска рассматриваются злоупотребление алкоголем, ожирение, беременность, трансплантация печени [22].
ПАТОГЕНЕТИЧЕСКИЕ ВАРИАНТЫ
Все перорально или парентерально введенные лекарства проходят через биотрансформационные системы печени и затем в измененном либо неизменном виде поступают в системный кровоток.
Среди множества разнообразных ксенобиотиков лишь небольшая часть обладает достаточной водорастворимостью для экскреции в неизмененном виде с мочой или желчью. Из лекарственных средств к ним относятся содержащие полярные группы пенициллины, цефалоспорины, тетрациклины, тиазиды, амилорид и кромогликоевая кислота; метаболиты этих препаратов не обнаружены. Большинство субстанций характеризуются липофильными свойствами и поэтому подвергаются биотрансформации специфическими трансферазами, результатом которой является образование гидрофильных соединений, экскретирующихся аналогично первой группе. В указанных процессах могут принимать участие почки, слизистая кишечника, мышцы, легкие и кожа, однако по сравнению с печенью их роль минимальна [1].
Помимо нетоксичных гидрофильных соединений возможно также образование токсичных метаболитов — химически нестабильных соединений, обладающих прямым повреждающим действием посредством расщепления связей между белками, повреждения микрофиламентов и т. д., что приводит к нарушению внутриклеточного транспорта и деления клетки, фрагментации ДНК путем активации каспаз (преимущественно по внутреннему пути) и в результате к апоптозу клетки [29, 55].
Осознание факта, что вследствие печеночного метаболизма могут образовываться высокореактивные токсические продукты, крайне важно для понимания патогенеза ЛПП. Разнообразие взаимодействия внешних и внутренних факторов обусловливает возможность мимикрии ЛПП под практически любое заболевание печени, как острое, так и хроническое [29].
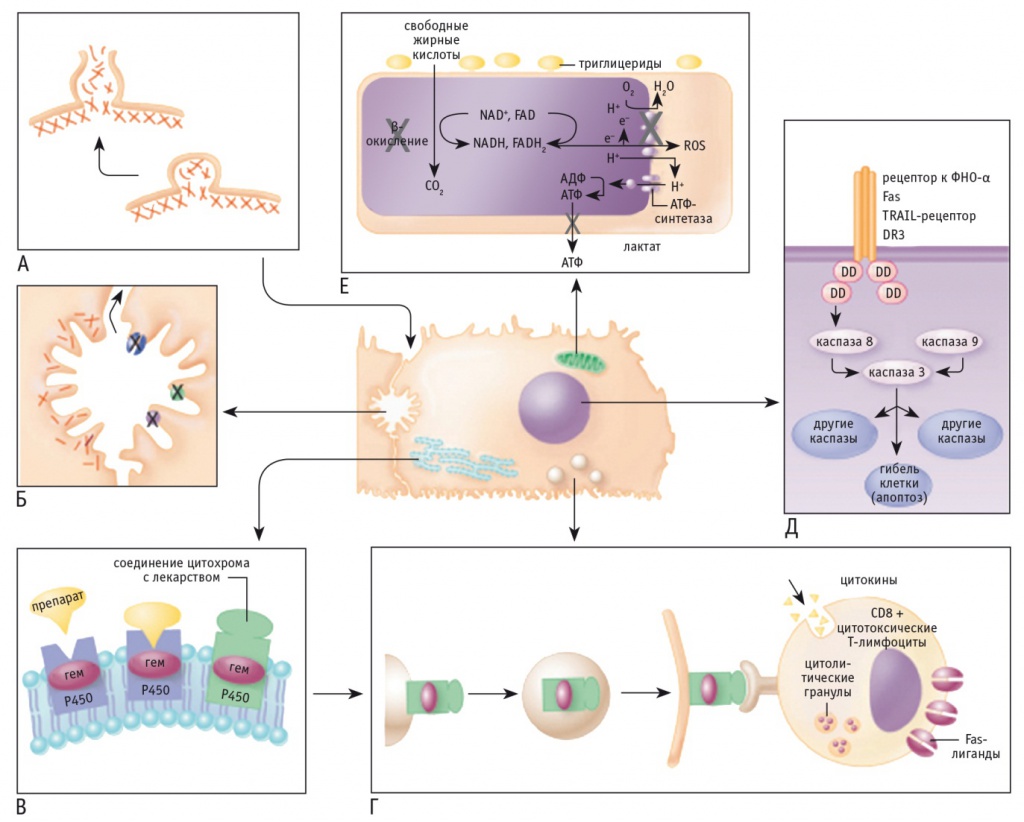
Помимо прямого токсического действия, как в случае с парацетамолом, возможны другие механизмы ЛПП (рис.).
Рис. Механизмы лекарственных поражений печени на клеточном уровне [29].
Примечания.
1. А ― сдвиг внутриклеточного гомеостаза кальция приводит к нарушению сборки фибрилл актина на поверхности гепатоцита, что сопровождается образованием пузырьков воздуха в клеточной мембране, нарушением ее целостности и последующим лизисом клетки. Б ― при холестатическом варианте разрыв актиновых филаментов, расположенных в непосредственной близости от желчных каналикул, нарушение функции транспортных помп, в частности протеина мультилекарственной резистентности, приводят к подавлению экскреции билирубина и других органических соединений с желчью. В ― токсичные метаболиты, образующиеся при участии ферментов системы цитохрома Р450, обладают способностью к миграции на клеточную поверхность гепатоцита (Г), где могут выступать в качестве антигенных мишеней для Т-лимфоцитов. Д ― активация апоптоза посредством взаимодействия с рецептором фактора некроза опухоли (данный рецептор или Fas может запускать каскад внутриклеточных каспаз, что ведет к апоптозу). Е ― некоторые лекарственные препараты обладают способностью нарушать функции митохондрий посредством блокады ферментов дыхательной цепи и снижения продукции аденозинтрифосфата. Изменение метаболизма свободных жирных кислот и недостаток аэробного окисления приводят к накоплению лактата и свободных радикалов, повреждающих митохондриальную дезоксирибонуклеиновую кислоту.
2. AДФ ― аденозиндифосфат, АТФ ― аденозинтрифосфат, ФНО ― фактор некроза опухоли
Выделяют два типа неблагоприятных побочных реакций лекарственных средств. Первый тип (тип А) — дозозависимые, предсказуемые реакции, возникающие в результате прямого повреждающего действия поступившего вещества и характеризующиеся отчетливой зависимостью от дозы и времени его экспозиции. Типичный пример — отравление суррогатами алкоголя или парацетамолом при применении последнего в дозах, значительно превышающих терапевтические (более 10 г в сутки).
Большинство случаев ЛПП принадлежит ко второму типу реакций (тип В) — дозонезависимых и непредсказуемых. Такие реакции развиваются по механизму идиосинкразии, то есть вследствие врожденных дефектов биохимических и ферментных систем организма, приводящих к нарушению метаболизма (метаболическая идиосинкразия), или по механизму гиперчувствительности (иммунологическая идиосинкразия). В пользу идиосинкразии свидетельствует развитие лекарственной реакции после первой экспозиции вещества. Непредсказуемые реакции могут проявляться в период от 1-8 недель до 12 месяцев от начала приема препарата [1, 13, 22, 55].
КЛАССИФИКАЦИЯ: КЛИНИКО-ГИСТОЛОГИЧЕСКИЕ ПАРАЛЛЕЛИ
Предложено несколько весьма сходных друг с другом классификаций ЛПП. В повседневной клинической практике наиболее удобна классификация, предложенная в 1993 г. Советом международных научных медицинских организаций (Councils for International Organizations of Medical Sciences — CIOMS), в основе которой лежит принцип оценки активности биохимических показателей сыворотки крови: АЛТ, щелочной фосфатазы (ЩФ) и билирубина. На основании полученных результатов выделяют три типа ЛПП: гепатоцеллюлярное, холестатическое и смешанное [7, 31].
Гепатоцеллюлярное ЛПП характеризуется повышением активности АЛТ более чем в 2 раза в сравнении с верхним лимитом нормы (ВЛН) или соотношением АЛТ/ЩФ ≥ 5. Данную форму ЛПП отличает более тяжелое поражение печени в сравнении с холестатическим.
Сочетание гепатоцеллюлярного типа ЛПП с гипербилирубинемией характеризует тяжелое повреждение печени, сопряженное с высокой смертностью. Его частота составляет 0,7-1,3 на 100 тыс. пациентов, принимающих лекарственные препараты.
Для холестатического ЛПП типично повышение активности ЩФ более 2 ВЛН или соотношение АЛТ/ЩФ ≤ 2 ВЛН.
Смешанному типу ЛПП свойственны рост активности АЛТ > 2 ВЛН и соотношение АЛТ/ЩФ > 2 ВЛН, но < 5 ВЛН. У пациентов с холестатическим или смешанным типом ЛПП чаще встречается хроническое, с гепатоцеллюлярным типом — острое течение болезни [31].
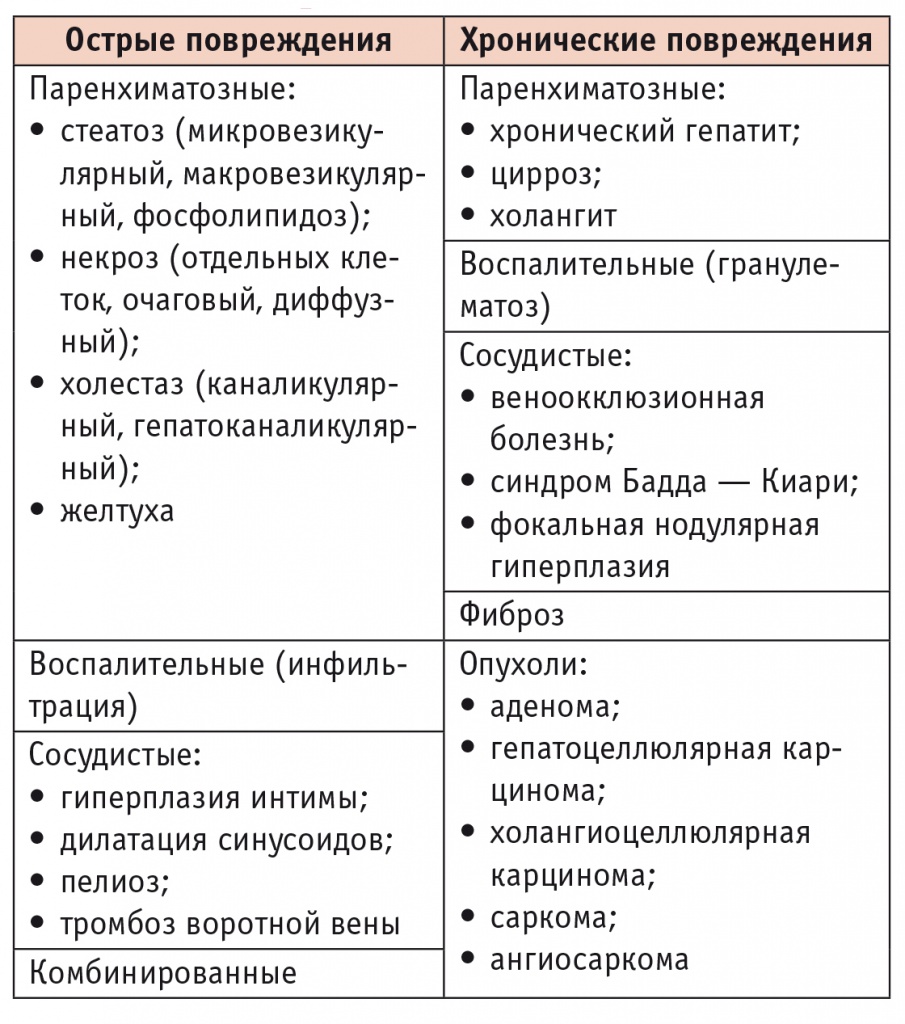
Несмотря на то что патоморфологический спектр ЛПП весьма широк (табл. 1), в рассмотренные выше варианты укладывается подавляющее большинство случаев лекарственной гепатотоксичности.
Таблица 1
Гистологические варианты лекарственного поражения печени [1]
ДИАГНОСТИЧЕСКИЕ ЭТАПЫ
Первый этап диагностики ЛПП — тщательный сбор лекарственного анамнеза, в том числе сведений о приеме БАД и/или средств нетрадиционной медицины.
Второй этап — исключение других возможных причин поражения печени: вирусных, алкогольных, аутоиммунных, метаболических и т. д. Этот процесс может занять немало времени, кроме того, следует учитывать, что ЛПП нередко «накладывается» на фоновую патологию печени. Необходимо помнить, что у 20% пациентов с ЛПП с сохраняющейся биохимической активностью, несмотря на прекращение действия этиологического препарата, впоследствии диагностируется аутоиммунный гепатит [22, 24, 55].
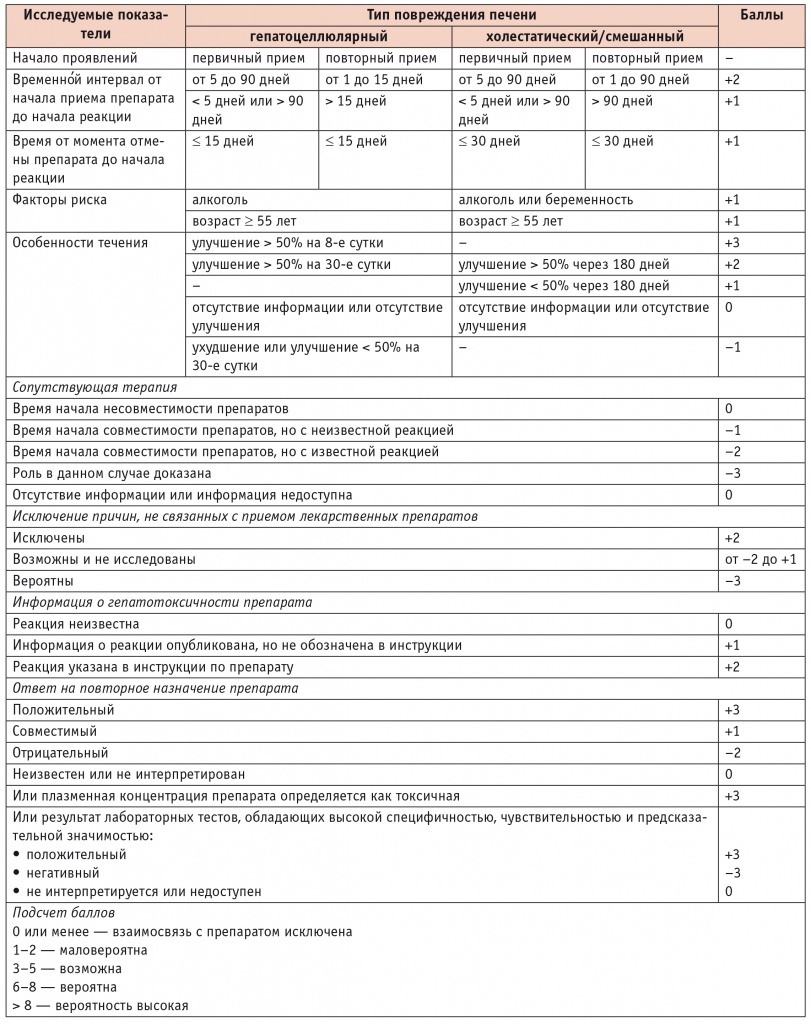
Трудности диагностики ЛПП и интерпретации результатов, полученных с помощью диагностических шкал, часто обусловлены приемом пациентом одновременно нескольких препаратов, а также сопутствующими заболеваниями, которые могут протекать с изменениями биохимических показателей крови. Вместе с тем отсутствие стандартных критериев диагностики ЛПП диктует необходимость комплексной оценки состояния пациента — тщательного сбора анамнеза, анализа клинических данных, а также применения диагностических шкал, например CIOMS/RUCAM (табл. 2). Как видно из таблицы 2, данная шкала учитывает и третий этап диагностики ЛПП — оценку динамики клинико-лабораторных показателей на фоне отмены этиологического препарата [1, 31].
Таблица 2
Шкала Councils for International Organizations of Medical Sciences/Roussel Uclaf Causality Assessment Method [7]
ОТМЕНИТЬ ИЛИ ПРОДОЛЖИТЬ ПРИЕМ ПРЕПАРАТА, ВЫЗВАВШЕГО ЛЕКАРСТВЕННОЕ ПОРАЖЕНИЕ ПЕЧЕНИ?
При гепатоцеллюлярном варианте ЛПП в большинстве случаев отмена лекарственного средства, вызвавшего гепатотоксическую реакцию (этиологического), приводит к спонтанной нормализации активности трансаминаз в течение нескольких недель. Разрешение в более поздние сроки либо нарастание активности трансаминаз после прекращения приема препарата при данном типе ЛПП встречается редко. При холестатическом варианте ЛПП улучшение наступает, как правило, в период от нескольких недель до нескольких месяцев после отмены этиологического препарата. Другой вариант течения ЛПП — бессимптомное повышение активности трансаминаз без тенденции к прогрессированию на фоне продолжающегося приема этиологического препарата — принято обозначать терминами «адаптация» или «толерантность».
В каждом конкретном случае приходится решать вопрос отмены или продолжения терапии индивидуально. В настоящее время общепринятые международные рекомендации по ведению больных с ЛПП не разработаны, поэтому авторы многочисленных руководств по гепатологии предлагают собственные алгоритмы. Большинство ведущих специалистов полагают, что незначительное или умеренное повышение активности трансаминаз не требует отмены вызвавшего ЛПП препарата. Так, Н. J. Zimmerman считает, что активность АЛТ менее 5 ВЛН в отсутствие клинических проявлений дает основание продолжить прием этиологического препарата с последующим тщательным наблюдением за пациентом, в то время как при активности АЛТ выше 8 ВЛН показана незамедлительная его отмена [55]. По мнению большинства специалистов, поводом для отмены этиологического препарата служит любое повышение активности АЛТ в сочетании с изменением одного из функциональных печеночных тестов: билирубина, альбумина или протромбинового времени (МНО) [1, 23, 31, 47, 53].
При появлении у пациента с ЛПП желтухи целесообразно пользоваться правилом Хайя, названным в честь Хаймана Циммермана и выведенным им еще в 1968 г. Он первым заметил, что желтуха, возникающая в любой момент от начала приема нового лекарственного средства у пациентов с гепатоцеллюлярным типом ЛПП (повышение активности АСТ или АЛТ более 3 ВЛН или ЩФ более 1,5 ВЛН), в комбинации с повышением уровня билирубина более 3 ВЛН служит неблагоприятным прогностическим фактором и свидетельствует о тяжелом поражении печени с высокой вероятностью летального исхода [47, 55].
ПАТОГЕНЕТИЧЕСКАЯ ТЕРАПИЯ С ПОЗИЦИИ ДОКАЗАТЕЛЬНОЙ МЕДИЦИНЫ
Средством с подтвержденной эффективностью в лечении пациентов с поражением печени вследствие передозировки парацетамола признан N-ацетилцистеин. Препарат оказывает антиоксидантное действие за счет свободной сульфгидрильной группы, способной непосредственно взаимодействовать с токсинами и нейтрализовывать их. Не менее важный эффект N-ацетилцистеина — способность восполнять запасы глутатиона за счет активации его синтеза и обезвреживать химические субстраты [5, 42].
Краткосрочное назначение преднизолона в дозе 10-80 мг/сут демонстрирует позитивный эффект у пациентов с ЛПП с явными проявлениями гиперчувствительности (сыпью, лихорадкой, эозинофилией) [43, 46, 55].
Урсодезоксихолевая кислота, состоящая из гидрофильных желчных кислот, широко применяется при холестатических заболеваниях печени и обладает многообразными механизмами действия [19]. Рекомендуемые дозы составляют 13-15 мг/кг массы тела в сутки. Однако в рандомизированном контролированном исследовании M. Kojima и соавт. наблюдалось почти трехкратное (11,4% vs 32,4%) уменьшение частоты гепатотоксических реакций на флутамид при назначении минимальной дозировки урсодезоксихолевой кислоты — 375 мг/сут [27].
S-аденозилметионин нормализует синтез эндогенного фосфатидилхолина в гепатоцитах, что повышает текучесть и поляризацию мембран. Это улучшает функцию ассоциированных с мембранами гепатоцитов транспортных систем желчных кислот и способствует пассажу желчных кислот в желчевыводящие пути. S-аденозилметионин снижает токсичность желчных кислот в гепатоците, осуществляя их конъюгирование и сульфатирование. Конъюгация с таурином повышает растворимость желчных кислот и выведение их из гепатоцита. Процесс сульфатирования желчных кислот способствует их элиминации почками, а также облегчает прохождение через мембрану гепатоцита и выведение с желчью [11].
S-аденозилметионин восполняет пул внутрипеченочного глутатиона, обеспечивая клеточные механизмы окислительно-восстановительной детоксикации, нейтрализует свободные радикалы, снижая интенсивность ПОЛ. В ряде экспериментальных исследований продемонстрирована более высокая эффективность S-аденозилметионина по сравнению с N-ацетилцистеином при ЛПП, вызванных передозировкой парацетамола, по скорости восстановления уровня глутатиона [11, 47].
К дополнительным механизмам действия при ЛПП можно отнести активацию β-окисления свободных жирных кислот и элиминацию триглицеридов из печени за счет стимуляции сборки липопротеинов очень низкой плотности [16, 30, 35].
В работах, выполненных на клеточных культурах и грызунах, показано стимулирующее действие S-аденозилметионина на регенерацию гепатоцитов и подавляющее — на образование соединительной ткани [26].
Бо’льшая часть исследований, показавших эффективность S-аденозилметионина при ЛПП, выполнена для онкологических пациентов [2, 44, 50, 51]. Так, в одном из них из 105 больных колоректальным раком, леченых по схеме FolFox (фторурацил, оксалиплатин, кальция фолинат — 12 курсов), 60 дополнительно получали S-аденозилметионин 400 мг 2 раза в день. Проявления гепатотоксичности отсутствовали у 70% в группе S-аденозилметионина по сравнению с 43% в группе контроля (p = 0,002), что обусловило существенно меньшую частоту отсрочек следующих курсов и случаев снижения дозировок препаратов [51].
S. Neri и соавт. в двойном слепом рандомизированном контролируемом исследовании оценили эффективность S-аденозилметионина в невысокой дозировке (400 мг в день) для профилактики лекарственного гепатита, индуцированного циклоспорином [37]. Результаты отечественных исследований также подтверждают эффективность S-аденозилметионина при псориазе и не только в отношении ЛПП [38].
К дополнительным преимуществам S-аденозилметионина могут быть отнесены различные пути введения — внутривенный, внутримышечный, пероральный — и сохранение достигнутого эффекта до 3 месяцев после отмены терапии, что важно при курсовом лечении потенциально гепатотоксическими препаратами.
При неэффективности всех мероприятий единственным методом лечения, спасающим жизнь пациента, может быть трансплантация печени [1, 10, 20, 26, 28, 29, 40, 54, 55]. Имеются отдельные сообщения о повышении выживаемости в листе ожидания трансплантации печени на фоне применения альбуминопосредованной гемодиафильтрации (аппарат MARS) [32].
ЗАКЛЮЧЕНИЕ
Выбор тактики ведения пациента с лекарственным поражением печени (ЛПП) определяется характером и тяжестью болезни, особенностями применения потенциально гепатотоксического препарата и индивидуальными характеристиками больного. Назначение препаратов с высоким гепатотоксическим потенциалом (противоопухолевых, противотуберкулезных, некоторых иммуносупрессоров и т. д.) иногда требует превентивного назначения средств патогенетической направленности. При использовании препаратов с низким гепатотоксическим потенциалом рекомендуется индивидуальный мониторинг биохимических показателей. И, безусловно, ЛПП должно включаться в область дифференциального диагноза любого поражения печени неуточненной этиологии.








