Настоящий обзор имеет своей целью анализ данных мировой литературы по терапии воспалительных заболеваний кишечника (ВЗК) иммунобиологическими препаратами и лечению ВЗК в педиатрической практике.
К ВЗК относятся язвенный колит (ЯК) и болезнь Крона (БК) — идиопатические хронические рецидивирующие заболевания ЖКТ, которые имеют как наслаивающиеся друг на друга, так и самостоятельные клинические и патологические черты[1].
В настоящее время распространенность ВЗК среди общего населения в мире составляет до 0,3%[2], что создает огромную экономическую нагрузку на общество[3]. По существующим оценкам, только в США прямые затраты, связанные с ВЗК, в 2014 г. находились в пределах от 14,6 до 31,6 млрд долларов[4].
Этиология и патогенез ВЗК остаются в значительной степени неизвестными. В настоящее время эти заболевания считаются многофакторными, развивающимися под влиянием отдельных генетических и экологических факторов, количественных и качественных изменений кишечной флоры и нарушений иммунного ответа. Сочетание этих факторов приводит к неадекватной иммунной реакции на комменсальную флору у генетически предрасположенных субъектов и вызывает нарушения барьерной функции слизистой оболочки ЖКТ[5].
К факторам риска развития ВЗК относятся семейная предрасположенность, социальные и географические факторы, стресс, прием некоторых лекарственных средств, оральных контрацептивов, ожирение и диета с повышенным содержанием углеводов[5].
Течение ВЗК носит прогрессирующий деструктивный характер и сопровождается различными кишечными осложнениями, включая стенозы, абсцессы и свищи, а также внекишечными проявлениями и связанными с колитом неоплазиями и раком[1].
Лечение ВЗК требует индивидуального подхода в зависимости от формы и тяжести заболевания, локализации процесса и наличия кишечных и внекишечных осложнений. Терапия обычно разделяется на две стадии: стадию лечения обострения для достижения ремиссии (индукционная терапия) и стадию поддерживающей терапии.
В течение длительного времени фармакотерапия ВЗК ограничивалась применением глюкокортикостероидов (ГКС) для индукции ремиссии и иммунодепрессантов (таких как азатиоприн, меркаптопурин и метотрексат) для ее поддержания[5].
ПРИМЕНЕНИЕ ИНГИБИТОРОВ ФАКТОРА НЕКРОЗА ОПУХОЛИ
В 1997 г. парадигма терапии ВЗК с неселективного подавления иммунного ответа с помощью традиционных классов лекарственных препаратов сменилась высокоселективным подавлением воспалительного процесса за счет ингибирования ключевого провоспалительного цитокина — фактора некроза опухоли альфа (ФНО-α). S.R. Targan и соавт. опубликовали результаты первого рандомизированного клинического исследования (РКИ), подтвердившие эффективность инфликсимаба (ИФМ) — современного препарата моноклональных антител к ФНО-α — в лечении БК[6].
Помимо ИФМ, современными представителями моноклональных антител к ФНО-α являются адалимумаб (АДБ), голимумаб и цетролизумаба пэгол (табл.).
Таблица
Показания и режимы дозирования иммунопрепаратов при воспалительных заболеваниях кишечника[7]
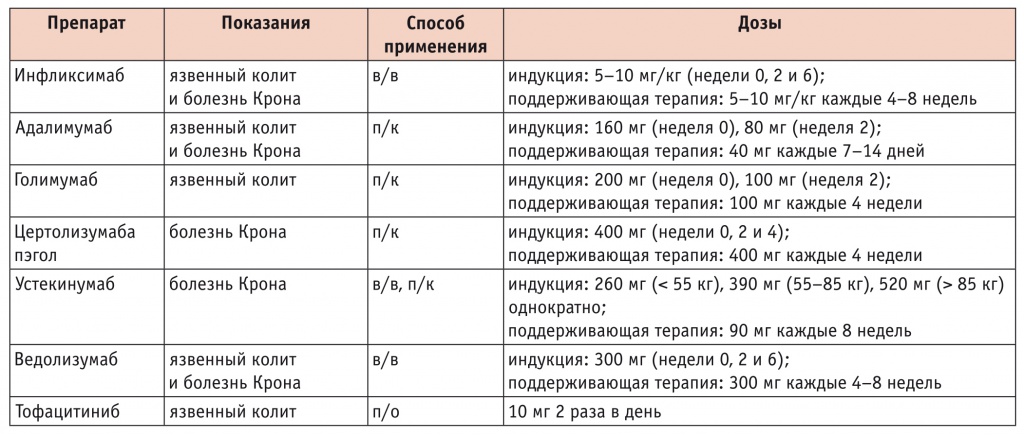
Примечание: в/в — внутривенно; п/к — подкожно; п/о — перорально.
Анти-ФНО-терапия при язвенном колите
В настоящее время имеются убедительные доказательства того, что анти-ФНО-терапия позволяет добиться клинической ремиссии при гормонозависимых и гормонорезистентных формах ЯК средней и тяжелой степени.
Систематический обзор с сетевым метаанализом, включавший 506 РКИ, показал, что у пациентов с ЯК ингибиторы ФНО эффективны не только при индукции, но и при поддержании ремиссии заболевания[8]. Однако у 60% пациентов с ЯК в течение 5 лет после начала терапии ингибиторами ФНО развивалась вторичная резистентность[9].
Анти-ФНО-терапия при болезни Крона
В систематическом обзоре с сетевым метаанализом десяти РКИ, в котором изучалась эффективность ИФМ, АДБ и цертолизумаба пэгола у пациентов с БК, показано, что все эти ингибиторы ФНО эффективнее плацебо как при индукции, так и при поддержании ремиссии заболевания [8].
Положительные результаты получены в многоцентровом РКИ с участием 52 медицинских организаций, где изучалась эффективность АДБ в индукции ремиссии у больных БК, ранее лечившихся ИФМ[10].
У пациентов с БК тяжелой и средней степени, гормонозависимых либо не отвечавших на большие дозы месалазина или ГКС, комбинированная терапия ИФМ и азатиоприном оказалась значительно эффективнее, чем изолированное применение ИФМ, в достижении клинической ремиссии к 26-й неделе после начала лечения[11]. Однако неизвестно, как долго должна продолжаться данная комбинированная терапия.
Имеются также подтверждения того, что ингибиторы ФНО являются эффективными средствами лечения параректальных свищей при БК[12].
Таким образом, в настоящее время ингибиторы ФНО можно считать эффективными при лечении ЯК тяжелой и средней степени (ИФМ, АДБ, голимумаб) и БК (ИФМ, АДБ, цертолизумаба пэгол).
Побочные эффекты ингибиторов фактора некроза опухоли
Анти-ФНО-терапия может вызывать реактивацию таких инфекций, как туберкулез и вирусный гепатит В[13]. Ввиду этого перед ее назначением необходимо провести скрининг на вышеуказанные инфекции.
Согласно ретроспективному когортному исследованию, в течение 3,5 года наблюдения примерно у 30% пациентов, получавших ингибиторы ФНО, развилось поражение кожи[14]. Сообщалось также о развитии демиелинизирующей и периферической нейропатии при применении анти-ФНО-препаратов[15].
Проспективное когортное исследование, проведенное в Северной Америке и включавшее 6000 больных БК, показало, что ИФМ не ассоциируется с тяжелыми инфекционными осложнениями[16]. Кроме того, согласно проспективному обсервационному исследованию, монотерапия ИФМ не имеет статистически значимой связи с развитием злокачественных новообразований[17]. Однако применение ИФМ в комбинации с тиопуринами является фактором риска развития неходжкинской лимфомы[18] и гепатоспленической лимфомы[19].
Отмечены более частые, по сравнению с плацебо, случаи воспалительных реакций в месте инъекции и лейкоцитопении при лечении АДБ[20].
ИНГИБИТОРЫ ИНТЕРЛЕЙКИНОВ 12 И 23
IL-12 и IL-23 являются гетеродимерными провоспалительными цитокинами, участвующими в формировании воспаления в слизистой оболочке кишечника при БК[21].
Каждый из этих цитокинов состоит из двух субъединиц — р35/р40 (IL-12) и р19/р40 (IL-23). Наличие у IL-12 и IL-23 общей субъединицы р40 позволяло предположить, что ее блокада приведет к эффективному подавлению воспалительного процесса в слизистой оболочке кишечника. Это нашло подтверждение в экспериментальной модели[22] и послужило рациональным основанием для создания устекинумаба — препарата моноклональных антител к р40-субъединице IL-12 и IL-23 (см. табл).
В исследовании IM-UNITI устекинумаб показал свою эффективность в качестве поддерживающей терапии. Различия в частоте побочных эффектов в группах устекинумаба и плацебо отсутствовали[23].
В обсервационном исследовании почти две трети пациентов с БК, резистентной к анти-ФНО-терапии, на фоне лечения устекинумабом в течение около года достигли бесстероидной ремиссии[24].
В 2016 г. устекинумаб был одобрен для лечения БК в Европе и США [23]. В настоящее время проводится РКИ III фазы UNIFI, в котором изучаются безопасность и эффективность индукционной и поддерживающей терапии устекинумабом у пациентов с умеренно активным ЯК (NCT02407236).
БЛОКАТОРЫ ТРАФИКА ЛЕЙКОЦИТОВ
С целью блокады трафика (активация, адгезия, миграция и инфильтрация) лейкоцитов из крови в воспалительный очаг в слизистой оболочке кишечника разработаны моноклональные антитела, получившие название антиинтегринов, или антиадгезивных препаратов. Они блокируют действия интегринов — молекул межклеточной адгезии, которые присутствуют на поверхности лейкоцитов и обеспечивают их адгезию и трансэндотелиальную миграцию. Соответственно, блокада интегринов избирательно предотвращает миграцию лейкоцитов и инфильтрацию ими очага воспаления[25].
Натализумаб
Натализумаб является рекомбинантным гуманизированным моноклональным антителом IgG4, направленным против субъединицы α4 в интегринах α4β7 и α4β1 лейкоцитов. Блокада этих интегринов предотвращает миграцию лимфоцитов в большинство тканей, включая кишечник, кожу и головной мозг.
Натализумаб был первым антиадгезивным средством, одобренным в США для лечения БК средней тяжести при резистентности или непереносимости ингибиторов ФНО. Кокрановский систематический обзор с метаанализом, проведенный в 2018 г., подтвердил, что натализумаб превосходит плацебо в индукции ремиссии у больных БК[25].
Однако из-за ингибирования миграции лейкоцитов в центральной нервной системе натализумаб в редких случаях способствовал реактивации вируса Джона Каннингема (JCV) в головном мозге и развитию прогрессирующей многоочаговой лейкоэнцефалопатии[25].
В связи с этим в настоящее время применение натализумаба одобрено только в США и Швейцарии, где он может использоваться при отсутствии инфекции JCV для краткосрочного (до 2 лет) лечения с мониторингом антител к JCV[25].
Ведолизумаб
Ведолизумаб (см. табл) — это гуманизированное моноклональное антитело IgGl, которое избирательно блокирует интегрин α4β7. Его воздействие направлено в основном на лейкоциты в стенке кишечника, он не проникает через гематоэнцефалический барьер и не вызывает прогрессирующую многоочаговую лейкоэнцефалопатию.
Ведолизумаб одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (англ. Food and Drug Administration) и Европейским агентством по лекарственным средствам (англ. European Medicines Agency) для лечения ЯК и БК средней тяжести [26]. Его эффективность подтверждена в РКИ III фазы GEMINI. При применении ведолизумаба, в сравнении
с плацебо, статистически значимо чаще достигались клинический ответ на 6-й неделе лечения (39,2% против 22,3%; р = 0,001) и клиническая ремиссия на 10-й неделе (26,6% против 12,1%; р = 0,001). Побочные эффекты в группах были одинаковыми[27].
Данные недавних систематических обзоров, метаанализов и постмаркетинговых исследований показали, что ведолизумаб является безопасным средством для лечения пациентов с тяжелыми и средней тяжести формами БК и ЯК, включая больных, не поддающихся анти-ФНО-терапии[28, 29]. Однако его эффект проявляется лишь через 10 и более недель лечения.
ИНГИБИТОРЫ ЯНУС-КИНАЗ
Янус-киназы (JAK) относятся к классу нерецепторных тирозинкиназ, которые экспрессируются в иммунокомпетентных клетках, в том числе лейкоцитах. Их функция заключается в передаче сигналов от факторов роста и рецепторов цитокинов (IL-2, IL-6, IL-12, IL-21, IL-23 и др.), которые участвуют в поддержании воспаления в слизистой кишечника при ВЗК, внутрь клетки, что обеспечивает реализацию эффектов данных цитокинов[30]. Идея блокирования JAK с целью предотвращения патогенного действия этих цитокинов послужила рациональной основой для создания ингибиторов JAK.
Тофацитиниб
Среди ингибиторов JAK к настоящему времени наиболее многообещающие клинические результаты при ВЗК, в основном при ЯК, продемонстрированы первым ингибитором JAK — тофацитинибом (см. табл).
В РКИ II фазы участвовали пациенты с активным тяжелым или средней тяжести ЯК. Из них 598 и 541 человек до этого не отвечали на стандартное лечение (OCTAVE 1) и на анти-ФНО-терапию (OCTAVE 2) соответственно[31]. В каждом из этих двух субисследований пациенты были рандомизированы на группы индукционной терапии тофацитинибом и плацебо в течение 8 недель. В обоих субисследованиях в группах тофацитиниба к 8-й неделе лечения частота клинических ремиссий была статистически значимо выше, чем в группах плацебо (18,5% и 8,2% соответственно, p = 0,007). В исследовании OCTAVE Sustain была показана эффективность поддерживающей терапии тофацитинибом при сравнении с плацебо[31].
Во всех трех исследованиях OCTAVE лечение тофацитинибом сопровождалось повышением уровней липидов крови. В РКИ OCTAVE 1 и 2 инфекционная заболеваемость была выше при лечении тофацитинибом, чем в группах плацебо[31].
Основываясь на результатах серии РКИ OCTAVE, в августе 2018 г. Европейская комиссия одобрила тофацитиниб (Xeljanz, Pfizer) для лечения ЯК средней тяжести у взрослых пациентов, не отвечающих либо не переносящих традиционную терапию или биологические препараты[32].
Следует заметить, что тофацитиниб стал первым пероральным препаратом, предназначенным для долгосрочного применения при ЯК.
В отличие от результатов лечения ЯК, результаты применения тофацитиниба при БК оказались разочаровывающими. В нескольких РКИ после лечения больных БК не было никаких различий в частоте клинического ответа в группах тофацитиниба и плацебо[33]. Последующие клинические испытания по изучению эффективности и безопасности тофацитиниба при БК были прекращены.
ПОДХОДЫ К ЛЕЧЕНИЮ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ КИШЕЧНИКА У ДЕТЕЙ
Лечение ВЗК у детей основано на комплексном подходе, подборе наиболее эффективной тактики: консервативной или хирургической — и нацелено на достижение и поддержание бесстероидной ремиссии, предотвращение прогрессирования заболевания, профилактику ранних и поздних осложнений, в том числе злокачественного перерождения, улучшение качества жизни пациентов и их социализацию.
Выбор консервативного или хирургического лечения определяется тяжестью атаки, протяженностью поражения, наличием внекишечных проявлений, временем от дебюта заболевания до верификации диагноза, эффективностью и наличием осложнений при ранее проведенном лечении, а также риском развития осложнений[34].
Важным является взаимодействие специалистов различного педиатрического профиля: гастроэнтерологов, хирургов, ревматологов, дерматологов, иммунологов, психологов, диетологов.
Пероральные и ректальные препараты 5-аминосалициловой кислоты
Согласно клиническим рекомендациям Союза педиатров России пероральное применение препаратов 5-аминосалициловой кислоты (5-АСК) является терапией первой линии для индукции и поддержания ремиссии у детей с ЯК при легкой и среднетяжелой активности воспалительного процесса. Доза перорального месалазина должна составлять от 60 до 80 мг/кг/сут (не > 4,8 г/сут); сульфасалазина — от 70 до 100 мг/кг/сут (максимальная доза — 4 г/сут). Ректальные препараты 5-АСК назначаются в дозе 25 мг/кг (до 1 г/сут)[35].
Рекомендована комбинация пероральных и местных препаратов 5-АСК, так как она более эффективна, чем применение каждого препарата в отдельности[35, 36]. Важно использовать адекватные дозы препаратов 5-АСК при индукции и поддержании ремиссии ЯК.
Обострение колита может имитироваться острой непереносимостью салазопрепаратов. Улучшение самочувствия после отмены 5-АСК и появление симптомов после ее повторного назначения позволяют верифицировать причину состояния и являются противопоказанием к назначению любых препаратов, содержащих 5-АСК.
При отсутствии ответа на прием салазопрепаратов в течение 2 недель рекомендовано применение альтернативного лечения — подключение местной терапии или назначение пероральных ГКС[35].
Системные глюкокортикостероиды
ГКС рекомендовано использовать для индукции ремиссии ВЗК, но не для ее поддержания, ввиду развития осложнений и гормональной резистентности[37].
Пероральные ГКС целесообразно применять при среднетяжелой атаке с системными проявлениями и у отдельных пациентов детского возраста с тяжелой атакой без системных проявлений или у пациентов, не достигших ремиссии на фоне терапии адекватной дозой 5-АСК. При тяжелой атаке проводится внутривенная терапия ГКС[35].
Доза перорального преднизолона — 1–2 мг/кг/сут с ее постепенным снижением и отменой к 12-й неделе (рис.), доза для внутреннего введения при тяжелой атаке — до 3–5 мг/кг/сут. Применение ГКС обеспечивает значительное подавление воспаления и быстрое исчезновение симптомов[35].
Рис. Схема снижения дозы глюкокортикостероидов у детей с язвенным колитом в зависимости от индукционной дозы[35]
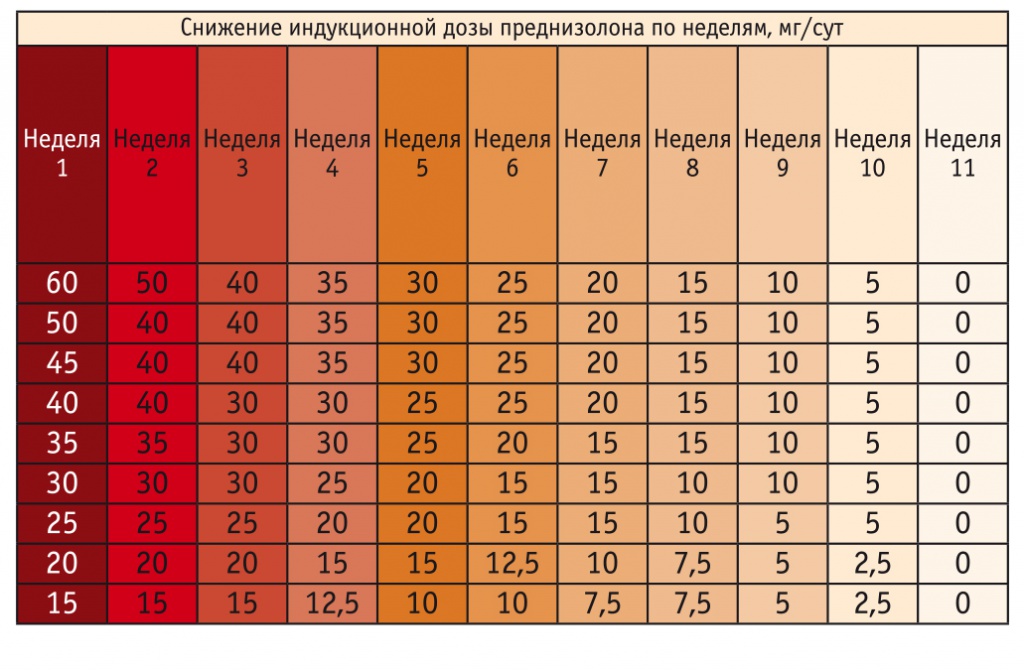
Однако системные побочные эффекты ГКС часто осложняют ведение больных, что приводит к досрочной отмене препаратов и/или к самостоятельному прекращению лечения больными. Удлинение курса гормональной терапии не приносит пользы[38].
Топические глюкокортикостероиды
В отличие от классических ГКС, только около 10% будесонида достигают системного кровотока. В связи с этим для него в меньшей степени характерны побочные эффекты стероидной терапии[38].
Согласно рекомендациям Европейской организации по изучению язвенного колита и болезни Крона (англ. European Crohn´s and Colitis Organisation) 2017 г., применение будесонида возможно при БК илеоцекальной локализации при легкой и среднетяжелой атаке[38]. Дозирование будесонида: 8 недель — 9 мг/сут, 2 недели — 6 мг/сут, 2 недели — 3 мг/сут, далее отмена. Средняя продолжительность терапии — 12 недель.
Иммуносупрессоры
Назначение тиопуринов обосновано для поддержания ремиссии у детей с непереносимостью препаратов 5-АСК и/или с часто рецидивирующим ВЗК (2–3 обострения в год), а также с развитием гормонозависимой формы заболевания на фоне проведения терапии 5-АСК в максимальных дозах[35, 39].
Терапевтический эффект тиопуринов достигается через 10–14 недель от начала лечения. Доза может корректироваться приблизительно до 2,5 мг/кг для азатиоприна или 1–1,5 мг/кг для 6-меркаптопурина и приниматься однократно.
Метотрексат угнетает дигидрофолатредуктазу и синтез ДНК, подавляет активность IL-1 и пролиферацию Т-лимфоцитов. Применение метотрексата при ЯК у детей в настоящее время не рекомендуется[35, 36].
Действие иммуносупрессоров развивается медленно (через 2–3 месяца от начала терапии), поэтому данные препараты более пригодны для поддержания ремиссии[36].
Биологические препараты
В настоящее время у детей рекомендовано назначать ИФМ в качестве препарата первой линии биологической терапии ЯК и БК[35, 40].
Учитывая потенциальное благоприятное действие и высокую безопасность 5-АСК, представляется рациональным комбинированное применение 5-АСК и биологических препаратов.
Показано, что ИФМ эффективен в индукции клинической ремиссии, обеспечивает заживление слизистой оболочки и снижает потребность в проведении колэктомии у детей с активным ЯК, не ответивших на стандартную терапию[41].
Согласно данным проведенного у детей РКИ Т-72, через 8 недель применения ИФМ 73% больных ЯК ответили на лечение и 40% достигли клинической ремиссии, у 68% пациентов отмечалось заживление слизистой оболочки по данным эндоскопического исследования. При продолжении терапии в течение года в режиме регулярных инфузий по 5 мг/кг каждые 8 недель стойкая клиническая ремиссия без применения ГКС наблюдалась практически у 40% пациентов[35, 42, 43].
Метаанализ исследований о применении ИФМ у детей с ЯК показал, что накопленная долгосрочная эффективность ИФМ при остром тяжелом колите составляет 64%[44]. Избежать колэктомии в течение 2 лет удалось у 61% больных.
ИФМ рекомендовано назначать при гормонорезистентной форме ЯК. Если ИФМ был назначен при острой атаке у пациента, ранее не получавшего тиопурины, биологическая терапия может использоваться как вспомогательная для перехода на применение тиопуринов. В этом случае терапию ИФМ можно прекратить спустя приблизительно 4–8 месяцев[42].
АДБ рекомендовано применять только у пациентов с потерей ответа на ИФМ или с его непереносимостью[35, 36]. Терапию АДБ показано проводить по схеме: индукционная доза на 0-й и 2-й неделе — 120 мг и 80 мг соответственно при массе тела ≥ 40 кг или 80 мг и 40 мг соответственно при массе тела менее 40 кг; затем поддерживающая терапия по 40 мг 1 раз в 2 недели. Препарат вводится подкожно. Может потребоваться индивидуальный подбор дозы[35, 36].
В настоящее время зарегистрированы биосимиляры (биоаналоги) анти-ФНО-препаратов, которые эквивалентны им по строению и схожи с ними по эффективности, однако возможность перехода с оригинальных препаратов на биоаналоги или обратно на сегодняшний день не доказана [45].
ЗАКЛЮЧЕНИЕ
Подробный анализ литературы позволяет сделать вывод о положительных сдвигах в терапии воспалительных заболеваний кишечника (ВЗК). Можно отметить развившийся в кратчайшие сроки тренд перехода от неселективного лечения (глюкокортикостероиды и препараты 5-аминосалициловой кислоты) к таргетной терапии: ингибиторам фактора некроза опухоли (ФНО) и ведолизумабу. Более того, многие новые биологические препараты в фазе разработки и тестирования показывают обнадеживающие результаты.
Другая многообещающая тенденция — выход на рынок биосимиляров анти-ФНО-препаратов, которые продемонстрировали эквивалентную эффективность в лечении ВЗК, однако дальнейшие исследования должны подтвердить возможность замены оригинальных средств.
При всех положительных результатах биологические препараты неидеальны: необходимо решить проблему развития вторичной резистентности к терапии, проблему реактивации вторичных инфекций, таких как туберкулез и гепатит В.
Вопрос терапии ВЗК особенно остро стоит в педиатрии, так как у детей эти заболевания протекают намного тяжелее, сопряжены с отставанием в росте и развитии и с более высоким риском злокачественных новообразований кишечника. В связи с этим необходимо с самого начала определиться с тактикой терапии и назначить наиболее эффективный препарат с минимальным количеством побочных эффектов.








