Колоректальный рак (КРР) стабильно занимает третье место в структуре заболеваемости злокачест венными новообразованиями. По данным ВОЗ, за 2018 г. общее количество вновь выявленных случаев КРР во всем мире составило 1,85 млн, это 10,2% от всех впервые диагностированных злокачественных опухолей[1]. В структуре смертности от новообразований различной локализации смертность от КРР занимает второе место (880 792 человека), уступая только таковой от рака легкого (1 761 007 человек)[1]. По предварительным прогнозам ВОЗ, к 2030 г. заболеваемость КРР превысит 2,2 млн в год, а смертность возрастет до 1,1 млн в год[2]. Более того, отмечается тенденция к увеличению заболеваемости КРР среди лиц моложе 45 лет [1].
Статистический анализ эпидемиологических данных за 2000–2012 гг. выявил, что показатели заболеваемости и смертности от КРР неоднородны и варьируют в странах с высоким и низким индексом человеческого развития (ИЧР)[3]. С учетом этих данных было произведено разделение стран на три группы: в первой группе наблюдается тенденция к росту одновременно и заболеваемости, и смертности; во второй — рост заболеваемости, но уменьшение смертности; в третьей группе — уменьшение заболеваемости и смертности от КРР[3].
В последнюю группу вошли страны с высоким ИЧР — США, Австрия, Новая Зеландия, Чехия, Франция, Исландия, Япония, Австралия и Израиль. Положительная динамика в этих странах объясняется внедрением национальных скрининговых программ по КРР и наличием широкого доступа к высокотехнологичному лечению[3].
Российская Федерация была отнесена к первой группе. За период с 2000 по 2010 г. среднегодовой темп прироста заболеваемости КРР в России составил 1,2% среди мужчин и 1,1% среди женщин, в то же время наблюдается ежегодное уменьшение смертности на 0,2% среди женщин и увеличение смертности на 0,2% среди мужчин[3].
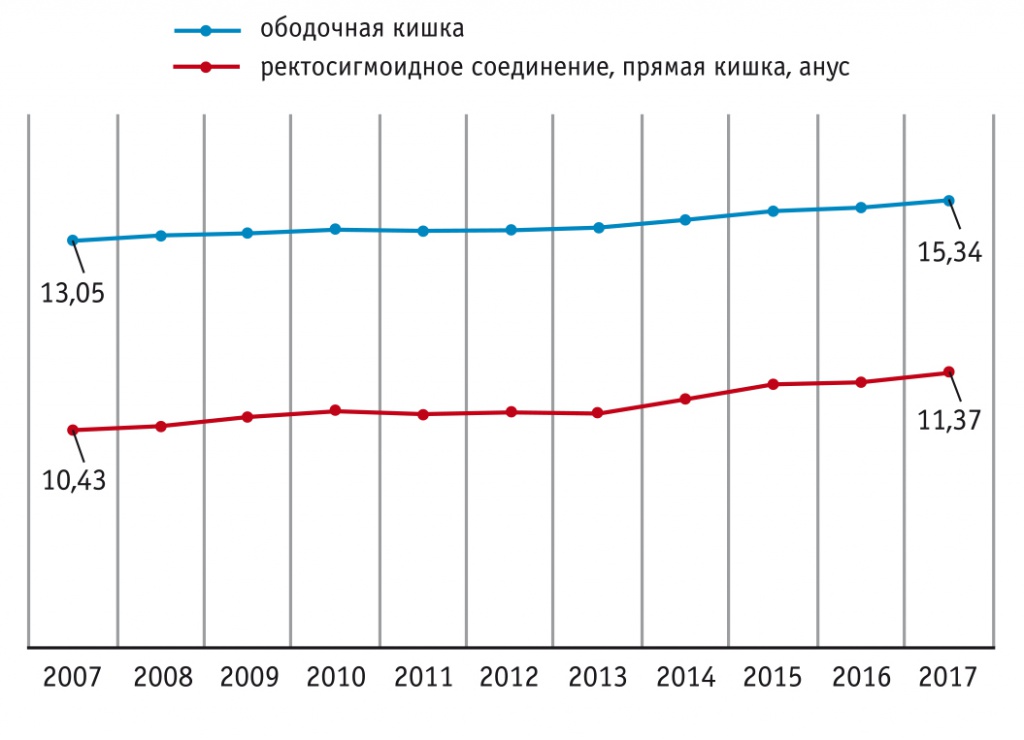
По эпидемиологическим данным, прирост заболеваемости населения России раком ободочной кишки (на 100 000 населения) в 2007–2017 гг. составил 15,95%, раком ректосигмоидного соединения, прямой кишки, ануса — 9,1% (рис. 1)[4]. Смертность от рака ободочной кишки в течение года в 2007 г. составляла 32,1%, в 2017 г. — 23,7%, а от рака ректосигмоидного отдела, прямой кишки и ануса — 27,8% и 24% в 2007 и 2017 гг. соответственно[4].
Рис. 1. Динамика заболеваемости населения России колоректальным раком в 2007–2017 гг. Оба пола (стандартизированные показатели на 100 000 населения, мировой стандарт)[4]
Выявление КРР всех стадий наиболее распространено в возрастной группе старше 60 лет, однако наблюдается тенденция к увеличению заболеваемости среди лиц в возрасте 30–44 лет. По данным 2012 г., в мире в возрастных группах 30–34 лет, 35–39 лет и 40–44 лет заболеваемость составила 4,52%, 5,63% и 6,32% соответственно, а в 2015 г. — 5,02%, 5,85% и 6,73%[2].
Таким образом, как в Российской Федерации, так и в мире наблюдаются общее увеличение заболеваемости КРР и его «омоложение» с вовлечением трудоспособного населения в возрасте старше 40 лет. При этом в странах с высоким ИЧР происходит замедление роста смертности от КРР, чего нельзя сказать о России. Увеличение заболеваемости КРР не только приводит к усилению нагрузки на медицинское сообщество, но и негативно сказывается на экономике страны. По приблизительным оценкам, в России в 2012 г. экономический ущерб от потерь здоровья больными злокачественными новообразованиями составил около 5 млрд долларов, или 0,25% от ВВП, а больными КРР — около 0,4 млрд долларов [5].
Цель обзора: освещение мирового опыта профилактики колоректального рака, анализ результатов опроса среди врачей — участников образовательной программы Quality of Colonoscopy (QuaCol) в России в 2016–2017 гг.
ПЕРВИЧНАЯ ПРОФИЛАКТИКА КОЛОРЕКТАЛЬНОГО РАКА
Преимущественный вклад в увеличение заболеваемости КРР вносят факторы риска, связанные с образом жизни; генетическая предрасположенность играет меньшую роль (около 30% случаев КРР относят к генетически детерминированным)[6]. Это подтверждается данными нескольких эпидемиологических обсервационных исследований. Показано, что КРР наиболее распространен в странах с «западным образом жизни» (низкое содержание пищевых волокон в пище, преимущественно рафинированные продукты, высокий процент потребления красного мяса)[7]. Более того, некоторые страны с изначально низкой заболеваемостью КРР (Вьетнам, Индия) отметили ее подъем после экономического роста и адаптации к «западному образу жизни»[7].
Первичная профилактика КРР направлена на предотвращение заболевания путем устранения модифицируемых факторов риска. К ним относят потребление пищи, бедной пищевыми волокнами и балластными веществами, сидячий образ жизни, чрезмерное употребление рафинированных жиров и красного мяса, курение, злоупотребление алкоголем, ожирение[8].
Питание, богатое пищевыми волокнами (с высоким содержанием овощей и фруктов), является наиболее изученным протективным фактором в отношении развития КРР, оно характеризуется снижением заболеваемости приблизительно на 40%[9]. Однако роль этого фактора в предупреждении КРР разной локализации неодинакова: он наиболее эффективен при профилактике проксимального КРР и практически не изменяет заболеваемость раком ануса. С другой стороны, употребление большого количества красного мяса и рафинированных жиров ассоциировано с более высоким риском развития КРР[9].
В нескольких исследованиях показано, что увеличение ИМТ на каждые 5 кг/м2 повышает риск развития КРР на 24% у мужчин и на 9% у женщин[11]. Высокий ИМТ не только ассоциирован с высоким риском заболевания КРР, но и ухудшает прогноз выживания[10].
Курение увеличивает риск развития КРР в 2 раза и ассоциировано с худшим прогнозом выживания[8].
Данные по влиянию употребления алкоголя на заболеваемость и смертность от КРР у разных авторов различаются. Прирост заболеваемости КРР (как дистальной, так и проксимальной локализации) доказанно связан только с чрезмерным (более 23 г/сут) употреблением алкоголя, умеренное и незначительное его употребление не было ассоциировано с повышением заболеваемости[12].
Идея химиопрофилактики КРР длительно обсуждалась в научном сообществе, особенно после сообщений об уменьшении смертности от проксимального КРР на 70% при длительном (более 5 лет) употреблении ацетилсалициловой кислоты (АСК)[13]. Однако АСК имеет ряд побочных эффектов, что ограничивает ее широкое использование для предупреждения КРР. На данный момент только Американская специальная комиссия по профилактике (англ. U.S. Preventive Services Task Force) рекомендует употребление АСК для профилактики развития КРР с уровнем доказательности В[14]. При этом пациенты должны соответствовать следующим критериям: возраст — 50–59 лет; высокий (≥ 10%) риск развития сердечно-сосудистых осложнений; низкий риск кровотечений; ожидаемая продолжительность жизни не менее 10 лет; добровольное изъявление желания ежедневно принимать АСК на протяжении как минимум 10 лет[14]. Европейские рекомендации, в частности рекомендации Британский национальный институт здравоохранения и клинического совершенства (англ. National Institute of Health and Clinical Excellence, Великобритания), не предусматривают употребление АСК для первичной профилактики КРР, за исключением синдрома Линча c уровнем доказательности 2B[15].
Протективные эффекты других препаратов (статины, бисфосфонаты, метформин) также были изучены, однако однозначного заключения об их эффективности на данный момент нет.
Осведомление населения о факторах риска развития КРР, пропаганда здорового образа жизни и более жесткие меры со стороны государства по ограничению распространения алкоголя и табачных изделий могут снизить заболеваемость КРР в долгосрочной перспективе.
СКРИНИНГ КОЛОРЕКТАЛЬНОГО РАКА
Скрининг — это комплекс медицинских исследований (лабораторных, инструментальных) по выявлению заболевания или его прекурсора в бессимптомной популяции. Основной целью скрининга является снижение заболеваемости и смертности от того или иного заболевания в популяции с повышенным риском.
В различных метаанализах и систематических обзорах обсуждается роль скрининговых программ в профилактике заболевания и смерти от КРР. В части исследований показано, что скрининг КРР снижает как заболеваемость, так и смертность от злокачественных новообразований. Однако авторы большинства работ склоняются к тому, что скрининговые программы могут снижать смертность, но не заболеваемость КРР[16].
Скрининг может проводиться по требованию (обследуемого или врача) или быть частью национальной программы (оппортунистический и популяционный скрининг соответственно). В России на данный момент имеется только оппортунистический скрининг КРР, более того, нет единых рекомендаций по алгоритмам проведения диагностических исследований (колоноскопия, ректороманоскопия, виртуальная колоноскопия, фекальные тесты).
Популяционные скрининговые программы по КРР введены во многих странах Европы (Финляндия, Франция, Словения, Великобритания и др.), в США, Японии и Южной Корее.
В данных странах предпринимаются попытки оптимизировать процесс скрининга посредством введения шкал для выявления групп с высоким риском развития КРР. Например, в США для определения высокого риска развития КРР наиболее часто используются тест Национального института онкологии (англ. National Cancer Institute) и Кливлендский клинический тест[17]. Однако они не показали своих преимуществ в рандомизированных клинических исследованиях (РКИ)[17]. В Европе и Азии большинство стран проводят скрининг в популяциях в возрасте старше 40–50 лет со средним риском развития КРР.
На данный момент существуют как инвазивные методы скрининга (колоноскопия, ректороманоскопия), так и неинвазивные (анализы кала и крови, лучевые методы исследования). Чаще всего применяются анализы кала на скрытую кровь: gFOBT и FIT.
gFOBT, или гваяковый тест на скрытую кровь (англ. guaiac fecal occult blood test), основан на выявлении в кале пероксидазной активности гема. Метод является одним из самых изученных, используется с 1970-х гг., применяется для скрининга во многих странах Европы (Хорватия, Португалия, Финляндия и др.). К преимуществам теста относятся низкая стоимость и простота выполнения. Для повышения эффективности gFOBT разработаны его высокочувствительные модификации — Hemoccult Sensa и Hemoccult ICT, — позволяющие обнаруживать более низкие концентрации гемоглобина. Чувствительность разных тестов gFOBT по результатам различных РКИ варьирует в диапазоне 31–63%, а специфичность — 92–96%[18].
По результатам Кокрановского систематического обзора четырех РКИ, в которых изучалось влияние Hemoccult II gFOBT на заболеваемость и смертность от КРР (Фюнен, Голландия; Гётеборг, Швеция; Ноттингем, Великобритания, и Миннесотское исследование, США; общее количество пациентов — 320 000 человек), скрининг снижает смертность от КРР на 16%, но не влияет на заболеваемость КРР[19]. Только в Миннесотском исследовании заболеваемость КРР снижалась на 20% при ежегодном скрининге с помощью gFOBT и на 17% при скрининге один раз в два года[20].
Наряду с перечисленными преимуществами gFOBT обладает достаточно низкой специфичностью: 1) тест определяет как человеческий, так и животный гемоглобин; 2) в свежих фруктах и овощах содержится пероксидаза, которая приводит к ложноположительному результату. Более того, высокое содержание витамина С в кале ингибирует пероксидазу, что обусловливает ложноотрицательный результат. Во избежание таких ошибок перед сдачей кала на gFOBT необходимо исключение из рациона красного мяса и свежих овощей, это является одним из недостатков теста. Другой немаловажный недостаток gFOBT — необходимость забора образцов кала как минимум из трех дефекаций.
В отличие от gFOBT, фекальные иммунохимические тесты, или FIT, обнаруживают только человеческий гемоглобин с помощью моноклональных антител. Соответственно, перед проведением FIT нет диетических ограничений и достаточно однократного забора образца, что повышает комплаенс пациентов. В РКИ, выполненном R.M. Hoffman и соавт., FIT обеспечил более высокую приверженность скринингу, чем gFOBT (61,4% и 50,5% соответственно)[21].
На данный момент имеются только ретроспективные РКИ по сравнению скрининга КРР с помощью FIT, с одной стороны, и отсутствия скрининга — с другой. Однако в исследованиях с применением Hemoccult II gFOBT и FIT последний показал более высокую чувствительность при выявлении дисплазии высокой степени и крупных аденом (61–91%), полипов размером более 1 см (67%)[16]. В проспективном исследовании J.A. Shapiro и соавт., включавшем 1006 пациентов, при сравнении трех каловых тестов — HS-gFOBT Hemoccult II Sensa, InSure FIT и OC FIT-CHEK — чувствительность определения КРР составила 7,4%, 26,3% и 15,9% соответственно[22]. Таким образом, продемонстрировано значительное превосходство FIT над gFOBT по чувствительности. В 2017 г. Объединенной рабочей группой по колоректальному раку США (англ. U.S. Multi-Society Task Force on Colorectal Cancer) были представлены обновленные клинические рекомендации по скринингу КРР, где ежегодное проведение FIT рекомендовано как основной метод скрининга КРР в популяции со средним риском развития заболевания[23].
Существует два типа FIT: качественные и количественные. Качественные FIT имеют заданную пороговую концентрацию фекального гемоглобина, результатом их проведения является положительная или отрицательная проба без указания конкретной концентрации гемоглобина в кале. В отличие от них, в количественных FIT для измерения уровня фекального гемоглобина используются иммунотурбидиметрические методы, а пороговая концентрация фекального гемоглобина (точка разделения) может быть установлена конечным пользователем[18]. Последние более предпочтительны и удобны для популяционного скрининга. Выбор точки разделения влияет на чувствительность и специфичность количественных FIT. Так, при ее повышении происходит снижение чувствительности FIT с одновременным ростом специфичности. По данным нескольких РКИ, оптимальной точкой разделения является концентрация гемоглобина в кале ≤ 20 мг/г, при этом условии обеспечиваются достаточные уровни специфичности и чувствительности [18].
К недостаткам FIT можно отнести более высокую стоимость тестов в сравнении с gFOBT и снижение чувствительности метода при несоблюдении условий транспортировки образцов.
Относительно новыми неинвазивными тестами на КРР являются комбинация теста на фекальную ДНК и FIT (FIT-DNA), выпущенная под торговой маркой Cologuard (США), и анализ крови — Epi proColon.
FIT-DNA направлен на обнаружение ДНК раковых клеток в кале и определение статуса ее метилирования. В многоцентровом исследовании проведено сравнение Cologuard с FIT, последний показал более высокую чувствительность при обнаружении КРР (92,3% против 73,8%) и предраковых заболеваний (42,4% против 23,8%)[24]. Специфичность FIT-DNA была в среднем на 10% ниже, чем при обычном FIT[24]. К недостаткам Cologuard можно отнести высокую стоимость и сложную процедуру забора материала.
В апреле 2016 г. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (англ. Food and Drug Administration) одобрило первый анализ крови, предназначенный для скрининга КРР, — Epi proColon (mSeptin9). Это количественный тест, основанный на реакции ПЦР, посредством которой определяются гиперметилированные участки Septin9 ДНК. Наличие метилированных участков ассоциировано с развитием КРР. В проспективном мультицентровом исследовании для Epi proColon показана такая же чувствительность при обнаружении КРР, что и для FIT, тогда как специфичность анализа крови была ниже на 16%[25]. Однако чувствительность Epi proColon прогрессивно уменьшалась при распознании КРР I стадии (35%) и аденом с высокой степенью гиперплазии (10%)[26]. Таким образом, Epi proColon не превосходит FIT по чувствительности в отношении ранних форм рака. Тем не менее он может занять нишу в скрининге среди лиц со средним риском развития КРР, которые предпочитают сдачу анализов крови анализам кала, тем самым обеспечив больший охват популяции[27].
Колоноскопия является «золотым стандартом» скрининга КРР с высокой чувствительностью и специфичностью. В настоящее время на стадии завершения находятся несколько крупных РКИ по сравнительному изучению эффективности колоноскопии в предотвращении случаев заболевания и смерти от КРР, окончательные результаты этих исследований будут известны к 2020 г. Среди них COLONPREV (Испания) и CONFIRM (США), где сравниваются колоноскопия и FIT, и NordICC (Европейский союз), где проводится сравнение между скринингом КРР с помощью колоноскопии и отсутствием скрининга в популяции.
Предварительные результаты РКИ NordICC были опубликованы в 2016 г. В числе основных итогов указано на отсутствие разницы между обнаружением полипов в проксимальном и дистальном отделах толстого кишечника, процент обнаружения аденом с высокой степенью гиперплазии равнялся 10,4[28]. Авторами отмечены два важных момента: 1) приверженность скринингу КРР с помощью колоноскопии в среднем составила 40%, что может снизить ее эффективность по сравнению с неинвазивными методами скрининга; 2) уровень обнаружения полипов напрямую зависел от качества выполненной колоноскопии.
Имеются данные нескольких проспективных обсервационных исследований и исследований «случай — контроль», в которых смертность от КРР в популяции прошедших скрининг с помощью колоноскопии снижалась в диапазоне 68–88%[29]. Однако показано, что колоноскопия уменьшает смертность от КРР преимущественно за счет раннего обнаружения дистальных неоплазий и практически не влияет на смертность от КРР проксимальных локализаций [29].
В 2015 г. общенациональные программы скрининга КРР уже действовали или находились в процессе развертывания в 24 странах Европейского союза. В частности, в Финляндии, Франции, Словении и Великобритании внедрение организованного скрининга было завершено. В Бельгии, Нидерландах, Дании, Ирландии, Италии, на Мальте, в Польше и Испании его развертывание продолжалось. В Норвегии, Португалии и Швеции внедрение скрининга КРР находилось на стадии пилотных проектов[30]. В США в 2015 г. охват скрининговой программой популяции со средним риском развития КРР составил 7%, из них 60% прошли скрининг инвазивными методами (колоноскопия или гибкая сигмоидоскопия)[30]. Что касается Азиатско-Тихоокеанского региона, то в Японии, например, программы скрининга действуют с 1992 г., в Австралии — с 2002 г., в Южной Корее — с 2004 г.[30].
На данный момент большинство стран Европейского союза и Южно-Азиатского региона внедрили или внедряют программы скрининга КРР в группе со средним риском, которые представлены двумя этапами: применением неинвазивного метода (FIT или gFOBT) и инвазивным исследованием (колоноскопия или гибкая сигмоидоскопия). В США действует оппортунистический скрининг и внедряется национальная скрининговая программа.
РЕЗУЛЬТАТЫ ОБРАЗОВАТЕЛЬНОЙ ПРОГРАММЫ QUALITY OF COLONOSCOPY (QUACOL)
Заболеваемость и смертность от КРР в России с каждым годом растут, однако на данный момент в стране не существует национальной скрининговой программы, которая, по данным исследований, значительно снижает смертность от данного заболевания. Для внедрения национальной скрининговой программы в России есть несколько лимитирующих факторов. Во-первых, в отсутствие единых клинических рекомендаций врачи-специалисты не имеют единого мнения относительно сроков проведения скрининга КРР, рекомендаций по подготовке к колоноскопии и параметров ее качества. Во-вторых, существуют проблемы с технической оснащенностью эндоскопических отделений и с квалификацией врачей-эндоскопистов.
Об отсутствии консенсуса по диагностике КРР среди специалистов в России впервые заговорили в 2014 г., когда в свет вышло мультицентровое исследование, выполненное в 14 медицинских учреждениях, выполняющих эндоскопическую диагностику. По данным этого исследования, достаточный уровень подготовки к колоноскопии был достигнут только в 77% обследований, двухэтапный «сплит»-режим был использован лишь в 25% случаев[31]. Слепую кишку интубировали в 86% процедур, а показатель обнаружения полипов составил всего 18% [31]. Данные результаты в целом не соответствовали рекомендациям Европейского объединения гастроэнтерологов (англ. United European Gastroenterology) и Европейского общества гастроинтестинальной эндоскопии (англ. European Society of Gastrointestinal Endoscopy, ESGE), но были сравнимы со средними показателями в Европейском союзе. Следует отметить также, что вариабельность результатов по центрам была достаточно значимой (рекомендованного уровня обнаружения аденом достигли только 45% центров). Исследование со всей очевидностью продемонстрировало необходимость обучения отечественных специалистов последним тенденциям в эндоскопии и гастроэнтерологии.
Опубликованный в 2015 г. анализ выявил недостаточные уровни использования эндоскопического оборудования в России и квалификации врачей-эндоскопистов[32].
Для внедрения скрининговой программы в первую очередь необходимо решение вышеназванных проблем. С этой целью в 2016 г. в России была запущена программа для врачей-гастроэнтерологов и эндоскопистов QuaCol, направленная на обучение специалистов и повышение качества выполняемых ими эндоскопических манипуляций. Эффективность образовательных программ доказана, в частности, на примере Великобритании, где уровень обнаружения аденом в начале 2000-х гг. был ниже 15%, а показатель интубации слепой кишки не достигал 80%, однако после проведения обучающих программ среди гастроэнтерологов на 2012 г. они составили 15% и 92% соответственно [33].
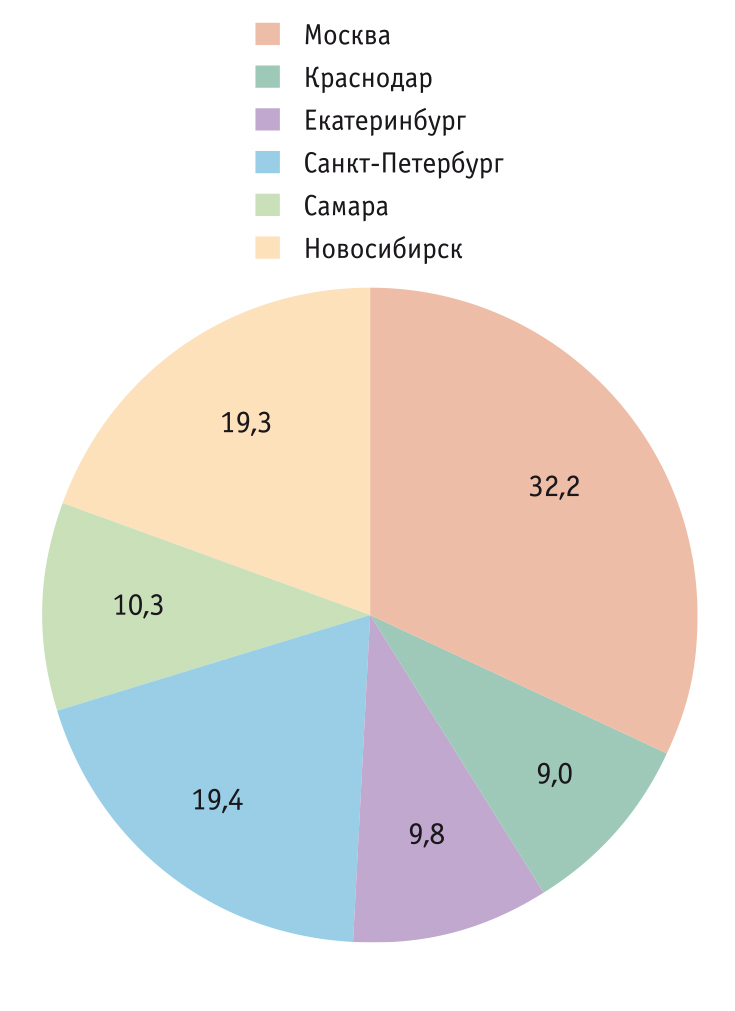
Участникам программы QuaCol 2016–2017 гг. перед каждым ее мероприятием предлагалось ответить на ряд вопросов, представлявших собой часть целостного опроса. Опрос завершили 1088 человек из 6 городов России (рис. 2). Бо́льшую часть аудитории составили эндоскописты (62–74% в различных городах), далее следовали гастроэнтерологи (5–18%) и хирурги (4–13%).
Рис 2. Распределение опрошенных участников программы QuaCol по городам России, %
Среди участников опроса наблюдался разброс мнений по поводу сроков начала проведения скрининга на КРР: 50% врачей отметили, что его необходимо начинать с 50 лет; 30% рекомендовали проведение первой колоноскопии пациентам в возрасте 30–40 лет; остальные ответили, что скрининг необходимо проводить с 60 лет. Между тем в большинстве стран мира возраст начала скрининга давно определен — 45–50 лет.
По результатам опроса подтвердилось предположение, что среди отечественных специалистов нет единого мнения об алгоритме подготовки пациента к исследованию, проведении самой процедуры и сроках наблюдения после колоноскопии.
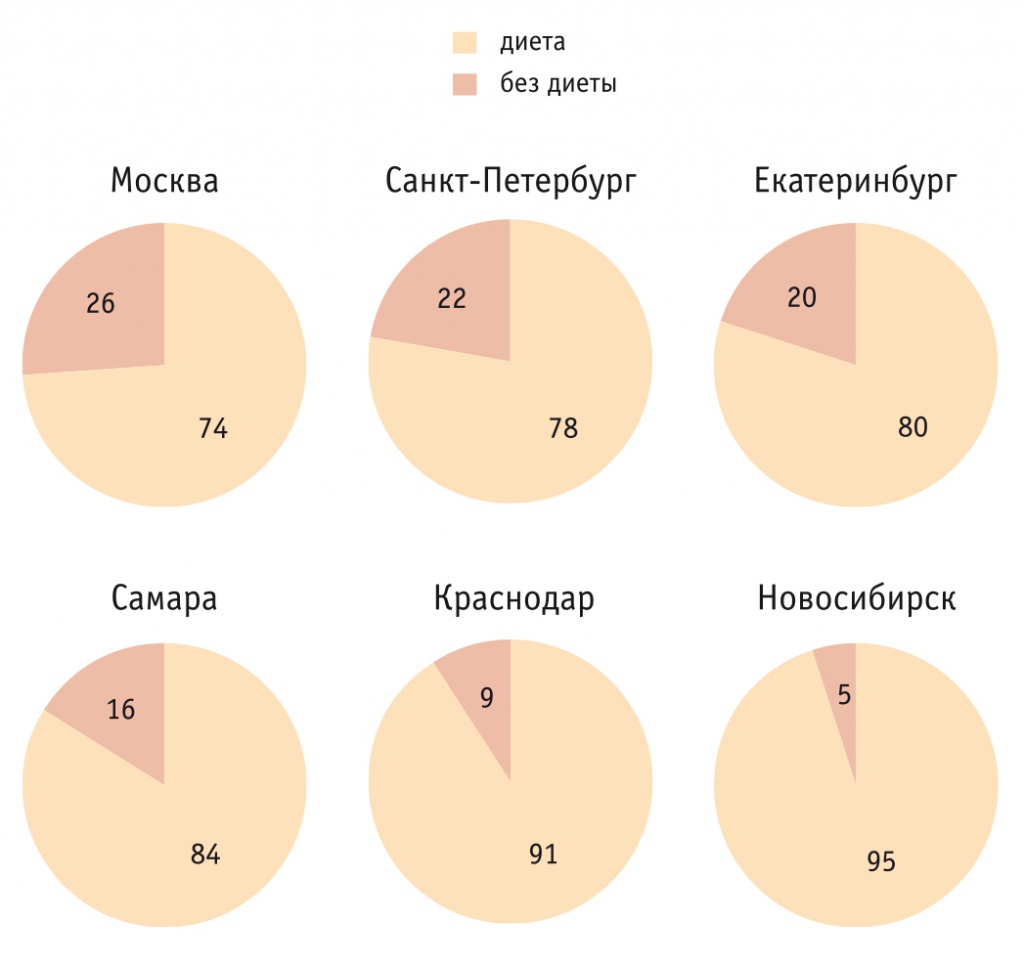
Более того, рекомендации по подготовке пациентов к колоноскопии варьировали среди врачей из различных регионов России (рис. 3). Настораживает, что 43,5% опрошенных рекомендовали своим пациентам «бесшлаковую» диету, определение которой, по сути, является псевдонаучным. В то же время на назначение диеты с низким содержанием пищевых волокон указали только 26% врачей, а жидкой диеты — 19%. По вопросу о режиме подготовки к исследованию также не было единого мнения. Большинство (приблизительно 70%) назначало двухэтапную «сплит»-схему; вечернюю схему (вся доза препарата накануне исследования) применяло порядка 27% врачей, а утреннюю схему (вся доза препарата утром в день исследования) — 4%.
Рис. 3. Рекомендации по подготовке к колоноскопии в разных городах России, %
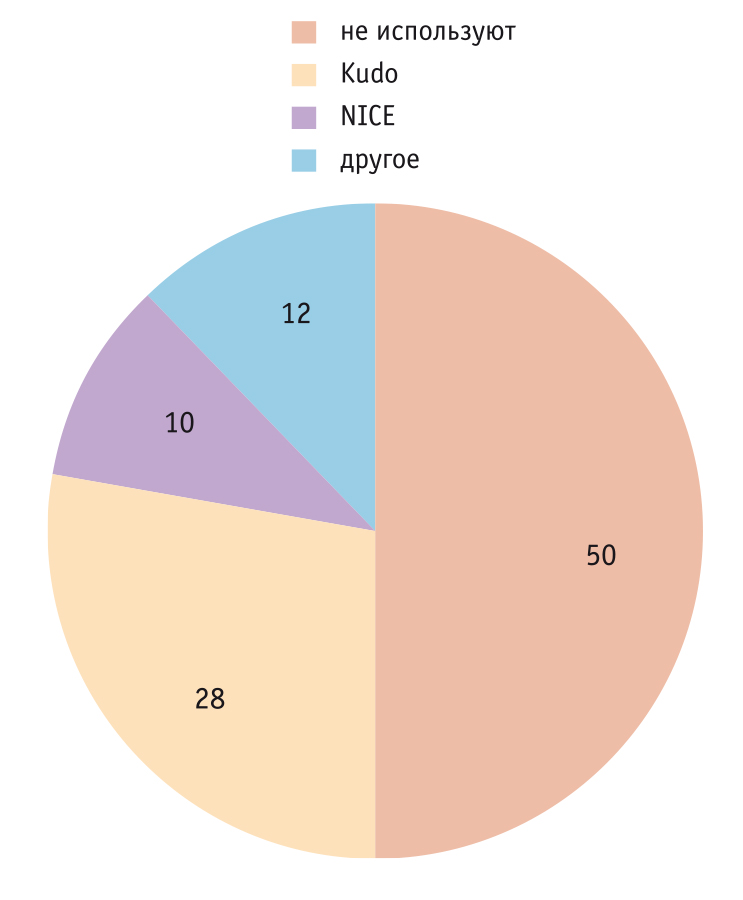
Помимо отсутствия единой тактики подготовки к колоноскопии, было выявлено, что большинство специалистов не оценивают качество подготовки к колоноскопии, а также макро- и микроскопические характеристики полипов. Так, только 18% опрошенных регулярно использовали в своей практике Бостонскую шкалу подготовки кишечника к колоноскопии; остальные либо вообще не указывали данную информацию в протоколе исследования, либо просто описывали качество подготовки как «удовлетворительное» или «неудовлетворительное». Оценка морфологии обнаруженных полипов выполнялась менее чем третью опрошенных, в частности, более половины врачей не оценивали ямочный рисунок при колоноскопии. Такой низкий показатель отчасти можно объяснить тем, что в большинстве эндоскопических отделений имеются фиброколоноскопы или колоноскопы без увеличения. Однако это обстоятельство не препятствует оценке макроскопических характеристик полипов по Парижской шкале, которая не была указана ни одним опрошенным эндоскопистом (рис. 4).
Рис. 4. Шкалы, используемые эндоскопистами для оценки морфологии обнаруженных полипов, %
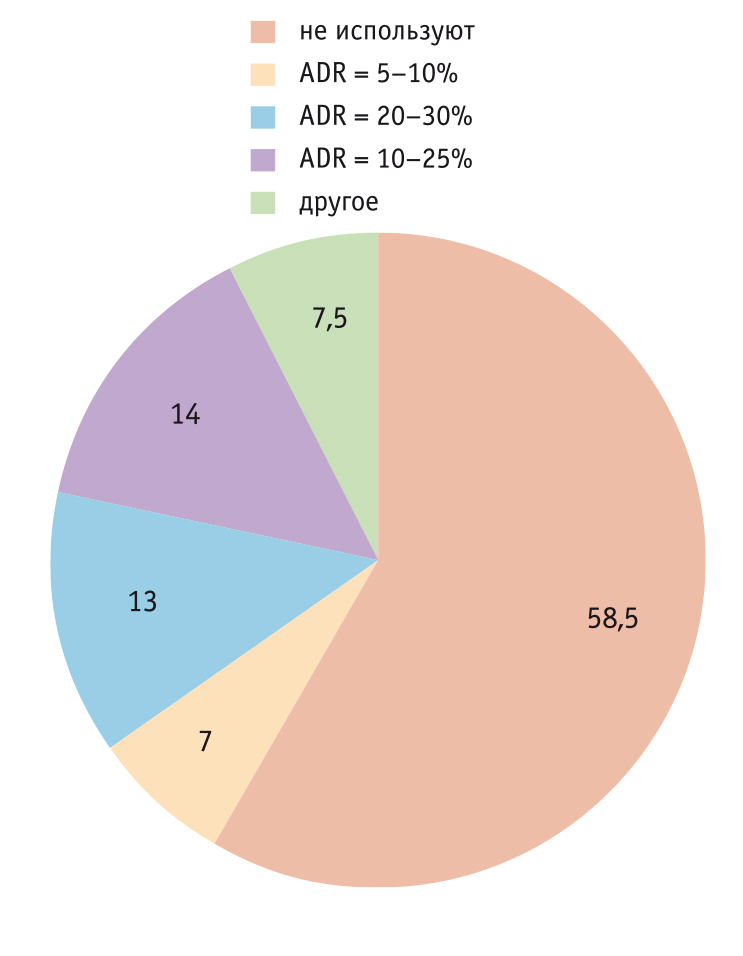
параметрам, рекомендованным ESGE, наиболее наглядным из них является показатель частоты выявления аденом (англ. adenoma detection rate, ADR). Большинство (58,5%) эндоскопистов сообщили, что не оценивают ADR в своей практике (рис. 5). Это подтвердило отсутствие единых стандартов диагностики КРР в России.
Рис. 5. Показатель частоты выявления аденом (ADR), выявленный у участников программы QuaCol 2016–2017 гг., %
С момента старта программы QuaCol по начало 2018 г. проведено 12 масштабных образовательных семинаров в крупнейших городах России (Санкт-Петербург, Москва, Самара, Краснодар, Екатеринбург, Новосибирск и др.), а также свыше 50 локальных конференций. В мероприятиях приняли участие более 6000 врачей различных специальностей, из них 1230 прошли очное обучение[34].
В 2016–2017 гг. были получены первые позитивные результаты реализации программы QuaCol. О положительной динамике можно косвенно судить по увеличению количества доброкачественных новообразований, удаленных через колоноскоп, так как единой системы определения показателей качества колоноскопии (например, ADR) в России нет. Так, в целом по стране с 2016 по 2017 г. количество полипэктомий выросло на 19,8% (с 54,995 до 65,895)[35]. В отдельных регионах данный показатель увеличился более чем на треть: в частности, в Санкт-Петербурге рост составил 32,8%, а в Новосибирской области — 31,0%[35].
В некоторых центрах, где был стандартизирован алгоритм подготовки пациентов с помощью двухэтапного «сплит»-режима, показатель качества подготовки толстого кишечника к колоноскопии достиг 97,7%, тогда как в 2015 г., до введения стандарта, он составлял в данных центрах 85%[36].
Наиболее показательным является внедрение рекомендаций ESGE в практику эндоскопического отделения ГБУЗ Ярославской области «Областная клиническая онкологическая больница».
В этом отделении был разработан стандартный алгоритм подготовки к колоноскопии в двухэтапном «сплит»-режиме с изданием подробной брошюры, содержащей доступные объяснения для пациентов. Проведены обучающие семинары для врачей общей практики, терапевтов, эндоскопистов г. Ярославля с разъяснением преимуществ назначения диеты с низким содержанием волокон и подготовки к колоноскопии в двухэтапном «сплит»-режиме. Помимо этого, была разработана карта осмотра пациента перед колоноскопическим исследованием для уменьшения рисков развития неблагоприятных исходов во время и после колоноскопии. Закуплено высококачественное оборудование для проведения колоноскопии. За последние 10 лет (2007–2017 гг.) в отделении практически в 4 раза (с 568 до 2221) увеличилось количество колоноскопий с седацией. Введена программа сбора информации с фоторегистрацией результатов колоноскопии по каждому сотруднику отделения, где фиксируются основные показатели ее качества: время вывода колоноскопа, процент достижения слепой кишки и ADR. Протокол этой программы закреплен в приказе Департамента здравоохранения и фармации Ярославской области № 1568 от 28.12.2017 «Об утверждении регламента обмена данными эндоскопических исследований», что является уникальным опытом для нашей страны[37].
В результате принятых мер показатель ADR в отделении вырос на 13,0% (с 24,6% в 2016 г. до 27,8% в 2017 г.), причем у некоторых врачей он увеличился более чем вдвое (с 9% до 20%)[37, 38].
ЗАКЛЮЧЕНИЕ
В условиях растущей заболеваемости колоректальным раком (КРР) и тенденции к его «омоложению» чрезвычайно важны создание национальной скрининговой системы и повышение качества проведения эндоскопических исследований, которые доказанно снижают заболеваемость КРР.
На данный момент главными препятствиями для создания национальной скрининговой системы в России являются малая осведомленность населения о КРР, низкий процент назначения теста на скрытую кровь врачами амбулаторного звена, недостаточная доступность высококачественной колоноскопии для населения и отсутствие единых национальных рекомендаций по ведению пациентов с подозрением на КРР.
В связи с отсутствием единых рекомендаций по проведению эндоскопических исследований среди врачей нет единого мнения о показателях качества колоноскопии, методике ее выполнения и последующем наблюдении за популяцией с высоким риском развития КРР. Таким образом, первоочередную задачу представляют разработка единых рекомендаций для специалистов и их обучение последним мировым тенденциям в сфере профилактики и диагностики КРР.
Образовательная программа QuaCol дала первые позитивные результаты: врачи стали более осведомлены о современных методиках эндоскопии, в некоторых эндоскопических центрах произошли кардинальные изменения. Это послужило основой для старта с февраля 2019 г. продолжения программы — QuaCol 2. Принимая во внимание опыт Великобритании, можно ожидать, что вовлечение в обучение большего количества врачей позволит улучшить качество колоноскопий и послужит фундаментом для разработки национальной скрининговой программы по КРР в России.








