Согласно медицинской статистике, более 90% заболеваний сопровождается болевым синдромом, поэтому НПВП и ненаркотические анальгетики относятся к наиболее востребованным лекарствам. НПВП — универсальные анальгетики, которые с успехом используются во всех областях медицины для борьбы с острой или хронической болью.
НПВП оказывают анальгетическое и противовоспалительное действие, что в сочетании с удобством применения и эффективностью сделало их незаменимым инструментом и для ургентной аналгезии в стоматологии, хирургии, гинекологии и ряде других областей медицины, и для длительного контроля симптомов при хронических заболеваниях опорно-двигательного аппарата[1].
Яркий представитель селективных ингибиторов ЦОГ-2 нимесулид применяется уже более 35 лет и является одним из наиболее широко используемых НПВП в целом более чем в 50 странах мира[2, 3].
ФАРМАКОКИНЕТИКА И ФАРМАКОДИНАМИКА
Основные ЦОГ-опосредованные механизмы действия нимесулида, среди которых преимущественное подавление ЦОГ-2 играет, несомненно, главную роль, неоднократно обсуждались в литературе. Мы не будем на этом детально останавливаться в данной статье, а сделаем акцент на не менее важных характеристиках нимесулида, отличающихся от подавления ЦОГ, а также на нюансах фармакокинетики и технологических особенностях одного из препаратов нимесулида — Найза (Dr. Reddy’s Laboratories). Именно эти характеристики позволяют сделать правильный клинический выбор в зависимости от цели и условий назначения.
Одна из характеристик, объясняющая степень безопасности нимесулида, — кислотность. Если кислотность (т. е. pKa) препарата низкая (как, например, у НПВП с карбоксильной группой), то происходит его накопление в высокой концентрации внутри клеток слизистой и подслизистой оболочек желудка, где среда экстрацеллюлярного пространства и так отличается низкой рH, что вызывает сильное раздражение слизистой оболочки ЖКТ[4].
Нимесулид же, являясь единственным представителем производных сульфонанилидов, обладает относительно высоким уровнем pKa — 6,5 (практически нейтральным) — и при хорошей абсорбции меньше ионизируется, благодаря чему он не удерживается в слизистой оболочке и не захватывается митохондриями, а это означает меньшую частоту развития НПВП-гастропатии при приеме нимесулида[4, 5].
Важным преимуществом нимесулида как препарата для купирования острой боли является быстрое достижение пиковой концентрации в крови благодаря хорошему всасыванию из пищеварительного тракта[6]. После приема препарата в стартовой дозе через 30 мин достигается 55–80% его максимальной концентрации, в это же время в среднем наступает аналгезия, однако в ряде работ отмечено и более быстрое действие — уже в течение 15–20 мин после приема[7, 8]. Анальгетический эффект нимесулида развивается быстро, в том числе благодаря хорошему проникновению в синовиальную жидкость[9].
Однако скорость развития анальгетического эффекта зависит и от эффективности высвобождения лекарственного вещества из таблетки, которая тесно связана со скоростью распада (дезинтеграции) таблетки, и последующего растворения и/или всасывания. Разработчики рецептур таблетированных форм стараются оптимизировать этот показатель, применяя различные дезинтегранты или их комбинации.
Дезинтегрант — вспомогательное вещество, способствующее более быстрому распаду лекарственной формы и высвобождению активного вещества. Дезинтеграция таблеток реализуется двумя основными механизмами: капиллярным эффектом и набуханием[10]. Одним из самых широко применяемых дезинтегрантов с капиллярным эффектом является крахмал.
Ключевая задача для увеличения скорости действия препаратов при обезболивании — ускорение дезинтеграции. Поэтому постоянно ведутся поиск и разработка веществ с улучшенными дезинтеграционными свойствами — супердезинтегрантов[11]. Один из представителей данной группы — натрия крахмал гликолят, обладающий выраженным эффектом набухания[12]. По механизму дезинтеграции, скорости и степени набухания он значимо отличается от других применяемых супердезинтегрантов, например кроскармеллозы, имеющей капиллярный эффект (рис. 1).
Рис. 1. Различия механизмов действия супердезинтегрантов — натрия крахмала гликолята и кроскармеллозы[12]
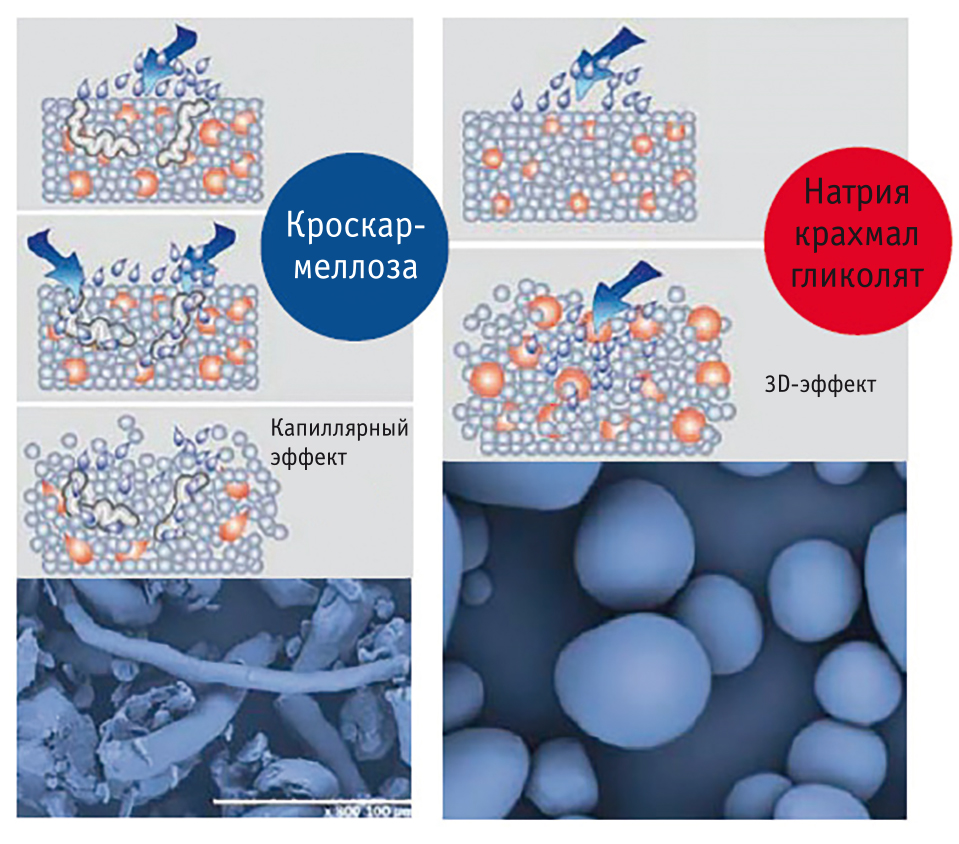
Очень важно, что отличия натрия крахмала гликолята от других супердезинтегрантов по скорости поглощения и объему связываемой жидкости не зависят от рН среды (рис. 2, 3). Так, в среде, близкой по кислотности к содержимому кишечника (рН = 6,8), натрия крахмал гликолят в первые 3–5 мин набухает примерно в 3 раза быстрее, чем кроскармеллоза, и быстрее достигает максимального объема, в 3–4 раза большего (до 15 мл/г), чем у кроскармеллозы (до 3,5 мл/г) и других супердезинтегрантов[12, 13] (см. рис. 2).
Рис. 2. Увеличение объема (набухание) натрия крахмала гликолята (Эксплозол), кроскармеллозы и других супердезинтегрантов при добавлении жидкостей, имитирующих по рН содержимое желудка (рН = 1,0) и кишечника (рН = 6,8)[13]
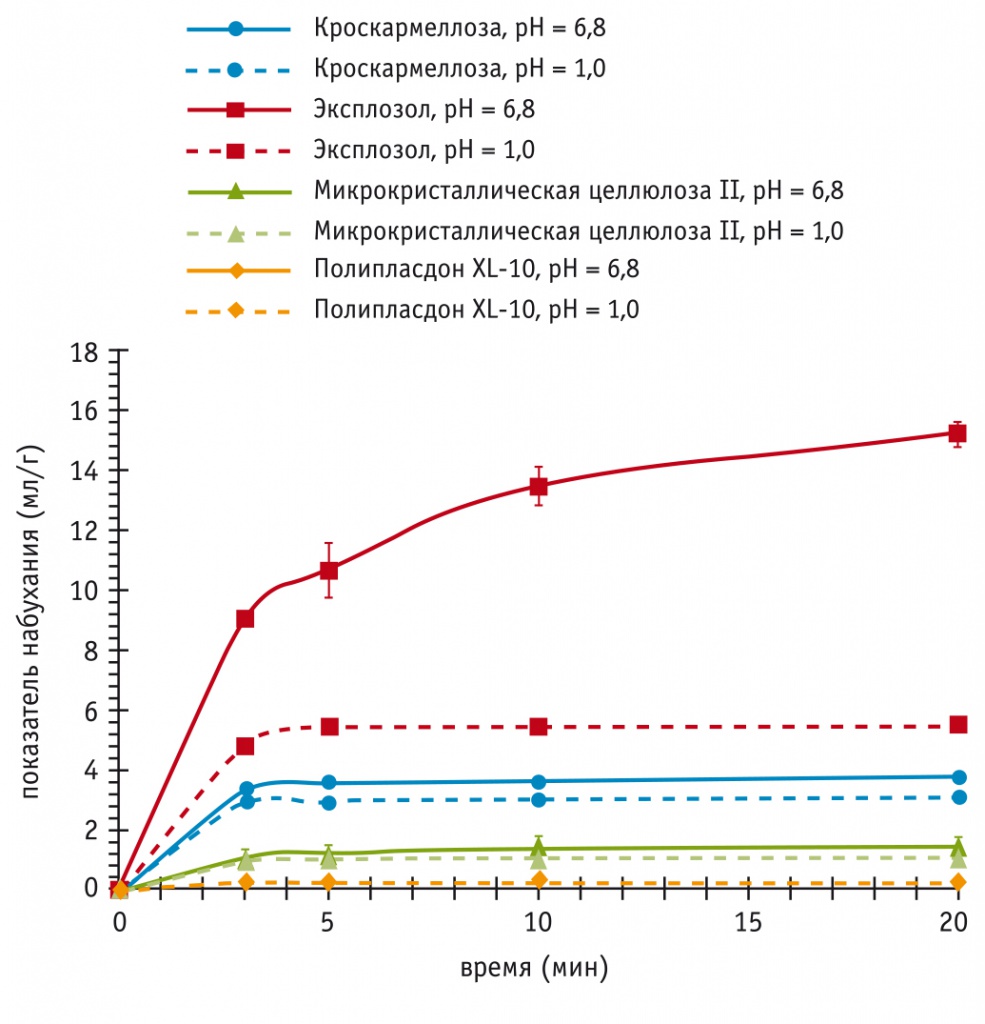
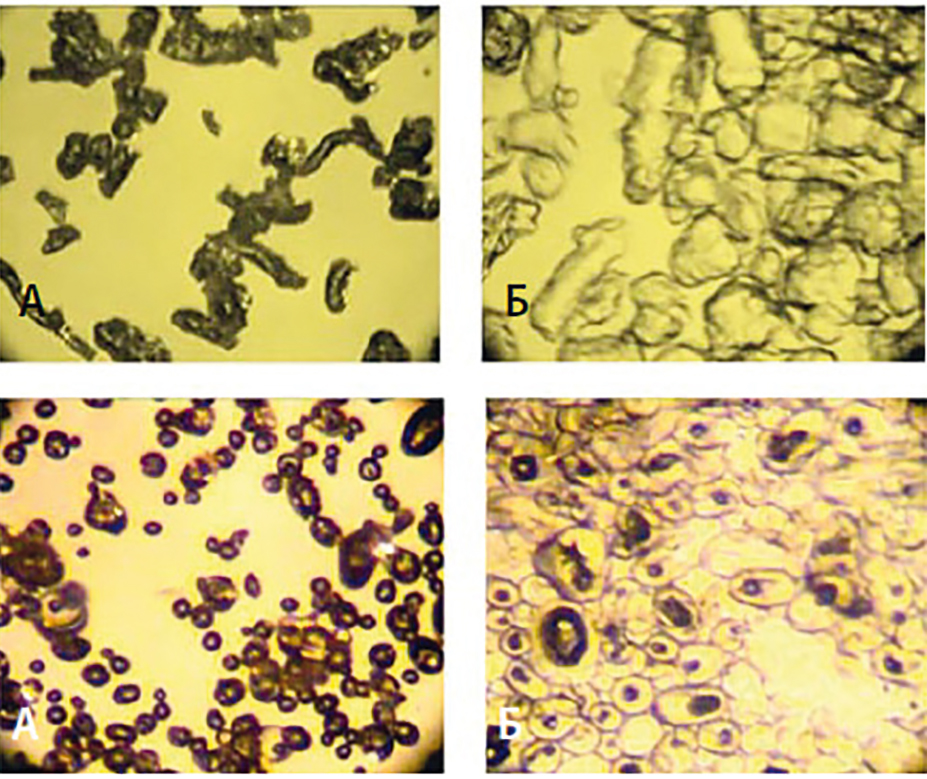
Рис. 3. Морфология частиц дезинтегрантов до (А) и через 5 с после (Б) добавления жидкости (увеличение в 700 раз) к натрия крахмалу гликоляту (вверху) и кроскармеллозе (внизу)[13]
Комбинирование различных дезинтегрантов дает еще более интересные эффекты, например комбинирование крахмала и супердезинтегранта натрия крахмала гликолята, реализованное в препарате Найз. Крахмал обеспечивает хороший капиллярный эффект и быстрое проникновение жидкости внутрь таблетки, а натрия крахмал гликолят усиливает их значительным набуханием и стремительным увеличением объема (при экспериментальных работах его объем увеличивался в 100 раз!)[10]. Быстро сорбируя большой объем жидкости, супердезинтегрант «взрывает» таблетку изнутри, способствуя ее трехмерному расширению во всех направлениях, так называемому 3D-эффекту[11, 12].
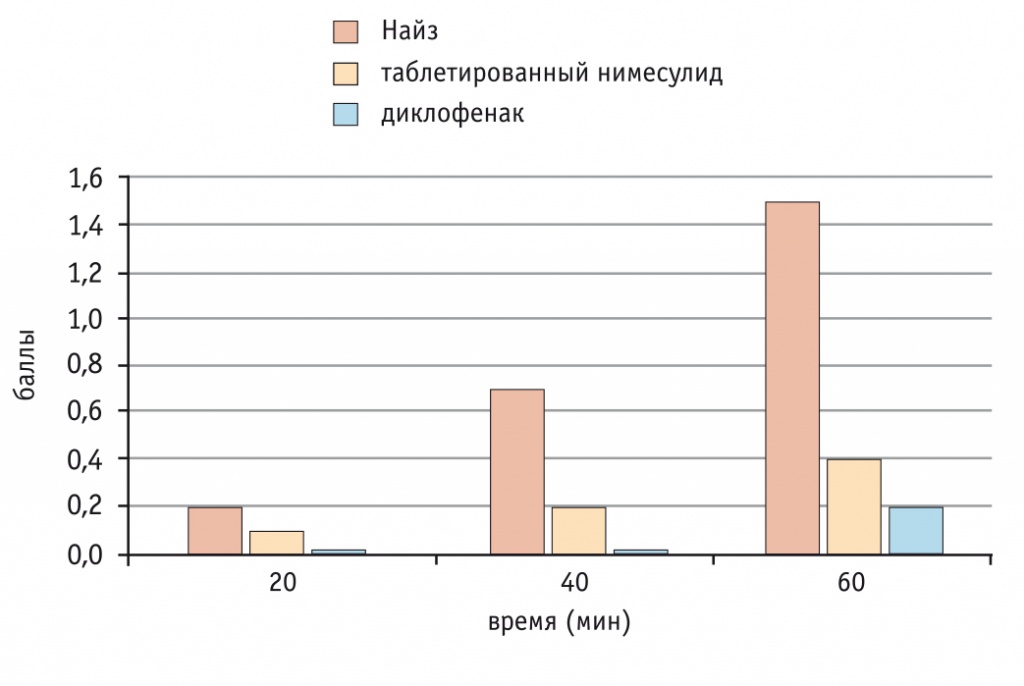
Клинически более быстрое анальгетическое действие Найза в сравнении с таковым другого генерика нимесулида и натрия диклофенака доказано и в клиническом исследовании[14]: уже через 20 мин наступил обезболивающий эффект Найза (100 мг/прием), но не другого таблетированного генерика нимесулида (100 мг/прием) и натрия диклофенака (150 мг/сут) (рис. 4).
Рис. 4. Уменьшение боли в течение первого часа после приема нестероидных противовоспалительных препаратов[14]
Скорость достижения анальгетического эффекта (подавления гипералгезии) у нимесулида реализуется через 15-20 мин после приема пероральных форм. В большей степени это связано именно с уникальной фармакокинетикой и дополнительными свойствами, отличными от ингибирования ЦОГ-2. Все НПВП уменьшают гипералгезию, однако эффект нимесулида превосходит таковой рофекоксиба при сравнительно одинаковой эффективности с диклофенаком и целекоксибом, но только у нимесулида действие развивается в столь короткие сроки[7].
Самые ранние работы, доказывающие и объясняющие уменьшение гипералгезии, выявили, что, помимо быстрого подавления интратекальной выработки ЦОГ-2, ингибируется NO-синтаза, которая напрямую участвует в механизмах передачи болезненных импульсов. На экспериментальных животных показано, что нимесулид превосходит трамадол, парацетамол, а также их сочетание в подавлении выработки ФНО-α и простагландина Е2 в спинномозговой жидкости в условиях воспалительной гипералгезии (Bianchi M. и соавт., 2007)[15]. Быстрая аналгезия на фоне приема нимесулида (в течение первых 15 мин) зафиксирована и в эксперименте на здоровых добровольцах с изучением ноцицептивной трансмиссии[16].
ЦОГ-НЕЗАВИСИМЫЕ ЭФФЕКТЫ НИМЕСУЛИДА
Нимесулид снижает уровень алгогенной субстанции Р[17], ослабляет синтез провоспалительных цитокинов, в том числе ИЛ-6[15, 17], ФНО-α[18] и лейкотриена В4[5, 17], а за счет снижения активности фермента фосфодиэстеразы IV он уменьшает таковую макрофагов и нейтрофильных гранулоцитов, играющих важную роль в патогенезе острой воспалительной реакции. Нимесулид ингибирует и продукцию реактивных кислородных радикалов и лейкотриена С4, продуцируемого эозинофилами[18].
Дополнительные противовоспалительные действия препарата обусловлены повышением чувствительности стероидных рецепторов к эндо- и экзогенным кортикостероидам[5, 19]. Он ингибирует иммунную и неиммунную секрецию гистамина тучными клетками, что также позитивно влияет на выраженность болевого синдрома[4, 20, 21]. Этот уникальный эффект нимесулида имеет значение при оценке потенциальной гастротоксичности, так как спектр действия гистамина чрезвычайно широк и воздействие на его выработку в ряде ситуаций может давать дополнительный эффект.
Показано, что нимесулид ингибировал стимулированную гистамином секрецию соляной кислоты в желудке опытных животных, и, хотя эти данные не проясняют до конца, каким образом ингибируется секреция кислоты в желудке человека, тем не менее возможность реализации подобных воздействий у людей может объяснить хорошую переносимость нимесулида[22]. Блокада выработки гистамина подтверждена еще в одном эксперименте, когда назначение нимесулида добровольцам, которым внутрикожно вводился гистамин, уменьшало реактивную зону на 40% (G. Senna, 1993).
Наконец, еще один важный момент, который нельзя не упомянуть при разговоре об особенностях фармакокинетики нимесулида, — период полувыведения, равный в среднем 2,5 часам. Считается, что столь короткий период полувыведения обеспечивает более быстрый ресинтез ЦОГ-1,
что ассоциируется с более высокой безопасностью препаратов[4, 23, 24]. Благодаря этому при использовании нимесулида побочные эффекты встречаются нечасто и выражены слабо, что и объясняет приверженность к препарату врачей различных специальностей[3, 25–33].
В 2014 году в Вене в Международном консенсусе эксперты также подтвердили положения о том, что риск связанных с использованием нимесулида тяжелых печеночных реакций является низким и находится в тех же пределах, что и токсичность других НПВП, а польза его применения превышает риски (при использовании в дозе не выше 200 мг/день на протяжении не более 15 дней подряд)[34, 35].
ЗАКЛЮЧЕНИЕ
К преимуществам анальгетика Найза (нимесулида) относятся высокая биодоступность, сильное и быстрое обезболивание, хорошее проникновение в синовиальную жидкость, мощный противовоспалительный эффект, низкая частота побочных эффектов.
Высокая скорость реализации анальгетического воздействия при использовании Найза связана с так называемым 3D-эффектом, который заключается в быстрой дезинтеграции таблетки.
Существенную роль в быстром и продолжительном анальгетическом действии нимесулида играет широкий спектр свойств, не связанных с ингибированием ЦОГ-2. Короткий период полувыведения обеспечивает быстрый ресинтез ЦОГ-1 и минимизацию частоты и выраженности побочных эффектов нимесулида.








