ВВЕДЕНИЕ
По данным Американского Торакального Общества, в США более 17 миллионов пациентов ежегодно обращаются к врачу по поводу одышки различной интенсивности [1]. Степень дискомфорта, ощущаемая больным, во многом зависит от индивидуальных особенностей и может быть различной даже при одинаковой степени объективных функциональных изменений [2].
Одышка является ведущим клиническим симптомом прогрессирующего фибротического фенотипа интерстициальных заболеваний легких (ИЗЛ). К этому фенотипу относятся идиопатический легочный фиброз, фибротический фенотип неспецифической интерстициальной пневмонии, хронический гиперчувствительный пневмонит, ИЗЛ, ассоциированные с системными заболеваниями соединительной ткани, и некоторые другие ИЗЛ, для которых общими являются рентгенологический образ обычной интерстициальной пневмонии и прогрессирующее течение [3]. Кардиальная патология отмечена у 69% больных фибротическим фенотипом ИЗЛ. Наиболее часто встречаются ИБС (44%), АГ (51%), наджелудочковые нарушения ритма (15%), сердечная недостаточность (13%) [4]. Сочетание ИЗЛ с ИБС сопровождается усилением одышки, ограничением физической активности, снижением качества жизни [5]. Причины усиления одышки у больных фибротическим фенотипом ИЗЛ, ассоциированных с кардиальными заболеваниями, различны [6]. Фиброзную трансформацию легочной ткани, снижение дыхательных объемов, развитие хронического легочного сердца расценивают как «преимущественно легочные» причины одышки. Прогрессирование систолической дисфункции ЛЖ при ИБС, развитие гиперволемии при нарушении ритма и недостаточности кровообращения составляют группу «кардиальных» причин одышки [7]. Различные причины возникновения и вариабельность одышки усложняют ее интерпретацию. Сложности возникают как у больного, так и у клинициста, особенно при первичном обращении пациента. Если у кардиологов есть инструмент оценки выраженности одышки в виде функциональных классов, по NYHA, The New York Heart Association (в случае, если одышка обусловлена сердечной недостаточностью), то терапевты ограничиваются показателями дыхательной недостаточности, основанной на адаптации к физической нагрузке: одышка в покое, одышка при умеренной и выраженной физической нагрузке [8]. Врачи общей практики часто расценивают одышку как «смешанную», не выявляя конкретных причин ее развития. В настоящее время в арсенале клинициста существуют доступные инструменты, такие как шкалы MRC (Medical Research Council Scale), BDI (Baseline Dyspnea Index), TDI (Transition Dyspnea Index), Шкала Борга, визуально-аналоговая шкала, которые позволяют объективно оценить дыхательный дискомфорт. Для них не требуется дорогостоящее оборудование, они просты в использовании, воспроизводимы при динамическом контроле. Количественная оценка одышки позволяет предположить первопричину ее появления, разработать алгоритм рационального обследования больных фибротическим фенотипом ИЗЛ, ассоциированных с ИБС.
Цель исследования: провести сравнительный анализ количественных характеристик одышки у больных фибротическим фенотипом ИЗЛ, ассоциированных с ИБС; сопоставить результаты анализа с данными функциональных и инструментальных методов обследования.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование были включены 47 больных фибротическим фенотипом ИЗЛ. Диагноз устанавливали по критериям диагностики ИЗЛ [9]. У 8 пациентов диагностировали идиопатический легочный фиброз, у 25 — хронический вариант гиперсенситивного пневмонита, у 14 — фибротический фенотип неспецифической интерстициальной пневмонии. У 23 больных была диагностирована ИБС. Сердечная недостаточность и ИБС были подтверждены в соответствии с рекомендациями ЕSС (European Society of Cardiology), ACC (American College of Cardiology), AHA (American Heart Association), HFSA (The Heart Failure Society of America) [10, 11]. Критериями исключения из исследования были III–IV функциональный классы ХСН, болезни соединительной ткани, онкологические заболевания, ВИЧ. Были проанализированы длительность легочного и кардиального заболеваний, продолжительность усиления одышки за последнее время. У всех пациентов оценивали интенсивность курения, нутритивный статус с подсчетом ИМТ. Инструментальное исследование включало в себя ЭхоКГ, КТ органов грудной клетки, спирометрию и бодиплетизмографию, анализ диффузионной способности легких. Пульсоксиметрия была проведена дважды: до и после шагового теста. Интерпретацию клинических симптомов (кашля, одышки, выделения мокроты) осуществляли по трехбалльной шкале, в соответствии с которой 1 балл — умеренная выраженность симптома, 2 балла — средняя, 3 балла — выраженный клинический симптом. Для трактовки рентгенологических находок КТ органов грудной клетки использовали метод Kazerooni с оценкой интерстициальных изменений и интенсивности «матового стекла» [12]. Для количественной оценки одышки применяли шкалу MRC, функциональную Шкалу одышки Борга и шкалу CRP (Clinical, Radiographic, and Physiologic scoring system). Шкалу MRC использовали для интерпретации повседневной физической нагрузки: 0 баллов — нет одышки, 4 балла — одышка развивается при малейшей нагрузке. Двадцатибалльная шкала CRP отражала показатели переносимости физической нагрузки при выполнении функциональных тестов (0 баллов — диспноэ отсутствует после интенсивной тридцатиминутной физической нагрузки, 20 баллов — одышка в покое). Подсчет баллов по шкале одышки Борга (0 баллов — нет одышки, 10 баллов — очень тяжелая одышка) осуществляли перед началом и по завершении шестиминутного шагового теста. Для оценки клинического состояния больных ХСН была использована комбинированная балльная шкала ШОКС (Шкала оценки клинического состояния) в модификации Ю.В. Мареева [13]. Количественный анализ полученных данных проводили с помощью статистической программы Statistica V 6.0. При нормальном распределении выборки использовали t-критерий Стьюдента. При сравнительном анализе непараметрических данных применяли критерий Манна — Уитни. Различия считали статистически значимыми при р < 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Обследовано 47 больных фибротическим фенотипом ИЗЛ (25 мужчин, 22 женщины) в возрасте от 47,9 до 68,3 года. Проведен сравнительный анализ клинических симптомов, демографических данных, сопутствующих заболеваний, продолжительности ИБС и фибротического фенотипа ИЗЛ у пациентов двух исследуемых групп (табл. 1).
Таблица 1
Клиническая характеристика больных фибротическим фенотипом интерстициальных заболеваний легких (ИЗЛ)
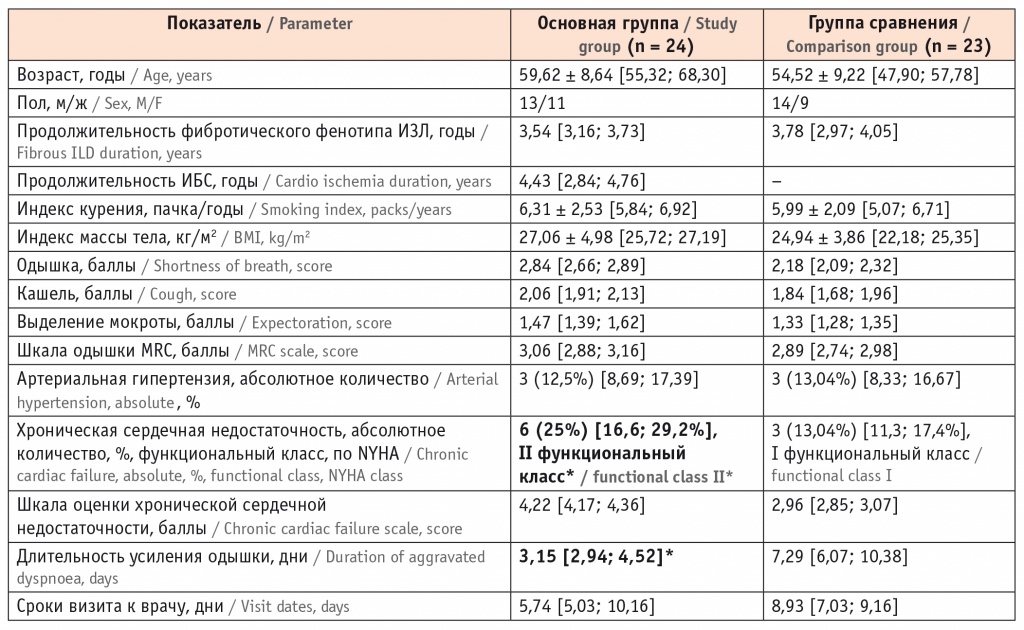
* Отличия от группы сравнения статистически значимы (р < 0,05).
В основную группу вошли 24 больных фибротическим фенотипом ИЗЛ, ассоциированных с ИБС (13 мужчин, 11 женщин, средний возраст: 59,62 ± 8,64 года). Длительность фибротического фенотипа ИЗЛ — 3,54 года, длительность ИБС — 4,43 года. Активными курильщиками были 4 пациента (16,7%), бывшими курильщиками — 2 пациента (8,3%), индекс курения в основной группе составил 6,31 ± 2,53 года. Больные имели следующие клинические формы ИБС: у 10 пациентов диагностирована ИБС II функционального класса, у 9 — ИБС III функционального класса, у 5 пациентов регистрировалась ИБС в форме постинфарктного кардиосклероза. Группу сравнения составили 23 пациента с фибротическим фенотипом ИЗЛ без ИБС (14 мужчин, 9 женщин, средний возраст: 54,52 ± 9,22 года). Продолжительность фибротического фенотипа ИЗЛ — 3,78 года, индекс курения — 5,99 ± 2,09 года. Длительность интерстициального заболевания у лиц из основной группы была меньше, чем у больных без ИБС. Интенсивность кашля у них составила 2,06 балла, одышки — 2,84 балла, выделения мокроты — 1,47 балла, что было выше, чем в группе больных ИЗЛ без ИБС.
Допустимо предположение, что ИБС увеличивает тяжесть и скорость проявления клинических признаков интерстициального заболевания. Анализ сопутствующих заболеваний у пациентов с фибротическим фенотипом ИЗЛ позволил исключить их в качестве причин усиления одышки. АГ встречалась практически с равной частотой: у 12,5% в группе больных с ИБС и у 13,04% в группе больных «изолированным» фибротическим фенотипом ИЗЛ. Висцеральное ожирение и продолжительность табакокурения рассматривали в качестве факторов риска развития ИБС и одышки, связанной с этим заболеванием. Индекс курения у пациентов с ИБС был больше, чем у больных без ИБС, но статистически значимого различия показателей между сравниваемыми группами не отмечено. Избыточная масса тела коррелировала со снижением пиковой скорости выдоха, остаточной емкости легких, резервного объема выдоха. У больных фибротическим фенотипом ИЗЛ с ИБС и ожирением развивался дефицит мышечной массы, возрастала потребность миокарда в кислороде, что, наряду с уменьшением легочных объемов, провоцировало усиление одышки [14, 15]. При изучении питательного статуса исследуемых больных не было отмечено повышения ИМТ тела, что исключало ожирение как причину появления одышки. После перенесенного инфаркта миокарда одышка может быть единственным клиническим проявлением сердечной недостаточности [16].
У больных фибротическим фенотипом ИЗЛ с ИБС статистически значимо чаще встречалась ХСН (в 25% случаев), в отличие от больных без ИБС (в 13,04% случаев), p < 0,05. При развитии ХСН пациенты уменьшали свою активность, приспосабливаясь к одышке. Об адаптации к физической нагрузке свидетельствовало отсутствие статистически значимых различий между показателями MRC у пациентов обеих групп. Клинические признаки ХСН имеют низкую специфичность, поскольку субъективные ощущения больного не всегда соответствуют стадиям сердечной недостаточности [11, 13]. Для количественного определения тяжести симптомов ХСН использовали шкалу ШОКС [13]. У больных с ИБС наблюдали большую выраженность клинических симптомов (кашля, одышки) и высокую степень сердечной недостаточности, выявленные с помощью шкалы ШОКС (4,22 балла); II функциональный класс был присвоен в соответствии с классификацией NYHA. В группе пациентов без ИБС интенсивность клинических симптомов была ниже, признаки сердечной недостаточности были выражены в меньшей степени: ШОКС — 2,96 балла, что соответствовало I функциональному классу NYHA. При сопоставлении времени появления одышки со сроками визита к врачу было установлено, что больные фибротическим фенотипом ИЗЛ с ИБС ощущают усиление одышки раньше (в среднем через 3,15 дня), чем пациенты с «изолированным» фибротическим фенотипом ИЗЛ (через 7,29 дня), p < 0,05. Большая интенсивность одышки у больных основной группы, ее усиление в более ранние сроки предполагали своевременное обращение к врачу. Однако более половины пациентов с ИБС (13 больных, 54,2%) и большинство больных без ИБС (16 пациентов, 69,6%) не связывали усиление одышки с прогрессированием кардиального или легочного заболеваний, а объясняли это длительным стажем табакокурения. Вероятно, поэтому пациенты обеих групп не сразу обращались к врачу после появления одышки: больные с ИБС — через 5,74 дня после усиления «привычной» одышки; больные без ИБС — через 8,93 дня. Только выраженное ограничение повседневной двигательной активности, развитие приступов стенокардии и перебоев в работе сердца, появление видимых признаков сердечной недостаточности (цианоза губ, отечного синдрома) заставляли больных обратиться к врачу для уточнения причин усиления одышки. Пациентам с ИБС проводили специализированное инструментальное обследование, результаты которого сопоставляли с клинической симптоматикой. Эти данные представлены в таблице 2.
Таблица 2
Результаты обследования больных фибротическим фенотипом интерстициальных заболеваний легких (ИЗЛ)
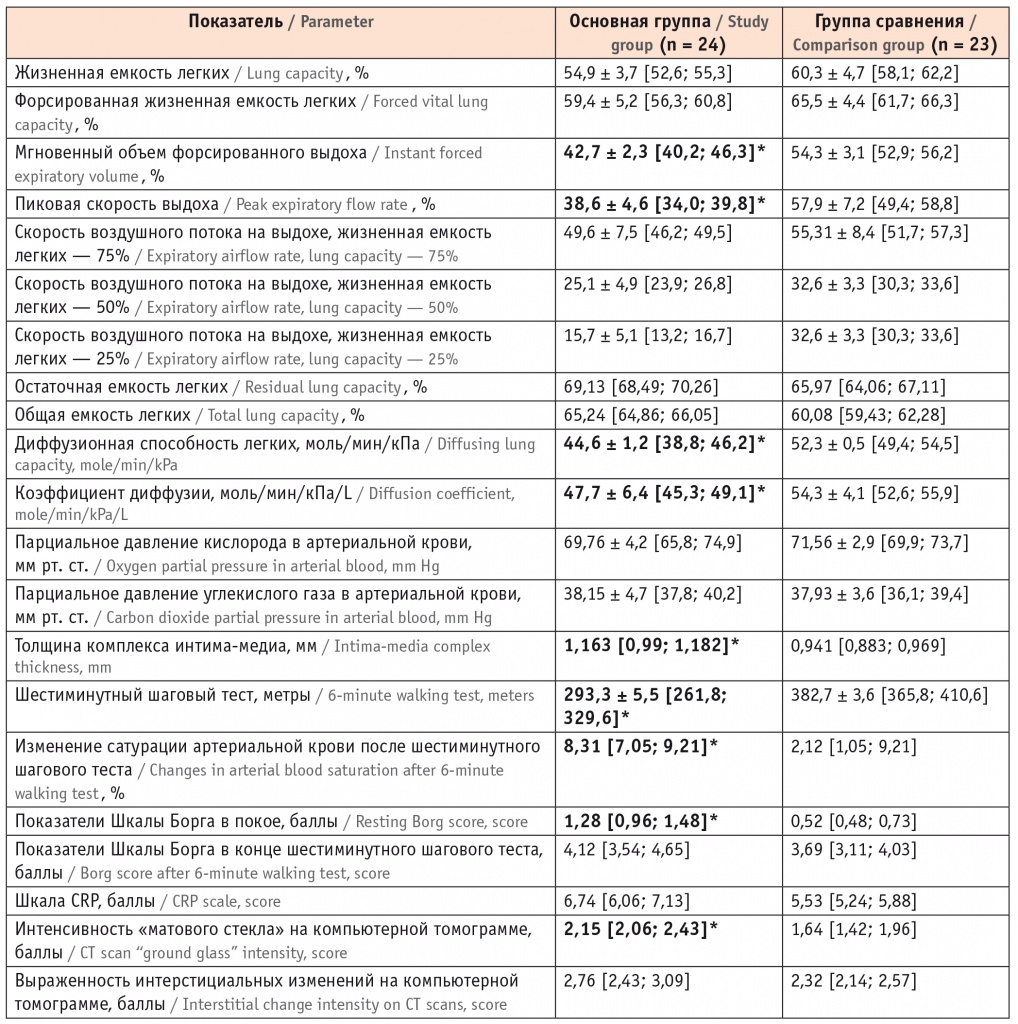
* Отличия от группы сравнения статистически значимы (р < 0,05).
При анализе спирометрии и бодиплетизмографии у больных фибротическим фенотипом ИЗЛ выявлено уменьшение общей и остаточной емкости легких за счет снижения ЖЕЛ. Уменьшение этих показателей более существенно у больных фибротическим фенотипом ИЗЛ с ИБС и отражает снижение растяжимости легочной ткани. Уменьшение эластической тяги легких развивалось вследствие фиброзной трансформации паренхимы легочной ткани, ретикулярных изменений, формирования тракционных бронхоэктазов, субплевральных кистозных образований. В группе пациентов с ИБС уменьшение ЖЕЛ, ФЖЕЛ, МСВ75 и МСВ50 было связано с отеком периваскулярного интерстиция, повышением васкуляризации интерстициальной ткани при гиперволемии, приводящими к большему снижению дыхательных объемов.
У пациентов с сердечной недостаточностью наблюдали как рестриктивные, так и обструктивные нарушения. Рестриктивные изменения обусловлены повышением ригидности легочной ткани на фоне интерстициального отека; обструктивные нарушения были вызваны набуханием слизистой оболочки мелких бронхов со снижением их проходимости. Функциональными маркерами бронхиальной обструкции являлось снижение ОФВ1 и уменьшение МСВ25.
При анализе диффузионной способности легких было отмечено статистически значимое снижение показателей у больных фибротическим фенотипом ИЗЛ с ИБС (p < 0,05). По-видимому, уменьшение этих показателей обусловлено морфологическими изменениями легочной ткани: инфильтрацией и фиброзированием вазального интерстиция, приводящими к сокращению площади газообмена; а также атеросклеротическим поражением сосудистой стенки со снижением диффузии газов [17]. О структурных изменениях микроциркуляторного русла, повышении жесткости артериол альвеолярно-капилярной мембраны косвенно свидетельствует увеличение толщины комплекса интима-медиа.
Анализ показателей парциального давления кислорода и углекислого газа в крови отражает развитие гипоксемии и гиперкапнии у больных обеих групп. Большую выраженность показателей наблюдали у пациентов с фибротическим фенотипом ИЗЛ с ИБС, статистические различия между группами отсутствовали.
Для оценки функционального статуса всем больным был проведен тест шестиминутной ходьбы. Меньшее расстояние, пройденное за 6 минут, более выраженная десатурация (ΔSрO2 в основной группе — 8,31% и 2,12% — в группе сравнения, p < 0,05), высокие значения на шкалах Борга и CRP свидетельствовали о статистически значимом снижении толерантности к физической нагрузке у больных с фибротическим фенотипом ИЗЛ при наличии ИБС.
Результаты тестирования отражали отягощающее влияние интерстициального и кардиального заболеваний друг на друга: ИБС у больного фибротическим фенотипом ИЗЛ являлась фактором, препятствовавшим преодолению расстояния во время теста; функциональный статус больного снижался вследствие фибротического фенотипа ИЗЛ, ассоциированных с ИБС.
Выявленные рентгенологические изменения на КТ органов грудной клетки были условно разделены на две группы. Фиброзная трансформация кортикальных и базальных отделов легких, утолщение стенок бронхов, уплотнение межальвеолярных перегородок, двусторонние ретикулярные изменения, нарушение архитектоники легких с развитием «сотового легкого» расценивали как интерстициальные изменения.
Участки инфильтрации септального и внутридолькового интерстиция, заполнение альвеол транссудатом при повышении объема капиллярного кровотока расценивали как зоны «матового стекла».
Статистически значимого различия интенсивности интерстициальных изменений у больных фибротическим фенотипом ИЗЛ с ИБС и у пациентов группы сравнения не выявлено.
Выраженность симптома «матового стекла» была статистически значимо выше у больных основной группы, p < 0,05. У больных «изолированным» фибротическим фенотипом ИЗЛ этот симптом отражал изменения интерстиция и являлся проявлением только легочного заболевания. У больных с ИБС он был обусловлен ретикулярными изменениями, альвеолитом, отечным пропитыванием межуточной ткани вследствие гиперволемии и являлся отражением интерстициального и кардиального заболеваний. Для анализа параметров центральной гемодинамики всем больным выполняли ЭхоКГ (табл. 3).
Таблица 3
Результаты эхокардиографии у больных фибротическим фенотипом интерстициальных заболеваний легких (ИЗЛ)
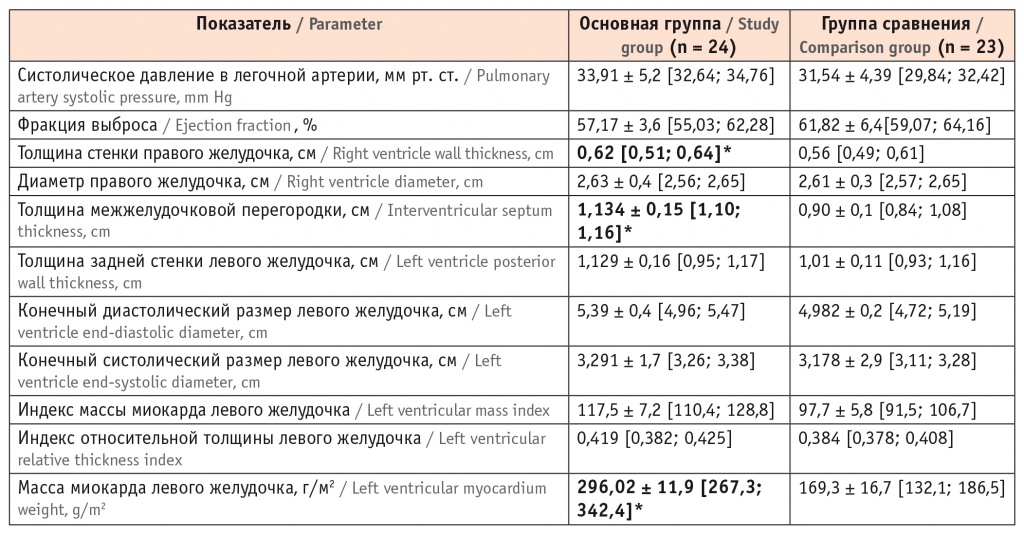
* Отличия от группы сравнения статистически значимы (р < 0,05).
По результатам ЭхоКГ, в обеих группах выявлено повышение среднего давления в легочной артерии, увеличение диаметра ПЖ и утолщение его стенки. Отмечено, что степень легочной гипертензии и гипертрофии ПЖ коррелируют с уровнем гипоксемии и гиперкапнии и являются показателем выраженности паренхиматозного легочного фиброза [18]. Снижение ФЖЕЛ на 10% и более в течение года, ограничение расстояния, пройденного за время шагового теста более чем на 45 метров при повторном тестировании, показатели диффузионной способности легких ниже 40 моль/мин/кПа, систолическая легочная гипертензия свыше 30 мм рт. ст. являются маркерами прогрессирования ИЗЛ [19].
Сопоставление интенсивности одышки, по результатам шестиминутного нагрузочного теста, с данными функционального обследования и ЭхоКГ позволяет оценить тяжесть и прогноз интерстициального заболевания. Высокий уровень легочной гипертензии и большие структурные изменения правых отделов сердца у больных основной группы свидетельствуют о негативном влиянии ИБС на течение фибротического фенотипа ИЗЛ.
Сократительная способность миокарда у исследуемых пациентов не была нарушена: значения фракции выброса не отражали отклонений от нормы. Количественная оценка структур сердца регистрировала развитие гипертрофии ЛЖ у пяти больных фибротическим фенотипом ИЗЛ и постинфарктным кардиосклерозом (20,83%). У этих пациентов отмечали увеличение толщины межжелудочковой перегородки до 1,134 ± 0,15 см и толщины задней стенки ЛЖ до 1,129 ± 0,16 см. Значение индекса массы миокарда свыше 115 (117,5 ± 7,2) и показатели индекса толщины стенки ЛЖ менее 0,42 (0,419) свидетельствовали о формировании эксцентрической гипертрофии ЛЖ. У остальных пациентов с ИБС и у больных группы сравнения структурных изменений ЛЖ не отмечено. Нарушение геометрии ЛЖ развилось вследствие локального снижения сократительного потенциала миокарда и являлось механизмом компенсации систолической функции. О диастолической дисфункции ЛЖ свидетельствовало увеличение его конечного диастолического размера (до 5,39 ± 0,4 см). Признаков диастолической дисфункции у больных сравниваемых групп не отмечено.
Таким образом, у больных с ИБС регистрируются структурные изменения ЛЖ и ПЖ, приводящие к функциональным нарушениям. По результатам шагового теста, нарушение работы миокарда, процессы ремоделирования объясняют большую интенсивность одышки и выраженное снижение функционального статуса. Чтобы выявить взаимосвязи между показателями одышки, по шкалам MRC, CRP, Борга, и результатами обследования, был проведен корреляционный и регрессионный анализы. Изучение одышки по шкале MRC позволяло объективизировать ощущения пациента, оценить уровень одышки в условиях повседневной двигательной активности. У больных фибротическим фенотипом ИЗЛ, ассоциированных с ИБС, регистрировалась тяжелая одышка (MRC — 3,06), у больных группы сравнения была одышка средней степени тяжести (MRC — 2,89). У пациентов основной группы выявлены статистически значимые корреляционные связи между интенсивностью одышки, по шкале MRC, и такими показателями, как парциальное давление кислорода в артериальной крови (r = –0,695, p < 0,001), ΔSpO2 (r = 0,523; p < 0,001), ЖЕЛ (r = –0,496, p < 0,05), общая емкость легких (r = –0,398, p < 0,05), остаточная емкость легких (r = –0,479, p < 0,05), диффузионная способность легких (r = –0,713, p < 0,001), дистанция, пройденная за 6 минут (r = –0,645, p < 0,001). У пациентов без ИБС выявлена менее статистически значимая связь интенсивности одышки, по шкале MRC, с такими показателями, как парциальное давление кислорода в артериальной крови (r = –0,43, p < 0,05); ΔSpO2 (r = 0,367; p < 0,05); ЖЕЛ (r = –0,375, p < 0,05), общая емкость легких (r = –0,319, p < 0,05), диффузионная способность легких (r = –0,537, p < 0,05), расстояние, пройденное за 6 минут (r = –0,487, p < 0,05).
Допустимо предположение, что у больных фибротическим фенотипом ИЗЛ высокая статистическая значимость выявленной связи и ее более высокий коэффициент корреляции отражают негативное влияние ИБС на развитие десатурации и выраженность функциональных нарушений. Шкалы одышки Борга и CRP позволяют оценить связь между субъективным ощущением переносимости физической нагрузки и дистанцией, пройденной за время теста, роль легочного и кардиального заболеваний в ухудшении функциональных возможностей пациента.
У больных фибротическим фенотипом ИЗЛ с ИБС показатели шкалы Борга коррелировали с парциальным давлением кислорода в артериальной крови (r = –0,63, p < 0,001), с ΔSpO2 (r = –0,732, p < 0,001), с диффузионной способностью легких (r = –0,44, p < 0,001), с показателями систолического давления в легочной артерии (r = 0,35, p < 0,05), с толщиной стенки ЛЖ (r = –0,39, p < 0,05), с выраженностью интерстициальных изменений на КТ (r = –0,41, p < 0,05), с расстоянием, пройденным за время шестиминутного шагового теста (r = –0,57, p < 0,001). У больных основной группы установлены взаимосвязи между интенсивностью одышки, оцениваемой по шкале СRP, и общей емкостью легких (r = –0,39, p < 0,001), толщиной стенки ПЖ (r = –0,48, p < 0,05), ФЖЕЛ (r = –0,39, p < 0,05), диффузионной способностью легких (r = –0,63, p < 0,001), показателями, выявленными с помощью шкалы ШОКС (r = –0,33, p < 0,05), показателями систолического давления в легочной артерии (r = 0,48, p < 0,001). Одышку, оцениваемую по шкалам Борга и CRP, у больных «изолированным» фибротическим фенотипом ИЗЛ трактовали как «тяжелую», у больных с ИБС как «очень тяжелую». По-видимому, у больных с ИБС одышка являлась фактором, ограничивающим физические возможности пациента. Изменение газового состава крови, десатурация, легочная гипертензия были обусловлены снижением легочной функции, структурными изменениями ЛЖ и ПЖ, влияющими на интенсивность одышки и переносимость физической нагрузки. Трактовка одышки субъективна, нередко больному трудно описать свое диспноэ и дать полную характеристику дыхательных ощущений. У больных с ИБС, ХСН, легочной гипертензией, структурными изменениями миокарда ЛЖ и ПЖ одышка более интенсивная, чем у больных «изолированным» фибротическим фенотипом ИЗЛ. Объективная характеристика одышки с использованием шкал MRC, Борга и CRP позволяет предположить, какие заболевания в большей мере провоцируют развитие диспноэ.
Интенсификация одышки, по результатам повторного нагрузочного теста, может свидетельствовать о нарастании рестриктивных нарушений вентиляции и о прогрессировании заболевания.
ЗАКЛЮЧЕНИЕ
У больных фибротическим фенотипом ИЗЛ наблюдают различные сердечно-сосудистые заболевания, сопровождающиеся развитием диспноэ.
Изучение количественных характеристик одышки может быть инструментом диагностики этих заболеваний. Оно позволяет предположить возможный механизм возникновения диспноэ. Это простой, удобный, доступный способ априорного анализа одышки на этапе, предшествующем специализированным инструментальным методам диагностики.
Поступила: 24.03.2021
Принята к публикации: 28.06.2021








