Системная красная волчанка (СКВ) — хроническое мультисистемное аутоиммунное заболевание неизвестной этиологии с широким спектром клинических проявлений и непредсказуемым течением. Серологически СКВ характеризуется присутствием высоких титров органонеспецифических аутоантител к различным компонентам клеточного ядра [1, 2]. В патогенезе СКВ участвуют как врожденные, так и приобретенные иммунные реакции. Взаимодействие генов с факторами окружающей среды приводит к многочисленным иммунологическим изменениям, результатом которых являются иммунные реакции против аутологичных нуклеиновых кислот. Аутоантитела и отложение иммунных комплексов могут повреждать ткани в почках, сердце, сосудах, центральной нервной системе, коже, легких, мышцах и суставах.
Заболевание начинается с доклинической бессимптомной фазы, характеризующейся появлением антинуклеарных антител/антинуклеарного фактора (АНА/АНФ), общих для аутоиммунных заболеваний, в последующем — высокоспецифичных для СКВ: антител к двуспиральной ДНК (анти-дс-ДНК), к Смит/Smith антигену (анти-Sm), антифосфолипидных антител (аФЛ) [3] (рис. 1). Ретроспективный анализ показал, что позитивные уровни АНА определяются за 10 лет до верификации диагноза у 47% пациентов с СКВ, аФЛ — за 7,6 года (в среднем за 3 года) у 18%, анти-дс-ДНК — за 2,5 года у 55%, анти-Sm — за несколько месяцев до диагностированной болезни [4–7].
Рис. 1. Течение системной красной волчанки на фоне стандартной терапии и применения стратегии «лечения до достижения цели» [3]
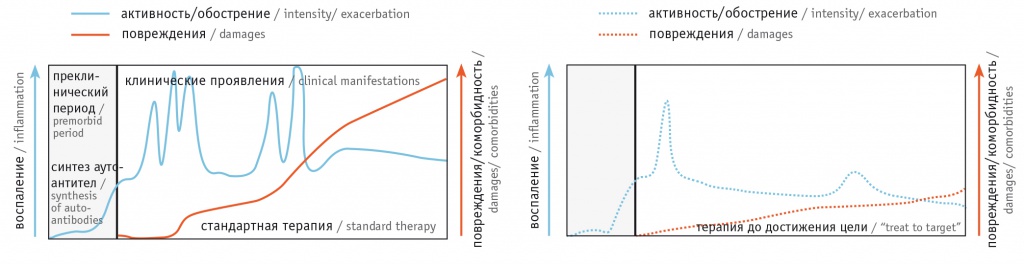
Период развернутой клинической картины отличается волнообразным течением: чередованием обострений («вспышек») и низкой активности/ремиссий. Частые обострения, которые оценивают с помощью индексов активности СКВ [8], вызванные аутоиммунным воспалением, терапия СКВ и сопутствующие заболевания (инфекции, ранний атеросклероз, злокачественные новообразования) приводят к накоплению необратимых повреждений различных органов (измеряют индексом повреждения по шкале Systemic Lupus International Collaborating Clinics Damage Index, SLICC) [9] (см. рис. 1). Эффективная и ранняя терапия, уменьшающая активность заболевания или приводящая к ремиссии, не только снижает частоту и тяжесть обострений, но и минимизирует связанные с ними повреждения [3].
ЭПИДЕМИОЛОГИЯ
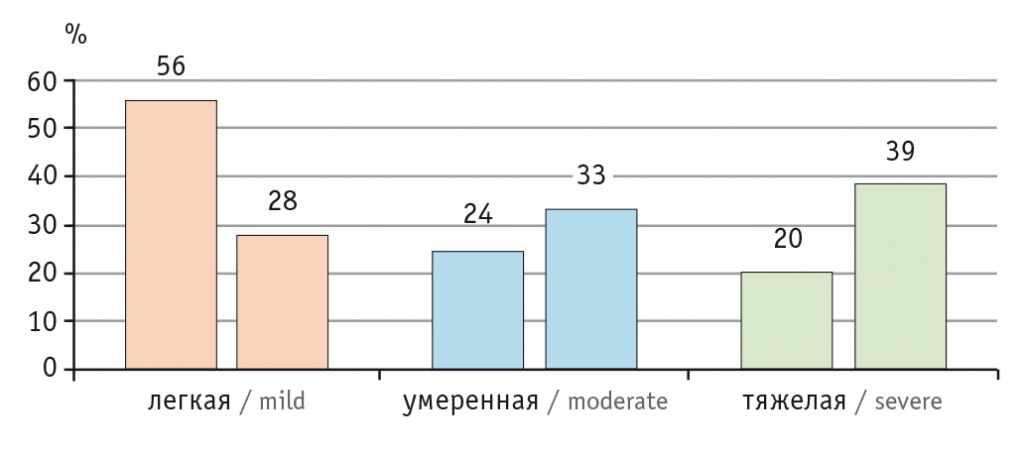
В последние 40 лет участились случаи СКВ, что может быть связано с совершенствованием диагностики, результаты которой колеблются в пределах от 0,3 до 31,5 случая на 100 тысяч человек в год. Распространенность заболевания во всем мире приблизилась к 50–100 случаям на 100 тысяч человек среди взрослого населения [3]. В Российской Федерации распространенность СКВ составляет 9,0–20,6 случая на 100 тысяч человек в зависимости от региона, а заболеваемость — 0,3–1,6 случая на 100 тысяч человек среди всего населения страны [10]. Среди заболевших СКВ преобладают женщины молодого и среднего возраста, что по отношению к пациентам мужского пола составляет 10:1, — это преимущественно больные с легкой степенью активности заболевания в дебюте (рис. 2) [11]. Однако со временем болезнь прогрессирует, так что число пациентов с легкой, средней и тяжелой степенями активности заболевания становится приблизительно одинаковым (около трети в каждой категории) (рис. 3) [12].
Рис. 2. Активность системной красной волчанки в дебюте заболевания [11]
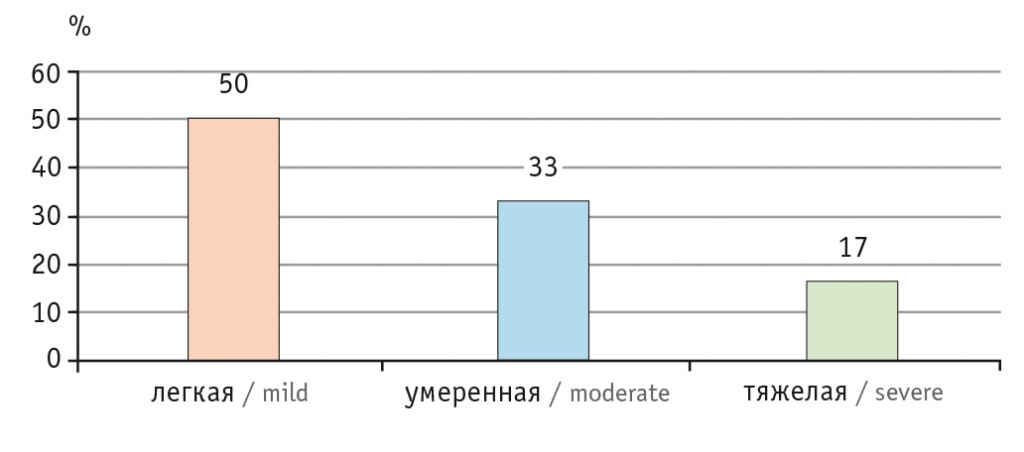
Рис. 3. Активность системной красной волчанки в дебюте и по мере прогрессирования болезни [12].
Примечание: первый столбец в каждой группе отражает частоту определенной степени активности заболевания в дебюте, второй — по мере прогрессирования болезни
Тяжесть СКВ варьирует в зависимости от этнической принадлежности и, как правило, тяжелее протекает у пациентов африканского и латиноамериканского происхождений [3].
ВЛИЯНИЕ ФАКТОРОВ ОКРУЖАЮЩЕЙ СРЕДЫ И ГЕНЕТИКИ
К факторам окружающей среды, запускающим патогенез СКВ, относят ультрафиолетовое облучение, курение, наркотики и некоторые лекарственные препараты (известно около 118 наименований: эстрогены, прокаинамид, гидралазин, сульфасалазин и др.) [13]. Так, курение ассоциировано с гиперпродукцией анти-дс-ДНК и аФЛ, а терапия ингибиторами ФНО-α — с анти-дс-ДНК [14–16]. Патогенетическая роль эстрогенов связана с их способностью влиять на гуморальные реакции: они стимулируют пролиферацию В-клеток и продукцию антител и одновременно оказывают ингибирующий эффект на пролиферативную активность Т-клеток [17, 18].
В настоящее время признана полигенная аддитивная модель семейной агрегации аутоиммунных заболеваний и, в частности, СКВ. Согласно общенациональному исследованию, проведенному на Тайване, относительный риск развития СКВ среди близнецов равен 316, среди братьев и сестер — 24, среди родителей — 11, среди детей — 14, и даже среди неродственных супругов он составляет 4. Конкордантность в отношении заболевания у монозиготных близнецов равна 25%, вклад генетически детерминированной наследуемости в развитие СКВ определен на уровне 44%, «семейных» общих факторов окружающей среды — на уровне 26%, необщих факторов окружающей среды — на 30% [19–21]. Относительный риск СКВ при наличии у родственников первой линии других аутоиммунных заболеваний колеблется от 5,87 для болезни Шегрена, 5,40 для системной склеродермии, 2,66 для ревматоидного артрита, 2,58 для рассеянного склероза, 1,68 для СД 1 типа до 1,39 для воспалительных заболеваний кишечника. Эти данные могут быть основой для определения генетической закономерности (или ее отсутствия) развития аутоиммунных заболеваний. Возможно, наличие редких генетических вариаций в сигнальном пути Т-клеточных рецепторов является общим знаменателем для существующей семейной агрегации [21].
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ СИСТЕМНОЙ КРАСНОЙ ВОЛЧАНКИ: «БОЛЬШИЕ И МАЛЫЕ»
В отличие от других аутоиммунных заболеваний, таких как СД 1 типа, рассеянный склероз, тиреоидит Хашимото, характеризующихся органоспецифичностью, при СКВ отмечают системное поражение органов и тканей, многообразие клинических проявлений. Болезнь может дебютировать одним или двумя симптомами, однако для СКВ характерно полиорганное поражение, ввиду которого страдают кожа, слизистые, опорно-двигательный аппарат, легкие, почки, сердечно-сосудистая и нервная системы. Клинические проявления существенно варьируют у разных больных и в разные периоды заболевания. Течение СКВ волнообразное, с чередованием ремиссий и обострений, при которых возможно вовлечение в патологический процесс новых органов и систем.
В таблице 1 представлены характер и частота клинических проявлений при СКВ в европейской когорте, согласно данным D. Nicolopoulos и соавт. [22], и собственные данные ФГБНУ «НИИР им. В.А. Насоновой».
Таблица 1
Частота поражения органов при системной красной волчанке
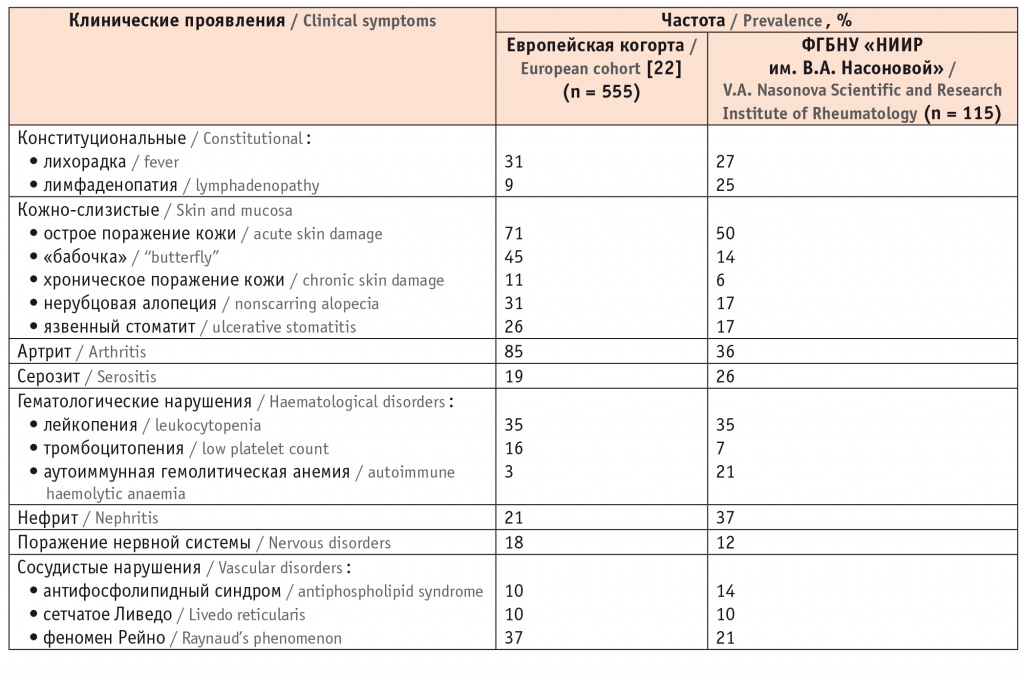
У кавказоидов самыми частыми клиническими проявлениями СКВ являются острое поражение кожи, артрит, лейкопения, нефрит и лихорадка. Поражения органов, не входящие в критерии СКВ (например, альвеолит, васкулит, люпус-гепатит), встречаются у 19% больных. Пациенты детского и пожилого возраста имеют свои особенности. Ювенильная СКВ характеризуется острым и более тяжелым течением с лихорадкой (46%), поражением почек (42%) и нервной системы (17%) [22]. Дебют СКВ в пожилом возрасте ассоциируется с поражением сердечно-сосудистой системы, серозитом, синдромом Шегрена. Тяжелые формы нефрита и вовлечение нервной системы редки. Характерны высокие значения индекса повреждения SDI, частоты коморбидных состояний и инфекционных осложнений [23].
Диагноз СКВ является клиническим, но требующим обязательного лабораторного подтверждения с определением АНФ и высокоспецифических биомаркеров: аутоантител (анти-дс-ДНК, анти-Sm, аФЛ) и гипокомплементемии. Верификацию диагноза, лечение и мониторинг должен осуществлять ревматолог.
Постоянно совершенствуются критерии диагностики СКВ, позволяющие своевременно установить верный диагноз и назначить адекватное лечение, что является основой повышения продолжительности и качества жизни больных. В 2019 году European League Against Rheumatism (EULAR) и American College of Radiology (ACR) опубликовали новые классификационные критерии СКВ (табл. 2) [24, 25], превосходящие по чувствительности и специфичности те критерии, которые были разработаны ранее (ACR — в 1997 году [26] и SLICC — в 2012 году [27]). Классификационные критерии успешно используются в реальной практике для постановки диагноза. Благодаря их применению время с момента появления первого симптома до подтверждения диагноза СКВ прогрессивно сократилось: с 59 месяцев в период до 1980 года до 9 месяцев после 2000 года [28].
Таблица 2
Классификационные критерии системной красной волчанки (СКВ) EULAR/ACR 2019 года [24]
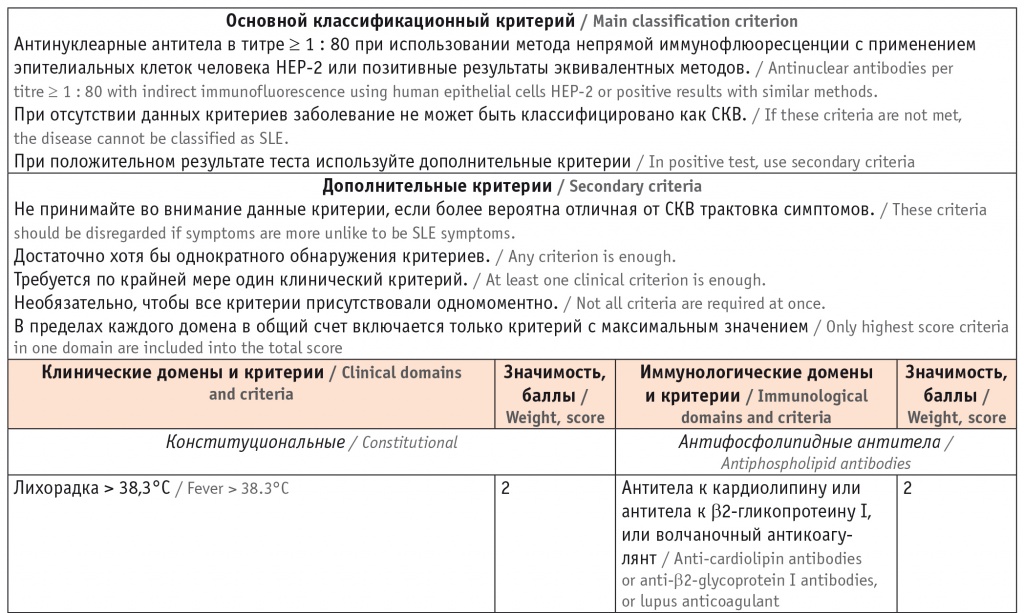
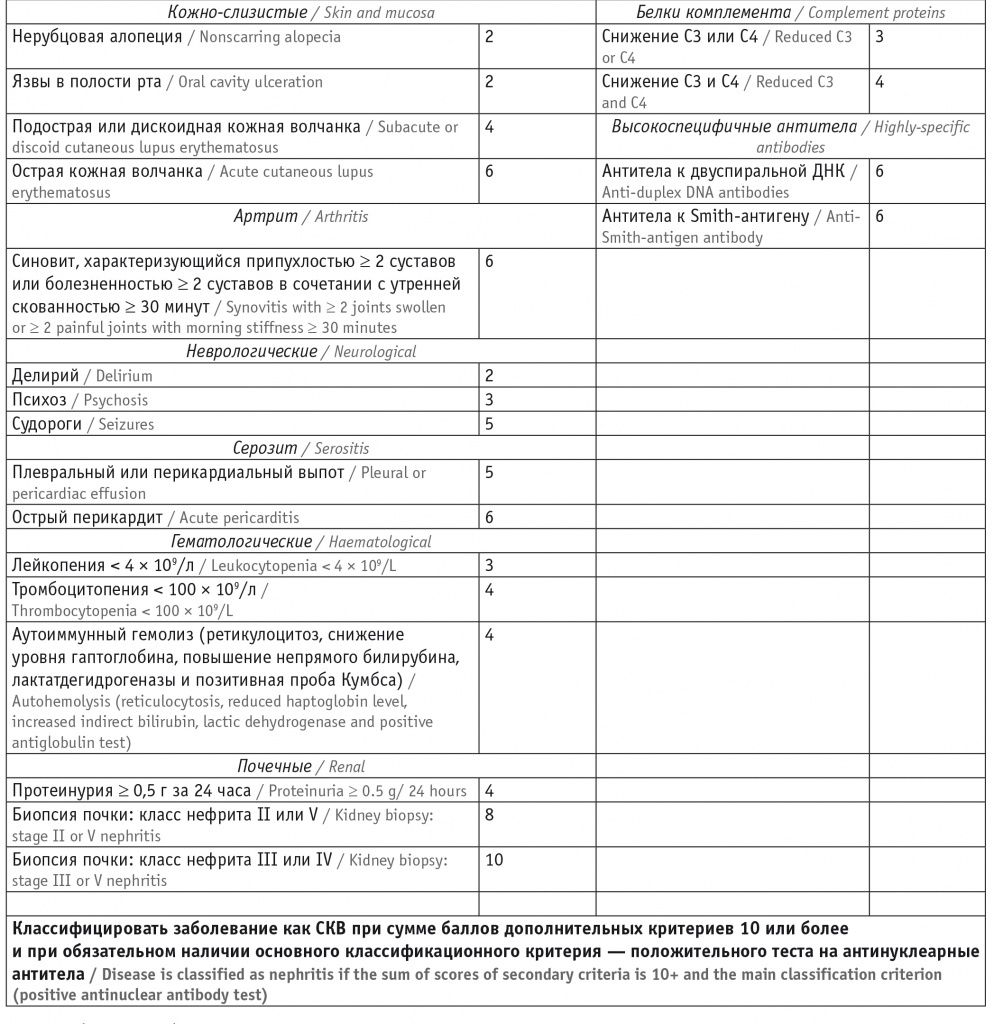
С какими трудностями можно столкнуться при диагностике СКВ? Во-первых, крайне редко, но все же могут встречаться АНА-негативные формы СКВ. Во-вторых, на ранней стадии болезни может отсутствовать необходимое для диагностики количество клинических и лабораторных признаков, характерных для СКВ.
В критериях EULAR/ACR 2019 года указано, что положительный тест на АНА/АНФ — это главный показатель для постановки диагноза СКВ, что является важнейшим отличием этих критериев от предыдущих. Негативный результат этого теста исключает диагноз [24, 25]. Однако важно учитывать сопутствующие заболевания. Например, повышение титров АНФ в сочетании хотя бы с одним из следующих признаков: артритом/артралгиями, кожной сыпью, алопецией, феноменом Рейно, серозитом, сухим синдромом, — позволяет заподозрить дебют или высокий риск развития в будущем аутоиммунного ревматического заболевания. И, напротив, положительный тест на АНФ в отсутствие перечисленных симптомов, вероятнее всего, связан с наличием других заболеваний (аутоиммунного тиреоидита, гепатита и др.), с использованием некоторых лекарственных препаратов или с бессимптомным носительством (по некоторым данным, частота выявления АНФ у здоровых людей может достигать 20% [29]). Нормальное содержание АНФ среди пациентов с СКВ крайне редко определяется в дебюте болезни (0,5% [30]) и относительно редко (5–20%) — в последующие годы вследствие влияния интенсивной терапии и/или особенностей методик исследования [29]. Некоторые исследователи рекомендуют увеличить титр, позволяющий зафиксировать позитивность по АНФ, с ≥ 1/80 до > 1/160 с целью повышения его диагностической значимости как основного входящего критерия [31]. Мы поддерживаем данную рекомендацию, учитывая, что АНФ в титре > 1/160 в здоровой популяции встречается гораздо реже, чем в титре ≥ 1/80 (соответственно в 5% и 20% случаев) [32, 33].
Следует иметь в виду, что упомянутые критерии СКВ классификационные, а не диагностические, и выполнение всех условий не является строгой необходимостью для постановки диагноза. В тех очень редких случаях, когда у пациента присутствуют специфические для СКВ клинические и иммунологические нарушения при отрицательном значении АНФ, целесообразно в качестве основного критерия EULAR/ACR 2019 года для постановки диагноза применить гипокомплементемию или позитивность по аФЛ [3] или использовать критерии SLICC 2012 года, в которых положительный тест на АНФ не является обязательным условием диагностики СКВ.
Вторая отличительная особенность критериев EULAR/ACR 2019 года — это градация каждого клинического и лабораторного показателя по его диагностической значимости. Максимальные баллы (от 10 до 6) имеют гистологически подтвержденный волчаночный нефрит (ВН), острый перикардит, синовит двух и более суставов, острая кожная волчанка, позитивность по анти-дс-ДНК, анти-Sm [24]. Подобная оценка способствует ранней диагностике болезни, так как при позитивности по АНФ наличие даже одного (ВН III или IV классов) или двух значимых признаков позволяет установить диагноз СКВ.
При подозрении на раннюю СКВ (медиана длительности — 48 месяцев) критерии EULAR/ACR 2019 года демонстрируют большую специфичность и дают меньше ложноположительных результатов (табл. 3) [34].
Таблица 3
Сравнение чувствительности и специфичности классификационных критериев у пациентов с ранней системной красной волчанкой [34]

На наш взгляд, одновременное использование комбинации критериев с наибольшей чувствительностью и специфичностью — EULAR/ACR 2019 года и SLICC 2012 года — сводит к минимуму возможность диагностической ошибки даже на ранней стадии болезни.
В реальной клинической практике при диагностике и мониторинге больных СКВ необходимо обратить внимание на следующее:
-
повторный тест на АНА/АНФ при его положительном результате нецелесообразен;
-
нет необходимости в частом контроле серологических биомаркеров, специфичных для СКВ, при низкой активности и/или ремиссии;
-
обязательно исследование анализов мочи в рутинном лабораторном контроле;
-
не следует относить все симптомы к проявлениям СКВ, необходимо исключать другие причины, не связанные с СКВ (инфекции, новообразования и др.).
ЭНДОТИПЫ И ОРГАНО-ДОМИНАНТНАЯ СИСТЕМНАЯ КРАСНАЯ ВОЛЧАНКА
СКВ отличается многообразием симптомов. Течение болезни, тактика лечения и прогноз различаются в зависимости от формы болезни. В связи с этим некоторые исследователи предлагают ввести понятие «эндотипов» СКВ, включающих ювенильную СКВ с дебютом в детском возрасте, СКВ с преобладающим поражением определенных органов и систем (например, суставную, почечную, неврологическую, гематологическую формы), СКВ в сочетании с антифосфолипидным синдромом или СКВ с синдромом Шегрена [3]. Ювенильная СКВ развивается, как правило, остро, характеризуется высокой активностью в дебюте, приводящей к накоплению повреждений и требующей агрессивной терапии. Наличие антифосфолипидного синдрома сопряжено с риском нервно-психических нарушений, тромботических и акушерских осложнений [13].
КЛИНИЧЕСКОЕ ТЕЧЕНИЕ БОЛЕЗНИ И ФАКТОРЫ НЕБЛАГОПРИЯТНОГО ПРОГНОЗА
Согласно результатам многолетнего проспективного когортного исследования (n = 267), длившегося ≥ 10 лет, активность СКВ распределялась следующим образом: большинство пациентов (68%) имели интермиттирующее течение (чередование обострений с ≥ 2 периодами ремиссии), 10% больных достигли длительной ремиссии, 9% имели персистирующе активное проявление болезни, 13% — «гибридное» (обострения в сочетании с одним периодом ремиссии) [35]. В итальянской когорте больных (n = 224) длительная ремиссия встречалась в 37% случаев, наличие васкулита, гломерулонефрита, гематологических нарушений осложняет достижение этого состояния [36]. К факторам, определяющим тяжелое течение СКВ, относят ювенильное начало, мужской пол, позитивность по аФЛ, гипокомплементемию, высокий «интерфероновый профиль», умеренную и высокую активность болезни [13] (рассчитанную с использованием валидированных индексов активности — The Systemic Lupus Erythematosus Disease Activity Index (SLEDAI) [37] и его модификаций — SELENA [38] и 2К [8]; The British Isles Lupus assessment Group Index (BILAG) [39]). Указанные шкалы применяются для глобальной общей оценки состояния больного СКВ, но могут использоваться и органоспецифические индексы, оценивающие степень поражения и/или улучшения функции определенного органа, например при нефрите или поражении кожи.
После непрерывной двухлетней ремиссии прекращается накопление необратимых органных повреждений [36], оцениваемых с помощью Silt Density Index (SDI) [9]. Его повышенное значение ассоциировано с неблагоприятным исходом и смертью. SDI — это единственный на сегодня валидированный и простой в использовании инструмент широкого диапазона для мониторинга осложнений в органах и системах или их дисфункций при СКВ. На его уровень влияет активность СКВ, сопутствующие заболевания и терапия в первую очередь глюкокортикоидами. При максимальном счете в 46 баллов даже небольшое повышение SDI имеет клиническое и прогностическое значение, отражающее тяжесть заболевания [40].
Применение любого из индексов активности при каждом визите пациента и определение SDI ежегодно рекомендовано EULAR [40, 41] и Ассоциацией ревматологов России [1], калькуляторы доступны в онлайн режиме1, 2.
Последние 30 лет в клинических исследованиях лекарственных препаратов (порядка 40 наименований) для лечения СКВ оценку эффективности проводили с помощью глобальных индексов, в то время как в более успешных испытаниях раннего периода ответ на лечение измеряли органоспецифическими критериями [3]. Возможно, в будущем стоит заменить глобальные индексы на органоспецифические или внедрить новые улучшенные варианты (строго определить критерии ремиссии и низкой активности заболевания).
ЛЕЧЕНИЕ
В 2019 году были обновлены рекомендации EULAR по лечению и мониторингу пациентов с СКВ [40, 41] и сформулированы основные цели терапии — достижение длительной выживаемости, предупреждение необратимых органных повреждений и улучшение качества жизни больных.
Основные рекомендации (рис. 4):
-
лечение при СКВ должно быть направлено на достижение ремиссии или минимальной активности заболевания и предотвращение обострений;
-
при отсутствии противопоказаний гидроксихлорохин рекомендуется назначать всем пациентам в дозе, не превышающей 5 мг/кг в сутки;
-
для поддерживающей терапии следует использовать минимально возможную дозу глюкокортикоидов (≤ 7,5 мг/сут в пересчете на преднизолон);
-
своевременное назначение иммуносупрессантов (метотрексата), азатиоприна, микофенолата мофетила приводит к стероидсберегающему эффекту, позволяющему снизить дозу глюкокортикоидов до минимально эффективной или отменить их совсем;
-
при персистирующе активном течении заболевания или при частых обострениях следует рассмотреть белимумаб как дополнительное средство;
-
ритуксимаб и циклофосфамид могут быть использованы при рефрактерном течении заболевания;
-
следует опираться на схемы лечения кожных, нервно-психических, гематологических и почечных проявлений;
-
у всех пациентов с СКВ следует определять уровень аФЛ, оценивать профиль риска инфекционных и сердечно-сосудистых заболеваний; все профилактические мероприятия необходимо проводить соответствующим образом.
Рис. 4. Терапия системной красной волчанки согласно рекомендациям European League Against Rheumatism (EULAR) 2019 года: дополнительные методы коррекции, основные препараты, цель терапии [40].
Примечание. АД — артериальное давление, АЗА — азатиоприн, аФЛ — антитела к фосфолипидам, БЛ — белимумаб, в/в ― внутривенное введение, в/м — внутримышечное введение, ГК — глюкокортикоиды, ГХ — гидроксихлорохин, ИК — ингибиторы кальциневрина, ММФ — микофенолата мофетил, МТ — метотрексат, ПЗ — преднизолон, РА — ревматоидный артрит, РТМ — ритуксимаб, СКВ — системная красная волчанка, ЦФ — циклофосфамид; SLEDAI, BILAG — глобальные индексы активности СКВ

ВОЛЧАНОЧНЫЙ НЕФРИТ
Тяжелый ВН развивается в 20% случаев у больных СКВ. К факторам риска ВН относят юный возраст дебюта, мужской пол, выраженные серологические нарушения, умеренную и высокую активность внепочечных проявлений СКВ. Факторы риска терминальной почечной недостаточности (ТПН) при ВН — мужской пол, АГ, повышенный исходный уровень креатинина, индексов активности и хронизации при гистологическом исследовании почечного биоптата, отсутствие поддерживающей иммуносупрессивной терапии. В последние годы выживаемость больных без ТПН в течение 20 лет возросла с 80% до 90% главным образом благодаря широкому распространению ранней диагностической нефробиопсии и своевременному назначению иммуносупрессантов [42].
В обновленных рекомендациях EULAR/European Renal Association — European Dialysis and Transplant Association (ERA-EDTA) 2019 года были выдвинуты цели терапии ВН: к 3-му месяцу лечения снижать протеинурию до ≥ 25% при стабильной скорости клубочковой фильтрации (СКФ) (± 10% от исходного уровня), к 6-му месяцу — до ≥ 50% и к 12–24 месяцам терапии достигать протеинурии уровня < 0,5–0,7 г/сут (при стабильной СКФ) [40].
При активном пролиферативном гистологически подтвержденном ВН лечение состоит из двух фаз: индукционной (начальной) и поддерживающей (продолжительной). Микофенолата мофетил (2–3 г/сут) и циклофосфамид (по 500 мг в/в каждые 2 недели в течение 3-х месяцев) в сочетании с глюкокортикоидами (пульс-терапия метилпреднизолоном, преднизолоном перорально в дозе 0,3–0,5 мг/кг/сут) — препараты выбора для индукционной фазы. Комбинация микофенолата мофетила с ингибиторами кальциневрина или высокодозный режим введения циклофосфамида (в/в в дозе 0,5–1 г/м2 раз в месяц в течение 6 месяцев в сочетании с преднизолоном перорально по 0,7–1,0 мг/кг/сут) — альтернативная схема лечения ВН с протеинурией нефротического уровня и неблагоприятными прогностическими факторами ТПН. В течение поддерживающей длительной фазы терапии применяется ММФ (1–2 г/сут) или азатиоприн (1,5–2 мг/кг/сут) [40].
НЕРВНО-ПСИХИЧЕСКИЕ ПРОЯВЛЕНИЯ
Нейропсихические нарушения при СКВ (НПСКВ) разнообразны, среди них наиболее частыми являются судороги, цереброваскулярные нарушения и когнитивная дисфункция. Риск ишемического инсульта повышен более чем в 2 раза по сравнению с общей популяцией, и чаще всего инсульт происходит в первый год после постановки диагноза СКВ. Важно отметить, что 60% инсультов возникает на фоне высокой общей активности СКВ [3]. Диагностика НПСКВ требует междисциплинарного подхода для исключения сходных состояний, вызванных другими заболеваниями (инфекциями, опухолями, метаболическими нарушениями и др.). Необходимо учитывать факторы, характерные как для НПСКВ (тип и сроки манифестации, экстраневрологические проявления активности СКВ, аномальные изменения при нейровизуализации и исследовании спинномозговой жидкости, а также позитивность по аФЛ), так и для альтернативных диагнозов [41]. Лечение НПСКВ зависит от того, какой патофизиологический механизм лежит в основе этих нарушений: воспалительный или тромботический/ишемический [43]. В первом случае назначают глюкокортикоиды и иммуносупрессанты, во втором — антитромботические препараты (антикоагулянты, антиагреганты). Различия между двумя патофизиологическими процессами трудно четко дифференцировать, у некоторых пациентов они могут встречаться одновременно, в такой ситуации необходимо назначить сочетание иммуносупрессивной и антитромботической терапий [43].
Пациентам с СКВ и цереброваскулярным поражением проводят обследование и лечение в соответствии с рекомендациями, разработанными для острой фазы цереброваскулярных заболеваний в общей популяции. Дополнительно осуществляют контроль экстраневрологических проявлений СКВ. Целесообразность иммуносупрессивной терапии в этих случаях можно рассматривать при нормальных значениях аФЛ, отсутствии факторов риска атеросклероза (то есть в отсутствие факторов риска тромбозов) или при рецидивирующих цереброваскулярных событиях. Симптоматическая терапия показана при определенных типах психических расстройств: антипсихотики — при психозе, анксиолитики — при тревожных расстройствах и т. п. [40]
ГЕМАТОЛОГИЧЕСКИЕ НАРУШЕНИЯ
При СКВ часто встречаются аутоиммунные цитопении. Это гематологические проявления, требующие иммуносупрессивной терапии, — аутоиммунная тромбоцитопения и гемолитическая анемия [40]. При сочетании тромбоцитопении с анемией необходимо проводить обязательное цитологическое исследование мазка периферической крови на предмет выявления шизоцитов (фрагментированных эритроцитов) для исключения микроангиопатической гемолитической анемии (МАГА) и тромботической микроангиопатии (ТМА). МАГА характеризуется неиммунным (реакция Кумбса отрицательная) внутрисосудистым гемолизом, вызванным механическим разрушением эритроцитов при взаимодействии с поврежденным эндотелием. ТМА — синдром, включающий тромботическую тромбоцитопеническую пурпуру (ТТП) (дефицит ADAMTS13, или ADAM-протеаз, A disintegrin and metalloproteinase with a thrombospondin type 1 motif, member 13) и МАГА в сочетании с тромбоцитопенией и повреждением внутренних органов вследствие тромбоза артериол и капилляров. Не всегда МАГА сопровождается ТМА, но всегда ТМА характеризуется МАГА и тромбоцитопенией. Сочетание СКВ с ТТП встречается редко в отличие от сочетания СКВ с ТМА/МАГА. При МАГА использование иммуносупрессантов демонстрирует положительный эффект, не требующий плазмафереза, развитие ТМА при СКВ сопряжено с его обязательным применением [3].
Синдром активации макрофагов — редкое, но потенциально фатальное осложнение СКВ, проявляющееся фебрильной лихорадкой, панцитопенией, коагулопатией, нарушением функции печени и центральной нервной системы, имитирующее обострение СКВ, может рецидивировать у 10% больных. Препаратами первой линии терапии являются высокие дозы глюкокортикоидов, внутривенный человеческий Ig, циклофосфамид, ритуксимаб, этопозид [44].
ПОРАЖЕНИЕ СЕРДЦА
Самым частым проявлением поражения сердца является перикардит, реже встречаются клапанные нарушения и еще реже — миокардит [45]. Согласно собственным данным (n = 87), патология перикарда была обнаружена у 45% пациентов (преобладал адгезивный перикардит, у 62%); недостаточность клапанов с разной степенью регургитации, не требующая хирургической коррекции, — у 92%; эндокардит — у 30%; пролапс створок митрального или трикуспидального клапанов — у 33% пациентов; миокардит — у 5% больных СКВ. Применение высокочувствительных тропониновых тестов и МРТ с парамагнитным контрастным усилением (информативный метод визуализации очагов воспаления в миокарде, повреждения и некроза миоцитов) позволяет в последние годы диагностировать миокардит чаще [46].
Легочная АГ — редкое, но серьезное осложнение СКВ. Выделяют два фенотипа: васкулопатический с низкой активностью СКВ («чистая легочная АГ») и васкулитический тип с высокой общей активностью СКВ. Последний более чувствительный к иммуносупрессивной терапии [47]. При СКВ может встречаться вторичная легочная АГ, обусловленная тромбоэмболическими осложнениями или возникшая на фоне интерстициального поражения легких [45].
Антималярийная кардиомиопатия — малоизученное и крайне редко встречающееся осложнение длительного приема антималярийных препаратов, представляющее собой гипертрофическую рестриктивную кардиомиопатию с нарушениями проводимости сердца или без них [48].
КОМОРБИДНОСТЬ
Риск инфекций при СКВ ассоциирован как с самой болезнью (вследствие высокой активности, тяжелой лейкопении; вследствие ВН, сопровождающегося гипогаммаглобулинемией при нефротическом синдроме), так и с лекарственными препаратами (с высокими дозами глюкокортикоидов, циклофосфамида, микофенолата мофетила и ритуксимаба) независимо друг от друга. Меры по защите от инфекционных осложнений должны осуществляться очень активно, они включают в себя как первичную профилактику (сезонную иммунизацию против вируса гриппа и пневмококковой инфекции вне обострения и высокой активности болезни), так и своевременную диагностику с адекватной терапией. Следует обратить внимание на уровень СРБ: его повышение с большей вероятностью ассоциировано с присоединением бактериальной инфекции, нежели с обострением СКВ [49].
Повышение риска ССЗ при СКВ может быть обусловлено как традиционными кардиоваскулярными факторами риска, так и факторами, связанными с самим заболеванием (активностью болезни, ВН, aФЛ и использованием глюкокортикоидов) [50]. Основанием для назначения статинов может быть дислипидемия в сочетании с другими традиционными факторами риска. Риск развития сердечно-сосудистых осложнений у пациентов с СКВ недооценивается. Рекомендуют рассчитывать 10-летний риск ССЗ с использованием шкалы Systematic COronary Risk Evaluation (SCORE) [51].
Поддержание уровня АД < 140/90 мм рт. ст. при почечной дисфункции может снизить риск сосудистого события. У пациентов с уже имеющимися клиническими проявлениями ССЗ или высоким значением SCORE (> 10%) целевые уровни АД должны быть < 130/80 мм рт. ст. и < 120/80 мм рт. ст.; для этих целей обязательно использование ингибиторов ренин-ангиотензин-альдостероновой системы [52].
У пациентов с СКВ повышен риск злокачественных новообразований легких, щитовидной железы, печени, шейки матки, снижен в отношении рака молочной и предстательной желез. Риск развития лимфом превышен в 3 раза, ассоциирован с активностью многочисленных цитокинов и вирусными инфекциями [53].
ВЗГЛЯД В БУДУЩЕЕ
Модифицирующие болезнь традиционные и биологические препараты, применяемые в качестве монотерапии, комбинации или используемые последовательно, позволили гораздо чаще достигать целей лечения, включая минимизацию дозы глюкокортикоидов и снижение частоты необратимых органных повреждений (измеряемых по шкале SDI). В исследовании AURA-LN обнадеживающие результаты показала мультитаргетная терапия с использованием комбинации ингибитора кальциневрина (воклоспорина) и микофенолата мофетила в индукционную фазу лечения ВН [54]. Применение белимумаба снижает значение SDI при долгосрочном наблюдении и демонстрирует положительный эффект в лечении ВН [55, 56]. Введение анифролумаба (человеческого моноклонального антитела к субъединице 1 рецептора интерферона I типа) не привело к достижению конечной точки в исследовании TULIP-1, но позволило уменьшить общую активность СКВ, по шкале BILAG, в исследовании TULIP-2 [57]. В настоящее время ученые исследуют эффективность низких доз IL-2 для усиления регуляторной функции Т-клеток [58]. Для будущих клинических исследований обсуждается целесообразность выделения эндотипов СКВ с преимущественным поражением определенных органов и систем и применением органоспецифических шкал оценки активности и исхода [3].
ЗАКЛЮЧЕНИЕ
Таким образом, проблема ранней диагностики и прогнозирования течения СКВ продолжает оставаться одной из центральных в современной ревматологии. Разработка рекомендаций по лечению и их внедрение в клиническую практику могут улучшить результаты терапии этого заболевания и его исход.
Поступила: 15.03.2021
Принята к публикации: 06.06.2021








