Бронхиальная астма (БА) — одно из самых распространенных хронических воспалительных заболеваний органов дыхания в детском возрасте, приводящее к ранней инвалидизации[1–3]. Несмотря на успехи, достигнутые в изучении патогенеза БА, многие этапы формирования и модификации течения этого заболевания в настоящее время не совсем ясны. Вероятно, отсутствие адекватного контроля БА обусловлено особенностями эндогенной регуляции, осуществляемой цитокинами — модификаторами как неспецифических воспалительных процессов, так и антигенспецифического иммунного ответа[4–7]. Отсутствие адекватного лечения БА в детском возрасте с годами приводит к прогрессированию заболевания. У взрослого человека уже отмечаются учащенные приступы удушья, переходящие в астматический статус, появляются признаки дыхательной недостаточности, наблюдаются осложнения со стороны других систем организма.
Общепринятой считается теория, согласно которой аллергические заболевания обусловлены нарушением регуляции в иммунной системе, связанной с активацией аллергенспецифичных клонов Тлимфоцитовхелперов, называемых Тхелперами 2го типа (Th2). Функциональная активность Th2 связана с секретируемыми ими цитокинами, в основном с ИЛ4, ИЛ5, ИЛ10, ИЛ13[8–10]. Цитокины Тh2лимфоцитов поддерживают биосинтез иммуноглобулина Е и некоторых других иммуноглобулинов (гуморальный иммунный ответ), а также участвуют в развитии аллергического воспаления, активируя тучные клетки и эозинофилы[11, 12].
Безусловно, существует необходимость в дальнейшем изучении особенностей цитокинового статуса, направленном на выявление маркеров персистирующего воспаления дыхательных путей при атопической бронхиальной астме (АБА), для достижения контроля над заболеванием.
Цель исследования: определить содержание медиаторов воспаления (ИЛ2, ИЛ4, ИЛ10, ФНОα) при АБА у детей с позиции контроля над течением болезни.
МАТЕРИАЛЫ И МЕТОДЫ
Работа проведена на базе детского аллергологического отделения Красноярской краевой клинической больницы. В соответствии с поставленной целью выделены группы исследования: первая — больные среднетяжелой АБА с контролируемым течением заболевания (КАБА, n = 59, средний возраст — 12,5 ± 1,60 года), вторая — больные среднетяжелой АБА с неконтролируемым течением заболевания (НАБА, n = 51, средний возраст — 13,1 ± 2,77 года). Контрольную группу составили практически здоровые дети без признаков атопии в личном и семейном анамнезе (n = 33, средний возраст — 13,6 ± 2,54 года).
Диагноз, степень тяжести, уровень контроля над течением заболевания устанавливали в соответствии с рекомендациями, изложенными в докладе рабочей группы Global Initiative for Asthma (GINA) 2015 г. Все дети, больные АБА, на протяжении трех последних месяцев получали монолечение или комбинированную базисную терапию в высоких/среднетерапевтических дозах.
Концентрации цитокинов (ИЛ2, ИЛ4, ИЛ10, ФНОα) в сыворотке крови определяли путем твердофазного ИФА с помощью тестсистем ЗАО «ВекторБест» (г. Новосибирск).
Уровни цитокинов анализировали с позиций перцентильных величин для каждого цитокина. Значения концентраций были разделены на ранги: «низкие» (ниже 10го перцентиля), «ниже среднего» (10–25й перцентили), «средние» (25–75й перцентили), «выше среднего» (75–90й перцентили) и «высокие» (выше 90го перцентиля).
Для оценки диагностической значимости уровней цитокинов в сыворотке крови определяли диагностическую чувствительность (ДЧ) — долю лиц с положительным результатом анализа среди больных с изучаемым симптомокомплексом; диагностическую специфичность (ДС) — долю лиц с отрицательным результатом теста в контрольной группе; диагностическую эффективность (ДЭ) — среднее между ДЧ и ДС; прогностическую ценность положительных результатов (ПЦПР) и прогностическую ценность отрицательных результатов (ПЦОР).
Статистическую обработку полученных данных проводили на персональном компьютере AMD Athlon. По результатам исследования в пакете электронных таблиц MS Excel 2003 была сформирована база данных, на основе которой с помощью статистических пакетов прикладных программ Windows XP Professional версии 2002 (service pack 2) и Statistica 8.0 выполняли статистический анализ. Для описания количественных данных, не подчиняющихся нормальному закону распределения, применяли непараметрический Uкритерий Манна — Уитни. Данные в таблицах и тексте представлены в виде медианы и 25го и 75го квартилей (Me [C25; C75]). При проверке статистических гипотез о существовании различий между показателями разных групп критический уровень значимости (p) принимали равным 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Анализ показал увеличение концентраций цитокинов (ИЛ2, ИЛ4, ИЛ10, ФНОα) при АБА по сравнению с контрольной группой независимо от уровня контроля над течением заболевания (табл. 1). С целью определения предикторов неконтролируемого течения болезни был проведен сравнительный анализ концентраций цитокинов в сыворотке крови при наличии и отсутствии контроля над течением АБА (см. табл. 1).
Таблица 1
Концентрации цитокинов в сыворотке крови у детей, больных атопической бронхиальной астмой, при наличии и отсутствии контроля над течением заболевания, пг/мл (Ме [С25; С75])
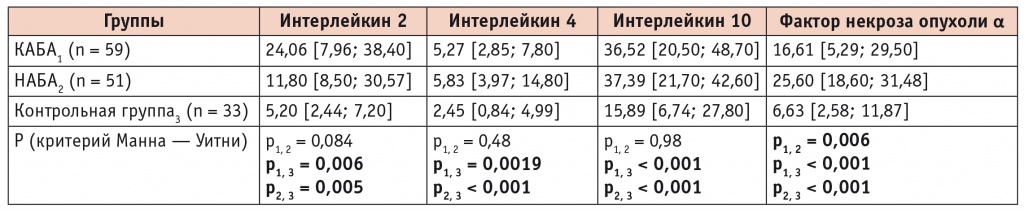
Примечание. Здесь и в последующих таблицах и диаграммах КАБА и НАБА — контролируемая и неконтролируемая атопическая бронхиальная астма соответственно.
Уровни воспалительных цитокинов в целевых и контрольной группах оценивались по медиане и интерквартильному размаху. В связи с высокой вариабельностью значений медиан в целевых группах статистически значимых различий выявить не удалось, поэтому был проведен анализ уровней цитокинов в сыворотке крови с позиций перцентильных величин для каждого цитокина (табл. 2).
Таблица 2
Концентрации цитокинов для каждого перцентиля при атопической бронхиальной астме контролируемого и неконтролируемого течения, пг/мл
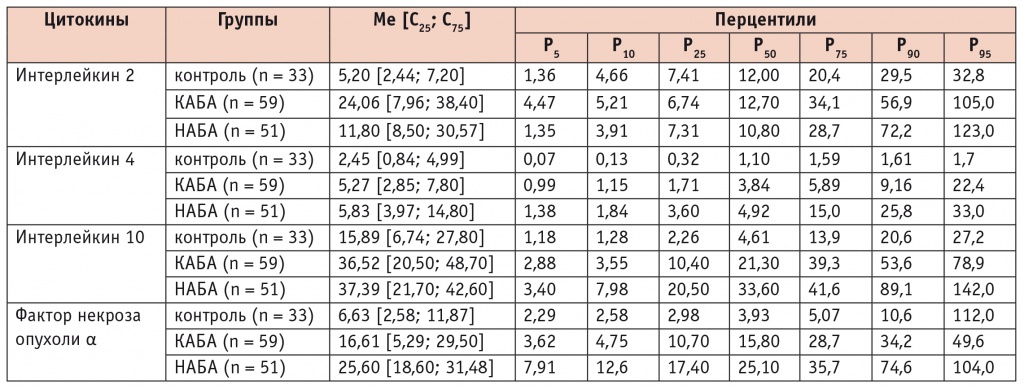
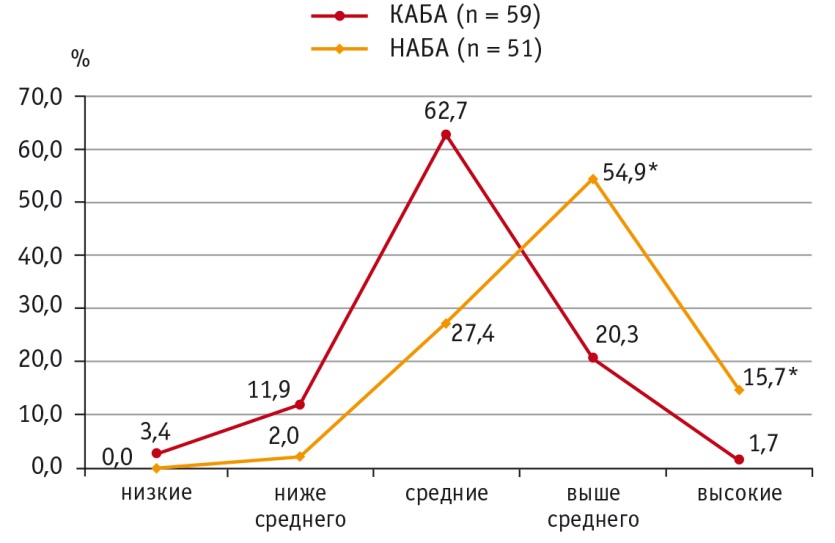
Исследование результатов показало, что высокие (выше 90го перцентиля) концентрации ИЛ4 в группе с неконтролируемым течением болезни имеются у 8 (15,7%) пациентов против 1 (1,7%) больного в группе контролируемого течения АБА (р < 0,001). Аналогичные результаты получены при оценке частоты концентраций ИЛ4 выше среднего (75–90й перцентили) в группах НАБА и КАБА: 28 (54,9%) и 12 (20,3%) соответственно (р < 0,001) (рис. 1).
Рис. 1. Уровни распределения интерлейкина 4 в сыворотке крови при контролируемом и неконтролируемом течении атопической бронхиальной астмы, %.
* P < 0,001
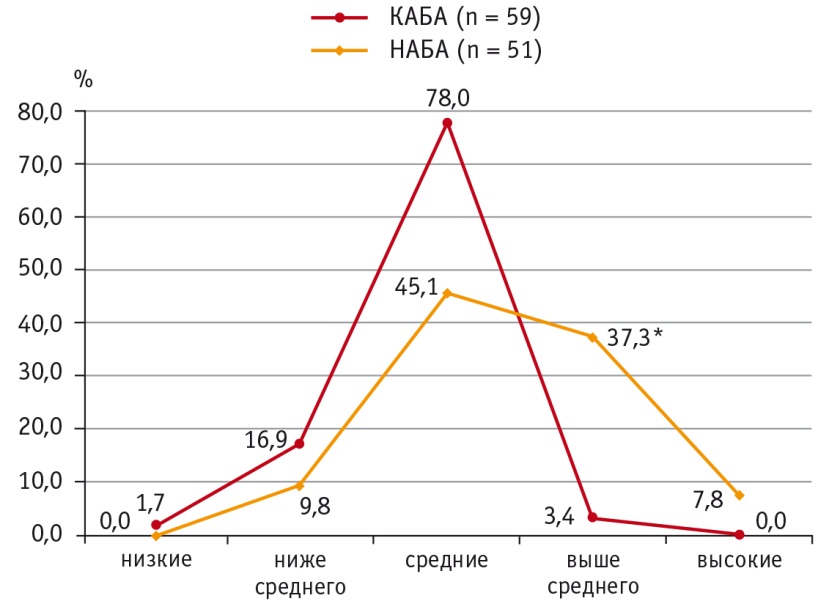
Распределение пациентов с учетом концентрации ИЛ10 в пределах перцентильных величин выявило, что концентрации ИЛ10 выше среднего (75–90й перцентили) в сыворотке крови чаще встречаются при НАБА (37,3%, n = 19), чем при КАБА (3,4%, n = 2), р < 0,05 (рис. 2). Статистически значимых различий в других рангах перцентилей не было.
Рис. 2. Уровни распределения интерлейкина 10 в сыворотке крови при контролируемом и неконтролируемом течении атопической бронхиальной астмы, %.
* P < 0,05
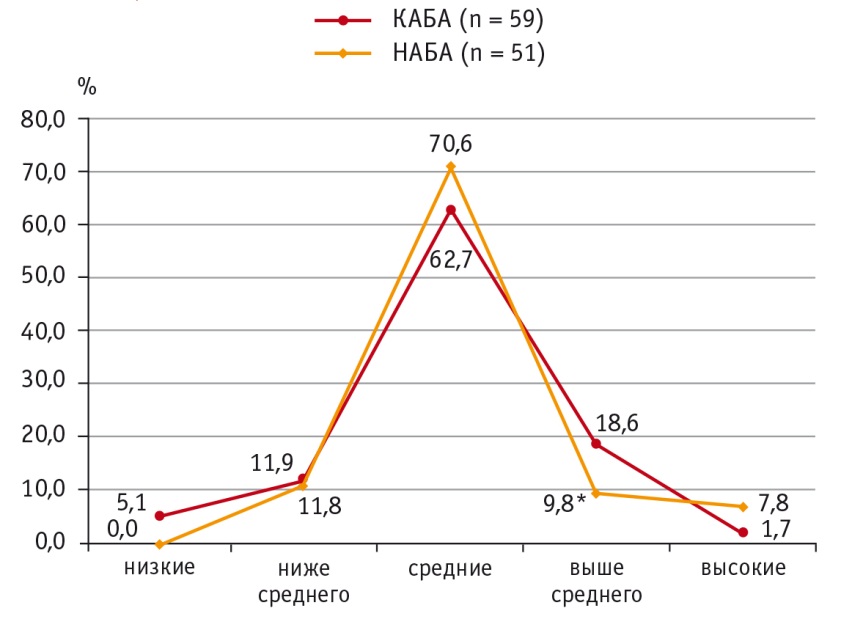
Распределение больных АБА с учетом значений концентрации ИЛ2 в пределах перцентильных величин показало, что при НАБА уровни ИЛ2 выше среднего (75–90й перцентили) в сыворотке крови встречаются реже, чем при КАБА: в первом случае показатель составил 5 (9,8%), во втором — 11 (18,6%), р = 0,03. Выявлено также, что высокие (выше 90го перцентиля) концентрации ИЛ2 при неконтролируемой астме имеются у 4 (7,8%) пациентов против 1 (1,7%) в группе контролируемого течения болезни, но эти различия статистически незначимы (р = 0,68) (рис. 3).
Рис. 3. Уровни распределения интерлейкина 2 в сыворотке крови при контролируемом и неконтролируемом течении атопической бронхиальной астмы, %.
* P = 0,03
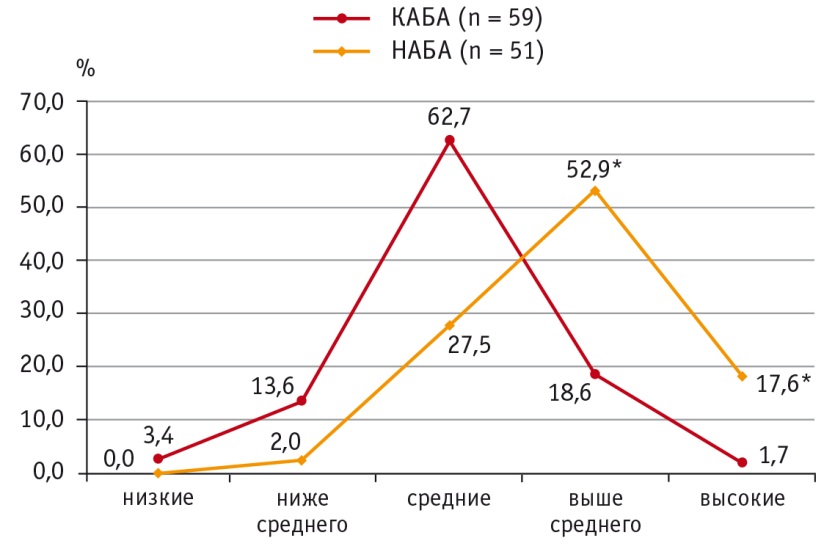
Распределение больных АБА с учетом концентрации ФНОα в пределах перцентильных величин показало, что при НАБА уровни ФНОα выше среднего (75–90й перцентили) в сыворотке крови характерны для большего числа детей, чем при КАБА: 27 (52,9%) против 11 (18,6%) соответственно (р < 0,001). Высокие (выше 90го перцентиля) концентрации ФНОα при неконтролируемой астме выявлены у 9 (17,6%) пациентов против 1 (1,7%) в группе контролируемого течения болезни, эти различия также статистически значимы (р < 0,001) (рис. 4).
Рис. 4. Уровни распределения фактора некроза опухоли α в сыворотке крови при контролируемом и неконтролируемом течении атопической бронхиальной астмы, %.
* P < 0,001
В целях оценки диагностической значимости уровней цитокинов при отсутствии контроля над течением АБА в качестве стандартного метода сравнения были взяты критерии неконтролируемого течения АБА (GINA, 2015).
Расчеты показали, что по уровню ИЛ4 в сыворотке крови ДЧ составляет 85,4%, ДС — 94,9%, ДЭ — 89,1%; при этом ПЦПР и ПЦОР были равны 95,5% и 8,0% соответственно.
По содержанию ИЛ10 в сыворотке крови ДЧ равнялась 92,1%, ДС — 91,5%, ДЭ — 91,8%; для ПЦПР и ПЦОР были получены значения 90,3% и 6,7% соответственно.
Анализ уровня ИЛ2 в сыворотке крови показал, что его ДЧ равна 74,5%, ДС — 79,6%, ДЭ — 77,2%; ПЦПР составила 76,0%, а ПЦОР — 22,0%.
По концентрации ФНОα в сыворотке крови ДЧ составила 89,2%, ДС — 93,2%, ДЭ — 82,8%; при этом показатель ПЦПР был равен 89,7%, а ПЦОР — 22,0%.
ЗАКЛЮЧЕНИЕ
В исследовании продемонстрирована значимость определения концентраций цитокинов в сыворотке крови. Выявлена бо’льшая частота встречаемости повышенных уровней ИЛ4, ИЛ10 и ФНОα при неконтролируемом течении атопической бронхиальной астмы (АБА) у детей, что позволяет рассматривать данные маркеры в качестве дополнительного диагностического теста, отражающего персистенцию воспаления в дыхательных путях при АБА.








