Остеоартроз (ОА) коленных суставов и варикозная болезнь нижних конечностей (ВБНК) — широко распространенные в популяции заболевания[1–4], которые часто наблюдаются одновременно у одного пациента[5, 6]. Поскольку оба заболевания проявляются болевым синдромом в нижних конечностях и функциональными нарушениями, логично предположить, что их сочетание у одного больного может сопровождаться более тяжелой клинической картиной. Более того, существуют обоснованные предположения, что нарушения венозного оттока могут играть патогенетическую роль в развитии ОА коленных суставов[7].
Ранее уже высказывалось мнение о возможном влиянии патологии вен на течение и тяжесть ОА коленных суставов, однако при этом приводились довольно противоречивые данные. Так, в исследовании И. Г. Салихова и соавт.[8] показано, что ОА (олигоартроз или полиартроз) в комбинации с патологией периферических вен нижних конечностей (ВБНК или посттромбофлебитическим синдромом) проявляется более интенсивным болевым синдромом в суставах в покое и при движении, более частыми синовитами коленных суставов и снижением функциональной активности по сравнению с пациентами с ОА без патологии вен. Другим авторам удалось установить ассоциацию ВБНК только с синовитом и более интенсивной болью в суставах в вечернее и ночное время, тогда как функция суставов не была хуже у пациентов с ВБНК[9]. Ранее нами также было проведено сравнительное исследование клинических проявлений гонартроза в зависимости от наличия у пациента ВБНК, однако никаких значимых клинических ассоциаций найти не удалось[10].
Мы предположили, что различия в результатах представленных исследований могут быть обусловлены использованием разных классификационных подходов и методов диагностики патологии вен (клинических и инструментальных), а на тяжесть ОА влияет не столько факт наличия ВБНК, сколько тяжесть поражения вен. Это и определило цель данного исследования: с использованием ультразвукового ангиосканирования провести анализ возможного влияния наличия и тяжести поражения клапанов поверхностных и перфорантных вен нижних конечностей на клинические проявления и тяжесть ОА коленных суставов.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проведено на кафедре профилактической и семейной медицины ФГБОУ ВО «Уральский государственный медицинский университет» (УГМУ) Минздрава России, на базе Городского ревматологического центра Городской клинической больницы № 40 и Европейского медицинского центра «УГМК — Здоровье» г. Екатеринбурга с октября 2010 г. по май 2012 г. Проведение исследования одобрено комитетом по этике УГМУ. В него вошли 62 женщины с ОА коленных суставов. Перед включением в исследование все пациентки подписали информированное согласие.
Критерии включения:
- женский пол;0
- возраст 40–60 лет;0
- наличие ОА коленных суставов в соответствии с клиническими, лабораторными и рентгенологическими критериями Американской ревматологической ассоциации 1986 г.[11].
Критерии исключения:
- указания на перенесенные тяжелые травмы нижних конечностей;
- наличие в анамнезе операций на суставах нижних конечностей;
- перенесенные ранее воспалительные заболевания суставов;
- клинические признаки ОА тазобедренных суставов;
- заболевания позвоночника, сопровождающиеся признаками радикулопатии;
- нейропатическая боль в нижних конечностях;
- тромбоз глубоких вен нижних конечностей в анамнезе или по данным ангиосканирования;
- врожденные аномалии вен нижних конечностей по данным ангиосканирования.
Таким образом, группа была сформирована из женщин с типичным ОА коленных суставов, при этом из исследования исключались пациентки с возможным вторичным ОА коленных суставов, а также женщины, имеющие заболевания, которые могли бы затруднить оценку клинических проявлений ОА коленных суставов и ВБНК.
Всем участницам было проведено клиническое и физикальное обследование с акцентом на опорнодвигательный аппарат и вены нижних конечностей (оценка суставных и венозных жалоб, объективный осмотр коленных суставов и вен нижних конечностей), выполнена рентгенография коленных суставов в двух проекциях с оценкой по I. Kellgren, I. Lawrence (1957). Тяжесть ОА определяли по индексу M. Lequesne[12]. Клиническая оценка патологии вен осуществлялась согласно международной классификации СЕАР[13].
С целью детального изучения состояния вен нижних конечностей было выполнено их ультразвуковое ангиосканирование на аппарате Philips iU 22, измерение диаметров вен производилось в Врежиме, определение рефлюксов — в режиме импульсноволнового доплера и цветного доплеровского картирования.
Обследование проводилось по стандартной методике в положении лежа и стоя с использованием функциональных проб (проб Вальсальвы, компрессионных проб). Определяли проходимость глубоких вен, наличие несостоятельности клапанов всех перфорантных вен нижних конечностей, поверхностных вен — большой (БПВ) и малой (МПВ) подкожных вен, а также степень рефлюксов на БПВ и МПВ. Степень рефлюксов оценивали с использованием классификации Т. Zontsich и М. М. Baldt (2003), которая выделяет 4 степени несостоятельности клапанов на БПВ: 1я степень — рефлюкс регистрируется только в проксимальных отделах бедра, 2я степень — рефлюкс регистрируется до дистальных отделов бедра, 3я степень — рефлюкс распространяется до проксимальных отделов голени, 4я степень — рефлюкс регистрируется на всем протяжении БПВ; а также 3 степени несостоятельности клапанов на МПВ: 1я степень — рефлюкс только в пределах одного клапана МПВ, 2я степень — рефлюкс до середины голени, 3я степень — рефлюкс на всем протяжении МПВ[14].
Перфорантные вены исследовали только на наличие несостоятельности клапанов без оценки степени несостоятельности. При этом для упрощения анализа вся группа перфорантных вен одной конечности оценивалась как одна перфорантная вена. Таким образом, нами были обследованы 6 вен.
При выявлении несостоятельности клапанов на 4 и более из 6 анализируемых вен данные трактовались как генерализованное поражение вен. При обнаружении одного из следующих признаков:
а) рефлюксы 4й (максимальной) степени на БПВ на обеих ногах, б) рефлюксы 3й (максимальной) степени на МПВ на обеих ногах или в) рефлюкс 4й степени на БПВ на одной ноге и рефлюкс 3й степени на МПВ на одной ноге — ультразвуковые изменения трактовались как тяжелое поражение вен.
Статистическая обработка проводилась с помощью программы Statistica 6.0. Количественные признаки при условии нормального распределения сравнивали с использованием теста Стьюдента, количественные ненормально распределенные признаки — с помощью теста Манна — Уитни, качественные бинарные переменные — с помощью 2стороннего точного теста Фишера. Статистически значимыми считались различия при р < 0,05.
РЕЗУЛЬТАТЫ
Клиническая характеристика участниц приведена в таблице 1.
Таблица 1
Характеристика группы пациенток с остеоартрозом коленных суставов
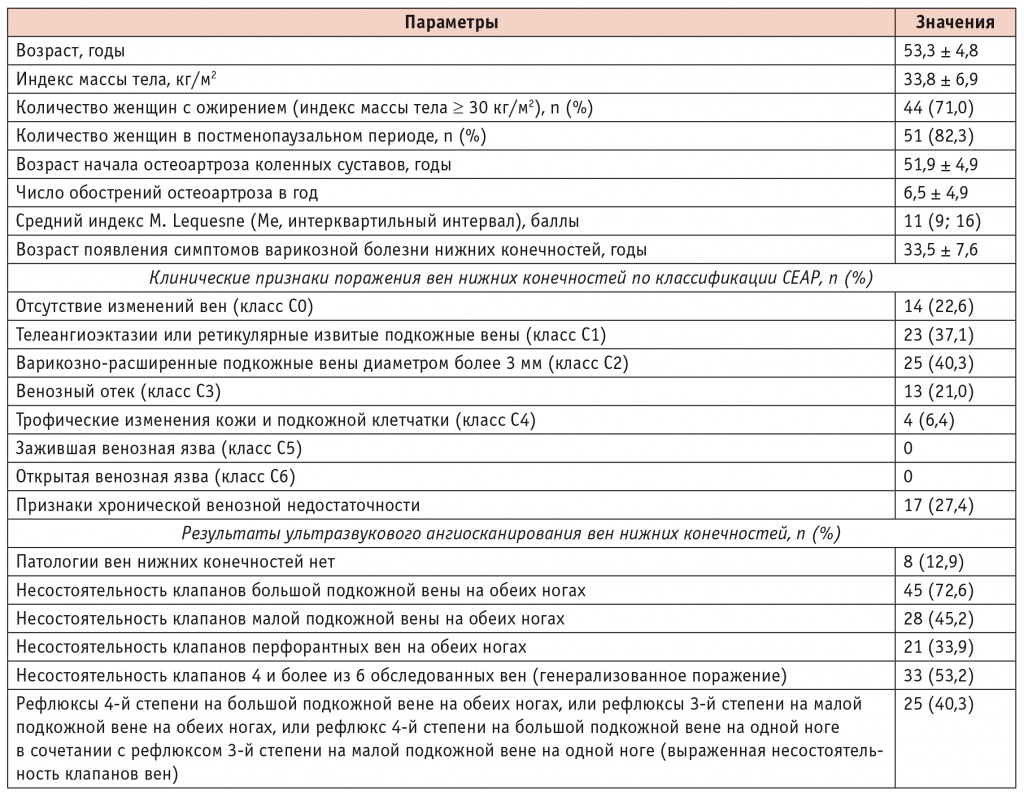
Группа преимущественно состояла из пациенток с ожирением, большинство находились в постменопаузе. Индекс M. Lequesne в обследуемой группе составил 11 баллов, что соответствует значительно выраженному ОА. Клинически наличие варикознорасширенных вен нижних конечностей было определено у 40,3%, а признаки хронической венозной недостаточности (ХВН) — у 27,4% пациенток. По данным анамнеза, дебют ВБНК (женщина самостоятельно заметила варикознорасширенные вены нижних конечностей или они были выявлены врачом) отмечался в среднем на 18 лет раньше, чем ОА коленных суставов.
Ультразвуковое ангиосканирование не выявило патологию вен нижних конечностей только у 8 пациенток с гонартрозом. Сравнительный анализ клинических и демографических данных в зависимости от наличия или отсутствия патологии вен не продемонстрировал никаких значимых различий: группы не отличались по возрасту, ИМТ, возрасту дебюта ОА, частоте обострений (усиление болей, скованности, появление синовита, ограничение функции коленных суставов), по индексу M. Lequesne, а также при осмотре — по таким клиническим проявлениям ОА, как крепитация, скованность, нестабильность в коленных суставах, бурсит, синовит, болезненность при пальпации суставной щели, а также вальгусная/варусная деформация коленных суставов.
Генерализованное поражение вен нижних конечностей (несостоятельность клапанов различной степени на 4 и более из 6 обследованных вен) выявлено у 53,2% пациенток (см. табл. 1). Они также не отличались по клиническим проявлениям и тяжести ОА от остальных участниц. Единственным отличием было то, что в группе с генерализованным поражением вен ИМТ был выше, чем у женщин с менее распространенным поражением вен или его отсутствием (36,2 ± 6,9 кг/м2 против 31,1 ± 5,9 кг/м2; р = 0,003).
Тяжелое поражение БПВ и МПВ хотя бы на одной ноге (рефлюксы на всем протяжении вены) имели 25 человек. По сравнению с группой из 20 пациенток без поражения вен или рефлюксами минимальной (1й) степени на поверхностных венах у них был более высокий ИМТ (37,3 ± 7,2 кг/м2 против 31,3 ± 6,7 кг/м2, р = 0,007), чаще наблюдалось ожирение (21 (84,0%) против 11 (55,0%), р = 0,048), и они были моложе (52,30 ± 5,2 года против 55,6 ± 4,3 года, р = 0,03). Ассоциации тяжелого поражения вен с клиническими проявлениями ОА не было.
Одновременно и генерализованное, и тяжелое поражение вен нижних конечностей наблюдалось у 21 пациентки (основная группа), у 41 при ангиосканировании изменения вен были малыми или отсутствовали (контрольная группа) (табл. 2). Группы не отличались по возрасту, ИМТ, по количеству участниц с ожирением, хотя отмечалась тенденция к более молодому возрасту и более высокому ИМТ в основной группе.
Таблица 2
Сравнительная характеристика пациенток с остеоартрозом коленных суставов в сочетании с тяжелым поражением вен нижних конечностей и женщин с остеоартрозом в сочетании с незначительными изменениями вен или их отсутствием
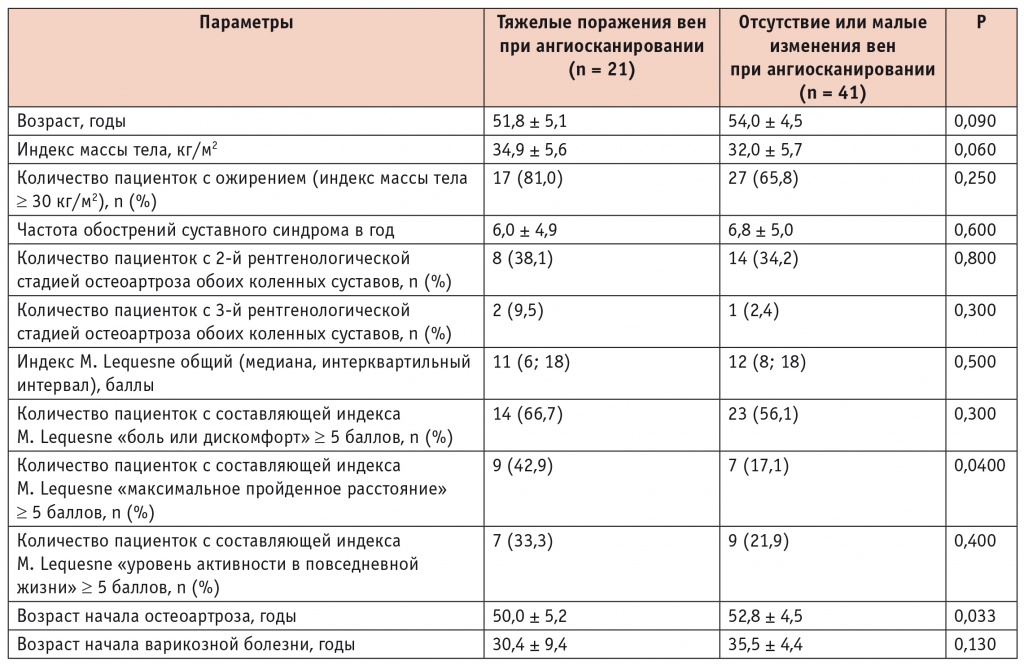
Клинически варикознорасширенные вены нижних конечностей чаще имели пациентки основной группы (71% против 24%, р = 0,0008), по проявлениям ХВН различий не было (38% против 22%, р = 0,2). При сравнении жалоб, типичных для ОА (скованность, хруст или крепитация, нестабильность в суставах), объективных проявлений ОА (пролиферативные изменения, крепитация при пассивных движениях, болезненность суставной щели, бурситы, синовит, киста Бейкера), частоты обострений ОА в год, рентгенологической стадии значимые различия между группами не получены. Тяжесть ОА с оценкой по общему индексу M. Lequesne также не различалась. Однако при сравнении отдельных составляющих индекса M. Lequesne обнаружены различия по показателю «максимальное пройденное расстояние»: в основной группе ≥ 5 из максимально возможных 8 баллов набрали 42,9% пациенток против 17,1% в контрольной группе (р = 0,04). Кроме того, по данным анамнеза, ОА коленных суставов в основной группе дебютировал почти на 3 года раньше, чем в контрольной (р = 0,033). Возраст начала ВБНК в этой группе был на 5 лет меньше, чем в группе без значимой патологии вен, но различие это статистически незначимо.
ОБСУЖДЕНИЕ
Несмотря на высокую распространенность в популяции, ОА остается заболеванием с плохо изученным патогенезом и неясной этиологией. Хотя основное внимание в последние годы обращается на суставной хрящ, а также подлежащую субхондральную кость, интерес к возможной роли сосудистых нарушений, в том числе венозных, в развитии ОА не угасает на протяжении последних десятилетий[15]. Субхондральная кость является богато васкуляризированной тканью, и микрососудистые, преимущественно венозные, поражения этой области известны давно[15]. Поэтому внимание исследователей к изучению сочетанной патологии вполне закономерно, ведь ОА обнаруживается у 65% пациентов с ВБНК[9], а патология вен — у 51% больных ОА[8].
Один из аспектов этой проблемы — возможное усугубление или модификация клинических проявлений ОА при наличии у пациента также признаков патологии вен нижних конечностей. В своем обзоре, посвященном влиянию нарушений венозного оттока на развитие ОА, Э. А. Щеглов и соавт.[7] отмечают связь повышения венозного давления конечности с наличием синовита, ночных суставных болей, функциональной недостаточности и других проявлений ОА. Вместе с тем работ, посвященных анализу влияния клинически манифестной ВБНК на проявления ОА, проведено мало, а результаты их не столь однозначны.
Одной из причин этого может служить выраженный полиморфизм течения и проявлений как ОА, так и патологии вен. Поэтому в отличие от предыдущих работ[8, 9] мы сформулировали жесткие критерии формирования групп с использованием общепринятых диагностических критериев, исключили пациенток с возможным вторичным ОА и состояниями, которые могли бы повлиять на клиническую картину поражения как суставов, так и вен. Поскольку ультразвуковое ангиосканирование является основным диагностическим методом при обследовании пациентов с хроническими заболеваниями вен[14], оно было проведено всем участницам по единому стандартизированному протоколу.
В отличие от других исследователей[8, 9] нам не удалось обнаружить доказательства определенного влияния патологии вен нижних конечностей, выявленной клинически[10] или при ультразвуковом ангиосканировании, на тяжесть и клиническую симптоматику ОА, за исключением статистически значимого влияния генерализованного поражения в сочетании с выраженными степенями несостоятельности клапанов вен на максимально проходимое расстояние по индексу M. Lequesne. Следует подчеркнуть, что синовиты и ночную боль, более высокую частоту которых у пациентов с поражением вен регистрировали ранее другие исследователи, являются субъективными симптомами и могут динамично меняться в течение ОА, что делает их довольно ненадежными параметрами.
В целом вопрос об ассоциации ОА и патологии вен остается открытым, необходимы более крупные группы и проспективное наблюдение. Вместе с тем связь ОА коленных суставов с поражением сосудов нижних конечностей может быть более глубокой, чем простое влияние одного заболевания на проявления другого. В предыдущей публикации мы показали, что у женщин с ОА коленных суставов шанс иметь варикознорасширенные вены нижних конечностей и проявления ХВН в 2,7 раза выше, чем у женщин того же возраста без ОА (53% против 20%, р = 0,0004)[16]. Такое накопление сочетанной патологии можно было бы объяснить высокой частотой ожирения и при ОА коленных суставов и при патологии вен, однако многофакторый регрессионный анализ показал, что после коррекции по ИМТ различия в частоте развития варикозной болезни между группами женщин с ОА и без него оставались клинически и статистически значимыми (ОШ = 2,7; p = 0,036).
Дебют варикозной болезни в среднем на 15 лет предшествовал появлению симптоматики ОА [16]. Интересно, что похожие данные о том, что клиника варикозного расширения вен развивается раньше (на 3–5 лет), чем суставной синдром, были получены ранее другими исследователями[6]. В настоящем исследовании мы также подтвердили ассоциацию и генерализованного поражения вен, и выраженной несостоятельности клапанов поверхностных вен, и их комбинации с более высоким ИМТ. Таким образом, не исключается, что ВБНК и ОА коленных суставов могут иметь общие патогенетические механизмы, и возможным связующим звеном может оказаться дисплазия соединительной ткани[17]. Одной из наших находок был более ранний дебют ОА у пациенток, имевших генерализованное поражение вен в сочетании с выраженной несостоятельностью клапанов вен нижних конечностей. Однако одномоментный дизайн нашего исследования не позволяет сделать определенный вывод о влиянии патологии вен на возникновение ОА.
ЗАКЛЮЧЕНИЕ
Необходимы проспективные исследования для более углубленного изучения ассоциации патологии вен нижних конечностей и остеоартроза коленных суставов. Ассоциация между ними существует, однако влияние патологии вен на клинические проявления патологии суставов нам подтвердить не удалось.








