Атопический дерматит (АД) — один из самых распространенных зудящих дерматозов, в особенности у детей. Согласно современным статистическим данным, заболеваемость АД в популяции развитых стран составляет 5–20% населения, а среди детей этот показатель достигает в среднем 37%[7]. Установлено, что при наличии данного заболевания у обоих родителей АД клинически манифестирует у 81% детей; если болен только один из родителей, а другой имеет аллергическую патологию дыхательных путей — у 59%; если болен только один из родителей — у 56%[4]. За последнее десятилетие наблюдается определенная тенденция к нарастанию заболеваемости АД, особенно среди детей, а также к развитию более тяжелых, непрерывно рецидивирующих форм дерматоза, протекающих с присоединением микробных осложнений, устойчивых к традиционной терапии[2].
Развитие АД связывают с воздействием экзогенных и эндогенных факторов аллергической и неаллергической природы в тот или иной период жизни пациента[7]. АД, дебютирующий в раннем детском возрасте, как правило, сопровождает больных на протяжении всей жизни и характеризуется обострениями разной степени тяжести, которые имеют тенденцию осложняться вторичной инфекцией, вызванной различной флорой[2].
Одна из важнейших функций кожи — барьерная — обеспечивает защиту организма от неблагоприятных факторов внешней среды, предохраняет от повышенной потери влаги и проникновения микроорганизмов и аллергенов. Нарушение этой функции является одним из основных факторов в развитии АД[1].
Недостаточность эпидермального барьера при АД обусловлена изменением в гене, кодирующем белок филаггрин. Лица с мутациями в данном гене предрасположены к формированию вульгарной формы ихтиоза и синдрома атопической экземы/дерматита. Термин «филаггрин» (англ. Filaggrin — filament aggregating protein) был впервые введен в 1981 г. для описания класса структурных белков, которые были выделены из рогового слоя. Филаггрин специфически взаимодействует с промежуточными филаментами, в частности с кератинами, которые образуются в клетках кожи[3]. Он действует как физический барьер, препятствующий воздействию потенциально опасных веществ из окружающей среды. Ученые выдвинули гипотезу, что мутации в гене, кодирующем белок филаггрин, могут ослаблять этот физический барьер, снижая его эффективность, и тем самым повышать риск возникновения аллергического поражения кожи[11, 14–17, 20].
Проведенный в 2009 г. метаанализ 24 исследований показал, что дефекты синтеза филаггрина (сниженная экспрессия в организме) увеличивают риск сенсибилизации, а также развития АД и аллергического ринита[19].
Еще одной причиной развития АД является низкий уровень естественного увлажняющего фактора (Natural moisturizing factor — NMF). При этом содержание в роговом слое одного из компонентов NMF — мочевины — уменьшается до 15% относительно нормы. Несостоятельность филаггрина (сниженная экспрессия) и низкий уровень мочевины в совокупности приводят к увеличению проницаемости кожного барьера и повышенной трансэпидермальной потере влаги[8].
Известно, что степень дефекта барьера при AД измеряется трансэпидермальной потерей воды (transepidermal waterloss — TEWL) на неповрежденных участках, которая коррелирует с тяжестью заболевания и уровнем IgE в сыворотке. F. Boralevi и соавт. в 2008 г. установили, что у младенцев с AД с двумя и более положительными патч-тестами значения TEWL были выше, чем у младенцев с одним или без положительного теста[10]. Исследования С. Flohr и соавт. (2010) показали, что мутации филаггрина были связаны с более высокой TEWL в клинически нормальной коже предплечья у 3-месячных младенцев вне зависимости от атопического статуса[10, 12].
В 1999 г. ученые впервые предположили, что нарушенный барьер кожи может быть первичным фактором развития АД. Последующие исследования доказали, что нарушения эпидермального барьера при АД коррелируют с тяжестью заболевания. Значение TEWL в местах с имеющимися кожными проявлениями более высокое. Однако даже в клинически чистых участках кожи показатели TEWL выше, чем у здоровых лиц[13].
Микробиота кожи больных АД существенно отличается от таковой у здоровых людей соответствующих возрастных групп как по количеству инфекционных агентов, так и по составу. Так, например, золотистый стафилококк высевается с кожи больных АД в 90% случаев, в то время как у здоровых лиц — только в 10% случаев. Рост грибов рода Candida обнаруживается при АД в 50–77%, а у здоровых — лишь в 12% случаев[6, 12].
В последние годы широко изучается роль кандидозной инфекции при АД. Candida spp. выделяют токсины, которые изменяют иммунную реактивность, повреждают стенку кишечника, конкурируют с облигатной флорой, повышая проницаемость кишечника для других токсинов.
Помимо этого, грибы рода Candida обладают сильными антигенными свойствами[9]. При воздействии грибковых антигенов происходит выработка специфических IgE, которые фиксируются на поверхности тучных клеток. При последующих контактах человека с тем же аллергеном происходят связывание аллергена со специфическими IgE и высвобождение из тучных клеток активных веществ. Медиаторы воздействуют на ткани и органы человека, что приводит к различным последствиям, например высыпаниям, зуду, сужению бронхов, затруднению дыхания или возникновению отеков[5].
По данным M. A. Shaheen и соавт., уровень специфических IgE у больных АД колеблется от 8 до 375 МE/мл (при среднем значении 70 МЕ/мл), в то время как уровень в контрольной группе здоровых лиц — от 10 до 75 МЕ/мл (в среднем 40 МЕ/мл)[18]. Показано, что содержание IgE к грибам рода Candida коррелирует со степенью тяжести АД. При легкой степени АД среднее содержание IgE составляло 46 МЕ/мл, при средней степени — 50 МЕ/мл, при тяжелой — 277 МЕ/мл[18].
Таким образом, при ведении пациентов с АД необходимо учитывать воздействие грибов рода Candida.
Цель исследования: изучение особенностей течения АД при выявленной сенсибилизации к дрожжеподобным грибам рода Candida у детей и усовершенствование на этой основе терапевтических мероприятий.
МАТЕРИАЛЫ И МЕТОДЫ
В 2015 г. под наблюдением находились 52 ребенка в возрасте от 3 до 12 лет с давностью заболевания от 2 до 10 лет. У пациентов были зарегистрированы клинические проявления АД: эритематозные пятна и нуммулярные папулы, склонные к слиянию, очаги инфильтрации и лихенизации, а также множественные экскориации и геморрагические корки на фоне выраженного ксероза кожи. Изменения преимущественно локализовались на сгибательных поверхностях конечностей, передней и задней поверхности шеи, тыле кистей. Всех больных беспокоил интенсивный зуд, усиливающийся после контакта с водой. При микроскопии материала с поверхности кожи у всех участников обнаружили дрожжеподобные грибы Candida.
Дети были рандомизированы на две группы. В группу А вошли 23 пациента со средне-тяжелым течением АД, со средним значением индекса Severity Scoring of Atopic Dermatitis (SCORAD) 27,98 ± 3,57 балла, в группу В — 29 пациентов со средне-тяжелым течением АД и средним значением индекса SCORAD 25,48 ± 4,01 балла.
Больным группы А назначали традиционную терапию: диетическое питание с ограничением употребления углеводов и продуктов, обладающих бродильным эффектом, наружно крем метилпреднизолона ацепоната 1 раз в день и эмолиент 2 раза в день. В группе B проводилась комплексная терапия: аналогичное диетическое питание, наружно эмолиент и комбинированный крем с беклометазоном и клотримазолом 2 раза в день, а также флуконазол в капсулах 50 мг 1 раз в сутки через день (на курс 7 капсул). Лечение продолжалось 4 недели.
Основными критериями назначения противогрибковой терапии являлись клинические признаки сенсибилизации к дрожжеподобным грибам (ухудшение состояния после потребления пищи, богатой углеводами, или после курса антибиотикотерапии) и обнаружение грибов рода Candida на поверхности кожи и IgE к ним в сыворотке крови.
Для объективной оценки степени тяжести АД и эффективности проводимой терапии использовали индекс SCORAD, микроскопическое исследование материала с поверхности кожи, а также субъективную оценку интенсивности зуда по 10-балльной шкале. Критериями эффективности лечения были уменьшение или полное разрешение зуда и признаков воспаления на коже, а также отсутствие дрожжеподобных грибов при микроскопическом исследовании материала, взятого с поверхности кожи.
РЕЗУЛЬТАТЫ
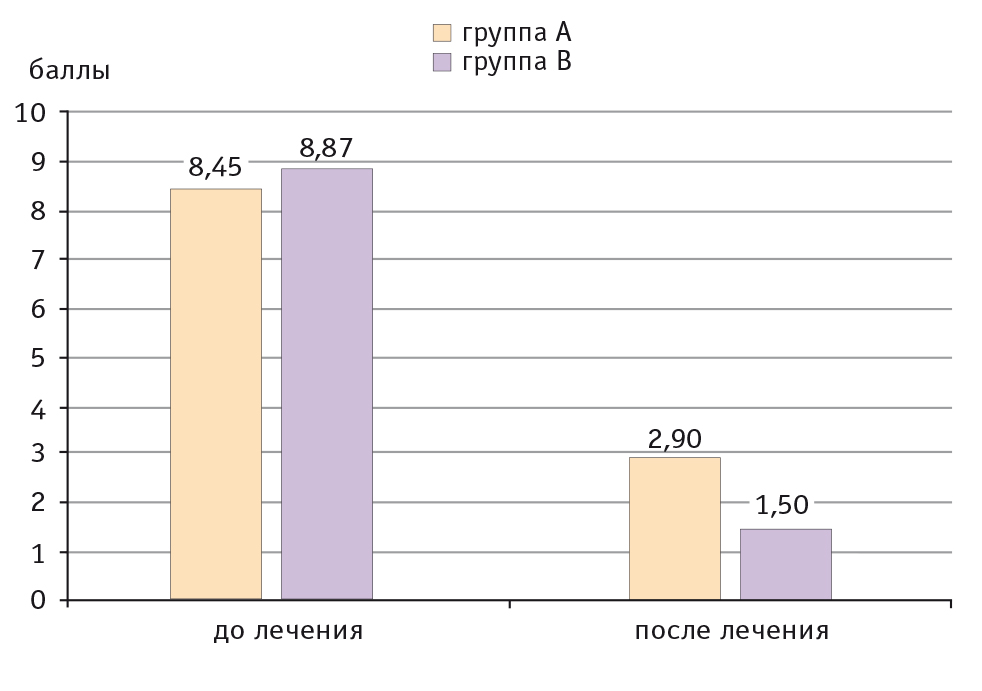
У всех пациентов в результате проведенной терапии снизилась интенсивность кожного зуда: в группе А — на 65,7%, в группе B — на 83,1% (рис. 1).
Рис. 1. Динамика интенсивности кожного зуда у детей с атопическим дерматитом, баллы
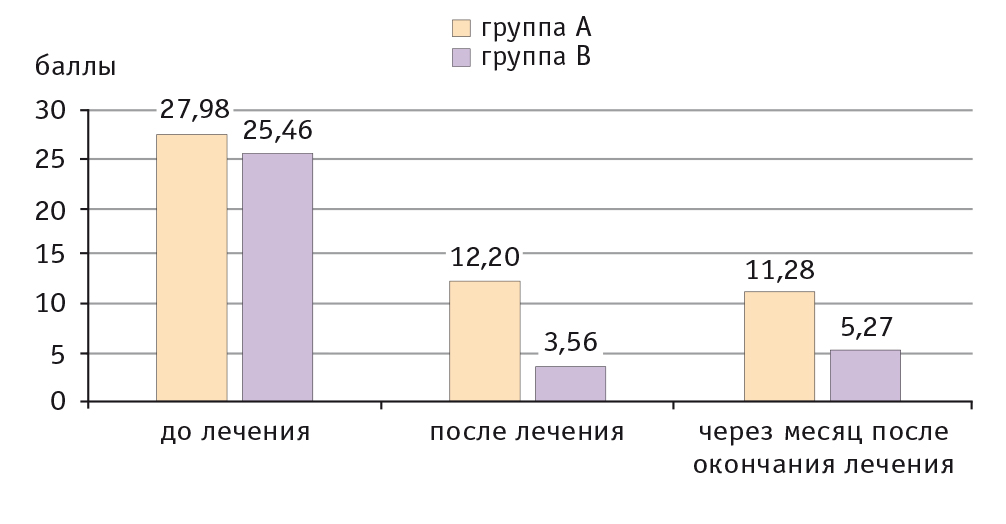
Динамика снижения индекса SCORAD в обеих группах была постепенной. Сразу после лечения его среднее значение в группе A снизилось на 56,4% относительно показателя до лечения, а в группе B — на 86,0%. Через месяц после окончания лечения индекс SCORAD в группе A снизился на 40,3%, а в группе B — на 79,3% (рис. 2).
Рис. 2. Динамика индекса Severity Scoring of Atopic Dermatitis у детей с атопическим дерматитом, баллы
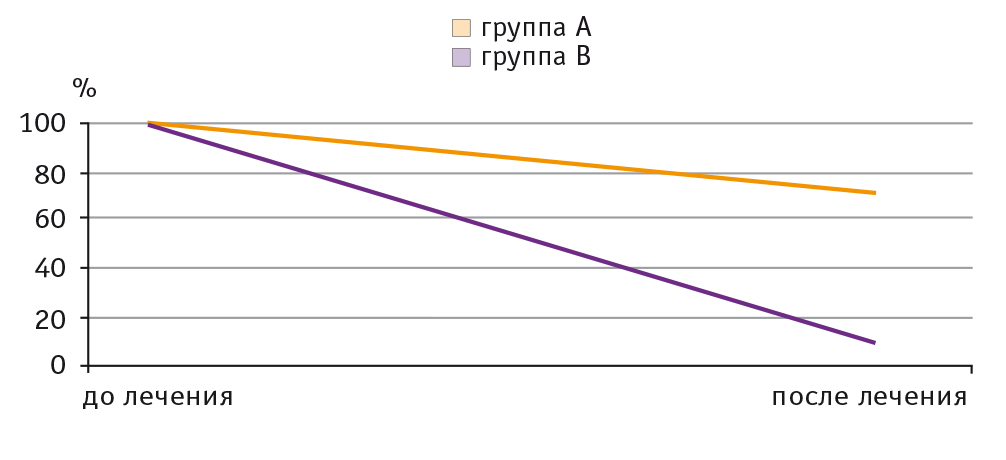
При микроскопическом исследовании материала, взятого у больных с поверхности кожи после лечения, была зарегистрирована элиминация дрожжеподобных грибов в группе А у 30,43% детей, в группе В — у 89,66% (рис. 3).
Рис. 3. Динамика показателей микроскопического исследования у детей с атопическим дерматитом, %
ЗАКЛЮЧЕНИЕ
При лечении как простой, так и осложненной формы атопического дерматита (АД) у детей необходимо всегда учитывать возможность присутствия грибковой инфекции. В связи с этим актуально включение в план лечения больных АД местных и системных антимикотических средств. Такая терапия благоприятно сказывается на общем состоянии и значительно улучшает качество жизни. Противогрибковая терапия является важным звеном в комплексном лечении детей, страдающих АД, с сенсибилизацией к дрожжевой флоре.








